高糖状态下心肌成纤维细胞Ⅰ、Ⅲ型胶原表达变化的观察
戴 斌,崔 猛,张 宏
(1.天津医科大学总医院内分泌科,天津300052;2.天津医院创伤骨科,天津300211;3.天津医科大学代谢病医院肥胖代谢科,天津300070)
糖尿病心肌病(diabetic cardiomyopathy,DC)是一种独立的、特异的糖尿病并发症,与继发于高血压、冠心病或瓣膜性心脏病的病理、生理改变不完全相同。DC是由糖代谢紊乱引起的心肌细胞原发性损伤及心肌功能障碍,其临床特征主要以左心室肥厚及心肌舒缩功能缺损为主,随着病程的进展会出现充血性心力衰竭,是糖尿病患者致残和致死的重要原因之一。临床研究发现,糖尿病患者多表现为向心性心室肥厚,可伴有左心室功能受损,心脏顺应性下降。除心肌细胞肥大外,心肌纤维化及间质重构亦是DC时心室舒缩功能障碍、心力衰竭的主要机制之一[1]。
1 材料与方法
1.1 材料 出生1~3d的SD幼鼠15只,平均体质量8.5g,购自天津医科大学动物实验中心。DMEM培养基购于美国Sigma公司。胎牛血清购于英国Gibco公司,胰蛋白酶购于美国Sigma公司,Vimentin波形蛋白单克隆抗体购于武汉博士德生物工程有限公司。Ⅰ型前胶原羧基端肽(PⅠCP)与Ⅲ型前胶原氨基端肽(PⅢNP)ELISA试剂盒购于美国BPB公司。Trizol试剂购于美国Invitrogen公司,定量PCR相关试剂购于日本TaKaRa公司,引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 细胞培养 将幼鼠处死后剪取心尖组织。DMEM洗,剪碎,Ⅱ型前胶元酶消化后收集上清液。加入10%胎牛血清,离心重悬细胞,于5%CO2、37℃孵箱中培养2h,吸去上清液,重新加入培养液,原代培养细胞生长成细胞单层。用0.25%胰蛋白酶消化以后,以1∶2比例传代培养。经3次传代后,已纯化为心肌成纤维细胞,实验选用3~5代细胞。行抗波形蛋白多克隆抗体免疫组织化学染色鉴定,结果为阳性。
1.2.2 试验分组 所有细胞共分成2组。(1)高糖组:高糖培养定义为DMEM25培养基中含葡萄糖25mmol/L;(2)对照组:正常糖DMEM5.5培养基含葡萄糖5.5mmol/L。各组细胞均刺激6、12、24h后,弃去培养液,加Trizol、氯仿,离心收集细胞沉淀。抽提总RNA,逆转录cDNA,以预先设计好的引物进行目的基因的扩增。
1.2.3 实时荧光定量PCR测6、12、24h各组细胞Ⅰ、Ⅲ型前胶原的mRNA表达 Ⅰ、Ⅲ型前胶原mRNA表达以逆转录的cDNA为模板,扩增各组细胞Ⅰ、Ⅲ型前胶原的mRNA,内参使用 GAPDH。α1(Ⅰ型)前胶原扩增的上游引物:5′-AGC CAC CAG CCC CTC ACT-3′;下游引物 5′-CGA GGT AGT CTT TCA GCA ACA CAG T-3′;扩增片断长度为160bp。α1(Ⅲ型)前胶原上游引物:5′-CAA CAC CGA TGA GAT TAT G-3′;下游引物:5′-TCA GGA TTG CCG TAG C-3′;扩增片断长度为344bp。GAPDH 上游引物:5′-GGG GTG ATG CTG GTG CTG AG-3′,下游引物5′-GAT GCA GGG ATG ATG TTC TG-3′扩增片段370bp。反应条件:逆转录65℃10 min,25℃5min;预变性94℃4min;循环94℃30s:50℃退火30s:72℃延伸40s;共40个循环。
1.2.4 酶联免疫吸附测定法(ELISA)测各组细胞24、48、72h 3个时间点的Ⅰ、Ⅲ型胶原蛋白的表达 Ⅰ与Ⅲ型胶原蛋白表达由PⅠCP与PⅢNP决定,根据ELISA试剂盒说明操作以检测PⅠCP与PⅢCP的表达。
1.3 统计学处理 采用SPSS11.5统计软件进行分析。结果取均值,计量资料以±s表示。各组间均数的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组细胞Ⅰ型胶原表达比较 与对照组比较,高糖组细胞经高糖培养后Ⅰ型前胶原mRNA表达显著上升,呈时间依赖性,培养12h后升高,差异有统计学意义(P<0.05),24h达高峰;Ⅰ型胶原蛋白表达在24h升高,但差异无统计学意义(P>0.05),在48h升高达峰值,差异有统计学意义(P<0.05),在72h有所降低,与对照组比较升高仍差异有统计学意义(P<0.05),见图1、2。
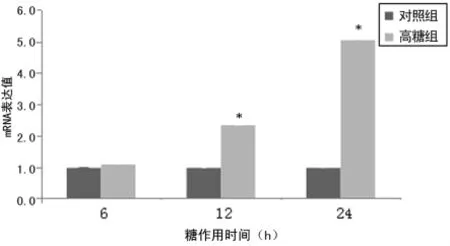
图1 两组细胞Ⅰ型前胶原mRNA表达比较
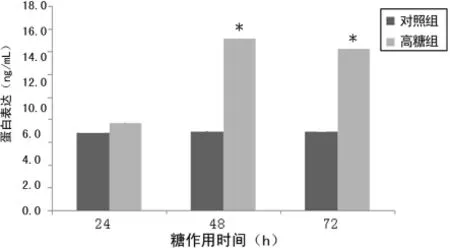
图2 两组细胞Ⅰ型胶原蛋白表达比较
2.2 两组细胞Ⅲ型胶原表达比较 与对照组比较,高糖组细胞经高糖培养后Ⅲ型前胶原mRNA表达呈时间依赖性上升,12h升高差异有统计学意义(P<0.05),24h升高达高峰(图3)。高糖刺激胶原的mRNA表达升高,Ⅰ型胶原mRNA升高幅度较Ⅲ型胶原明显。与对照组比较,高糖组Ⅲ型胶原蛋白表达呈时间依赖性上升,24h升高但差异无统计学意义(P>0.05),48h明显升高差异有统计学意义(P<0.05),72h达高峰(图4)。与对照组比较,48h时Ⅰ型胶原蛋白升高幅度较Ⅲ型胶原明显。
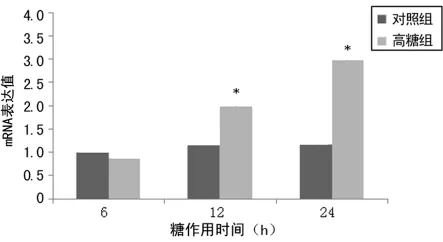
图3 两组细胞Ⅲ型前胶原mRNA表达比较
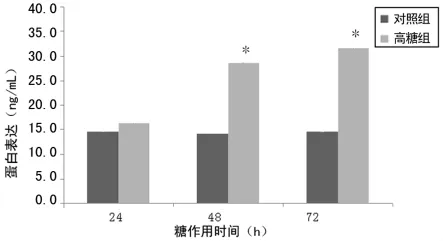
图4 两组细胞Ⅲ型胶原蛋白表达比较
3 讨 论
糖尿病是一种威胁全人类健康的疾病,发病率逐年增加。而糖尿病目前已被视为冠心病的等危症,因为糖尿病显著升高心血管疾病的发病率和死亡率。有研究发现,糖尿病患者并发冠心病是非糖尿病患者的4倍。然而,糖尿病导致冠心病的发生是多因素、多途径的,其具体机制目前尚未完全明确。糖尿病动物模型和临床研究发现糖尿病心脏心肌细胞显著肥大、细胞外基质增加、心脏纤维化和舒缩功能减退,导致心室壁僵硬度增加,呈现类似限制性心肌病样的改变[2-5]。
心肌成纤维细胞是心脏组织中数目最多的细胞,遍布于心肌组织,包绕心肌细胞并连接细胞间质[6-7]。心肌成纤维细胞是心肌纤维化的主要效应细胞,其过度增殖,胶原分泌增加在心肌纤维化发生、发展中起着重要作用。高血糖是导致心肌纤维化及间质重构的重要因素,有研究表明,糖基化终末产物可诱导心肌成纤维细胞增殖[8-9]。高血糖可通过多种途径促使心脏纤维化[10-12],其机制包括暂时或持续的促进成纤维细胞增殖和增加成纤维细胞外基质的产生。其信号调节机制复杂。深入探索高糖诱导心肌纤维化的分子机制对防治糖尿病心肌病的进行性发展具有重要意义。
心肌成纤维细胞是心脏分泌胶原的主要细胞,是维持心脏生理和病理性重塑的主要调节因素[13-15]。本实验观察到高糖培养鼠心肌成纤维细胞,可促进Ⅰ、Ⅲ型胶原mRNA和蛋白表达显著上升,表明心肌成纤维细胞的胶原合成在转录和翻译后水平进行。高糖刺激鼠心肌成纤维细胞Ⅰ、Ⅲ型胶原增殖并呈时间依赖性,培养12hmRNA即升高,而蛋白在48h明显升高,蛋白延后于mRNA水平的升高表明了反应的连续性和顺序性。高糖刺激胶原mRNA表达升高,Ⅰ型胶原mRNA升高幅度较Ⅲ型胶原明显。Ⅲ型胶原蛋白表达呈时间依赖性上升,24h升高但差异无统计学意义(P>0.05),48h明显升高差异有统计学意义(P<0.05),72h达高峰。48h时Ⅰ型胶原蛋白升高幅度较Ⅲ型胶原明显。
高糖促进胶原合成,从而促进纤维化。本研究证实高糖可以促进大鼠心肌成纤维细胞增殖,Ⅰ、Ⅲ胶原mRNA及蛋白表达增多,Ⅰ型胶原升高幅度较Ⅲ型胶原明显。其具体上下游信号通路有待进一步研究。
[1] Avogaro A,Vigili de Kreutzenberg S,Negut C,et al.Diabetic cardiomyopathy:a metabolic perspective[J].Am J Cardiol,2004,93(8A):13-16.
[2] Depre C,Young ME,Ying J,et al.Streptozotocin-induced changes in cardiac gene expression in the absence of severe contractile dysfunction[J].J Mol Cell Cardiol,2000,32(6):985-996.
[3] Mazumder PK,O′neill BT,Roberts MW,et al.Impaired cardiac efficiency and increased fatty acid oxidation in insulin-resistant ob/ob mouse hearts[J].Diabetes,2004,53(9):2366-2374.
[4] Young ME,Guthrie PH,Razeghi P,et al.Impaired longchain fatty acid oxidation and contractile dysfunction in the obese Zucker rat heart[J].Diabetes,2002,51(8):2587-2595.
[5] Wang RP,Qian YJ,Chen ML.The clinical and pathdogical findings ofdiabetic heart disease in the aged[J].Chin J InternaI Med,1998,37(10):677-679.
[6] 郝嘉,游凯.心肌成纤维细胞的特性和调节[J].心血管病学进展,2011,32(3):405-408.
[7] Souders CA,Bowers SL,Baudino TA.Cardiac fibroblast:the Renaissance cell[J].Circ Res,2009,105(12):1164-1176.
[8] 李洁,刘乃丰,魏芹.罗格列酮抑制糖基化终产物诱导心肌成纤维细胞增殖和结缔组织生长因子及Smad的表达[J].中华内分泌代谢杂志,2010,26(6):479-483.
[9] Yamagishi S,Nakamura K,Matsui T,et al.Receptor for advanced glycation end products(RAGE):a novel therapeutic target for diabetic vascular complication[J].Curr Pharm Des,2008,14(5):487-495.
[10]Falcão-Pires I,Palladini G,Gonçalves N,et al.Distinct mechanisms for diastolic dysfunction in diabetes mellitus and chronic pressure-overload[J].Basic Res Cardiol,2011,106(5):801-814.
[11]赵树梅,沈潞华,李虹伟,等.吡格列酮下调高糖培养的心肌成纤维细胞促纤维化因子表达[J].临床心血管病杂志,2009,25(3):223-226.
[12]Lee YJ,Kim JS,Kang DG,et al.Buddleja officinalis suppresses high glucose-induced vascular smooth muscle cell proliferation:role of mitogen-activated protein kinases,nuclear factor-kappaB and matrix metalloproteinases[J].Exp Biol Med,2010,235(2):247-255.
[13]Mir SA,Chatterjee A,Mitra A,et al.Inhibition of signal transducer and activator of transcription 3(STAT3)attenuates interleukin-6 (IL-6)-induced collagen synthesis and resultant hypertrophy in rat heart[J].J Biol Chem,2012,287(4):2666-2677.
[14]邹平,吴立玲,吴丹,等.高糖促进成年大鼠心脏成纤维细胞periostin表达及其信号转导机制[J].生理学报,2010,62(3):247-254.
[15]Wu W,Muchir A,Shan J,et al.Mitogen-activated protein kinase inhibitors improve heart function and prevent fibrosis in cardiomyopathy caused by mutation in lamin A/C gene[J].Circulation,2011,123(1):53-61.

