骨形成蛋白-2在上颌骨快速牵引骨愈合中的作用*
姚玉胜,王程越,王桂君
(1.辽宁医学院附属第二医院口腔颌面外科,辽宁锦州121000;2.辽宁省锦州市中心医院修复科,辽宁锦州121000;3.辽宁医学院药学系,辽宁锦州121000)
作为一种创伤小、出血少的治疗骨缺损及畸形新技术,经骨缝牵引成骨术已引起各科医生的重视[1]。Liu等[2]以兔为实验对象发现,重组人骨形成蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2)对骨缝及周围组织的改建有较明显促进作用。范伟等[3]也认为BMP-2单独应用即有较强的诱导成骨活性。为继续探索快速弹性牵引中骨形成蛋白(bone morphogenetic protein,BMP)对扩张骨缝作用,本研究建立了犬腭横缝牵引模型,探讨当牵引力大于800g后加入缓释rhBMP-2对骨质改建的影响。
1 材料与方法
1.1 材料 实验动物:选取4~5个月健康杂种犬36只,体质量(3.72±1.35)kg,由辽宁医学院动物中心提供。牵引器:由不锈钢滑道和作用距离为30mm(初始作用力为400、600、800 g)的形状镍钛记忆合金组成,由北京有色金属研究所提供。内水相:rhBMP-2 10mg加入适量盐酸胍溶液溶解后,取100μL与少量牛血清清蛋白混匀形成,由解放军军事医学科学院提供;油相:聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA),由山东医疗器械研究所提供;外水相:含1%PVA聚乙烯醇、0.5%吐温-20,由北京化学试剂公司提供。纤维蛋白胶(fibrin sealant,FS),由杭州普济公司提供;兔抗鼠 BMP-2、BMP-4、BMP-7多克隆抗体,由博士德公司提供;生物素化山羊抗兔IgG,由博士德公司提供。
1.2 方法
1.2.1 rhBMP-2缓释胶囊制作 将初乳与10mL外水相经800r/min离心4h,过滤,蒸馏水洗涤,真空冻干,形成rhBMP-2/PLGA缓释微球,4~8℃保存。实验时分别将缓释微球与FS的主体胶和粉剂相溶,制成主体胶混悬液和催化剂溶液。二者按1∶1比例通过双管注射器于术后5d注入牵引区附近黏膜下。
1.2.2 实验动物分组及手术操作 将36只健康杂种犬随机分为对照组(n=4)和实验组(32)只,实验组又分为400g组(n=8)、600g组(n=8)、800g组(n=8)、800g+rhBMP-2组(联合组)(n=8)。实验组采用3%戊巴比妥钠(0.1mg/kg)静脉注射麻醉,术前15min阿托品0.01mg/kg肌内注射,先截除尖牙牙冠后行根管治疗。无菌条件下在硬腭中线纵行6cm切口,剥离子翻瓣,找到腭横缝后,电钻钻孔将滑道后板用微型螺钉固定于腭横缝后缘。在腭横缝前测量相应位置后钻孔,分别固定400、600、800g镍钛合金丝及滑杆。镍钛合金固定于腭横缝两侧,通过滑道限制牵引丝扩张方向,可以将两侧骨板按预定轨迹相背移动。牵引5d后通过双管注射器将rhBMP-2/PLGA缓释微球与FS注入联合组动物的牵引区黏膜下。对照组不处理。术后肌内注射青霉素40万μ,共4d。每周拍X线片,以确定上颌骨位移及牵引器固定情况。
1.2.3 标本采集及制作 术后1、2、4、8周以过量麻药处死各实验组动物2只,对照组1只。先行头颅CT横断扫描,扫描区间自外耳道至尖牙区。解剖腭骨剔除软组织后,组织块固定于10%中性甲醛中,5.5%乙二胺四乙酸(EDTA)脱钙3周,脱水、包埋。免疫组织化学染色60℃烤片过夜,一抗采用兔抗鼠BMP-2、BMP-4、BMP-7多克隆抗体,二抗为生物素化山羊抗兔IgG。按说明书完成免疫组织化学染色,PBS代替一抗作阴性对照。
1.3 统计学处理 采用SPSS11.5软件进行统计分析,数据以±s表示,各组间比较行χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床观察 术中800g组1只犬死亡,给予补充,余均健康,牵引器固定完好。各组术后颅底上牙槽座角(∠SNA)自131°增大至140°±4°(表1)。颅底下牙槽座角(∠SNB)无明显变化,维持在128°左右,各标志点见图1、2。为排除其他影响因素,解剖颅骨标本后按Yao等[4]颅骨各标志点以游标卡尺(E0512)测量(图3),结果显示实验组上颌成功前徙,以600g及联合组明显(表2)。头颅CT扫描显示,各牵引组腭骨水平板均变薄,骨密度显著下降,以800g组(图4)明显,在注射rh-BMP-2后(图5)明显改善,见表3。
2.2 免疫组织化学染色结果 BMP-2(图6)、BMP-4(图7)、BMP-7(图8)阳性染色主要定位于成骨细胞、成纤维细胞及骨细胞细胞质中,细胞以形态学鉴定,其中成骨细胞染色较深。经Image pro plus软件的intensity校正及测量过滤分析,BMP-2、BMP-4 的 累 积 光 密 度 值 (integrated optical density,IOD)值在2周内达到峰值,之后逐渐下降至正常水平。BMP-7则处于低表达状态,但800g在注射rhBMP-2后有所增强,见表4~6。
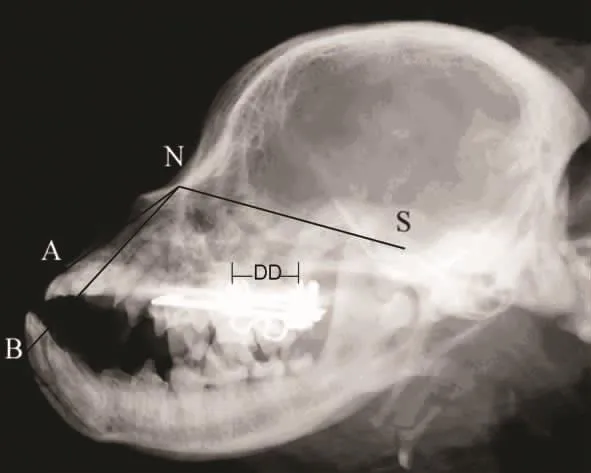
图1 400g组牵引2周头影测量及各标志点
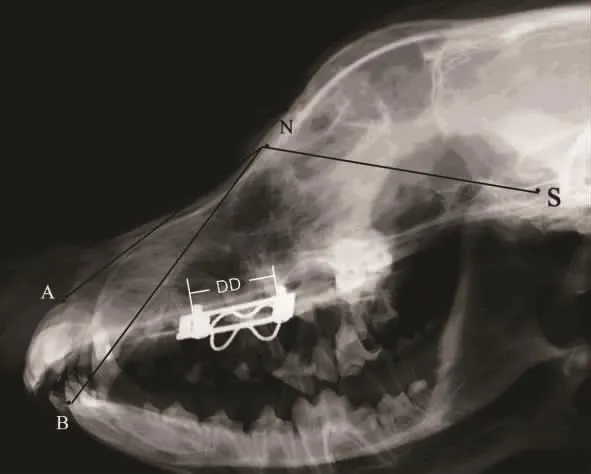
图2 600g组牵引2周头影测量及各标志点
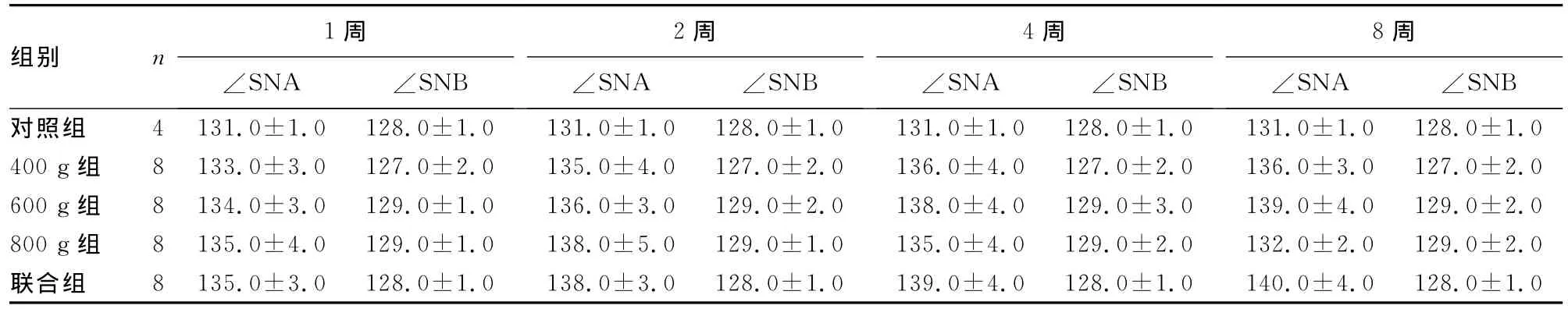
表1 各组∠SNA、∠SNB测量结果比较(
表2 各组上颌骨前移结果比较(±s,mm)

表2 各组上颌骨前移结果比较(±s,mm)
OI:枕髁中点与中切牙颈部中点距离;OC:枕髁中点与尖牙颈部中点距离;DD:腭横缝两侧固定螺钉间距离;-:此项无数据。
组别 n OI OC DD 4 1.0±0.2 0.8±0.1 - - -400g组 8 16.6±2.8 16.1±2.8 17.8±4.0 0.42 <0.05 600g组 8 25.3±5.2 19.5±3.3 22.9±5.2 1.21 <0.05 800g组 8 12.1±2.3 12.5±4.9 12.5±2.4 1.46 >0.05联合组 8 24.2±3.4 23.8±4.6 23.8±4.2 1.28 <t P对照组0.05
表3 CT检测各组腭骨水平板骨密度值比较(±s,HU)

表3 CT检测各组腭骨水平板骨密度值比较(±s,HU)
*:P<0.05,与对照组同时间比较。
时间 对照组(n=4) 400g组(n=8) 600g组(n=8) 800g组(n=8) 联合组(n=8)第1周 1 235.6±96.0 881.5±81.9 724.7±99.0 294.3±240.7*892.9±86.6第2周 1 255.7±109.3 929.4±103.3 715.8±84.9 317.8±185.5* 1 001.8±95.4第4周 1 260.9±88.3 911.9±71.6 759.6±90.9 349.0±181.0* 1 060.7±79.1第8周 1 235.1±100.2 930.9±75.4 839.0±92.0 377.9±160.0*1 158.0±93.0
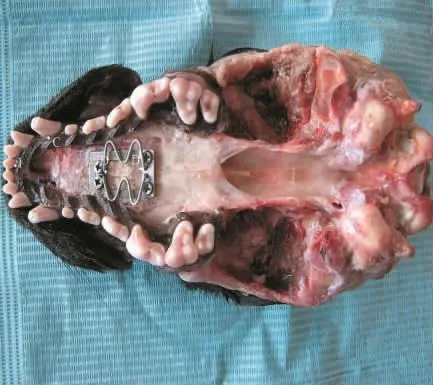
图3 牵引器固定位置及各标志点
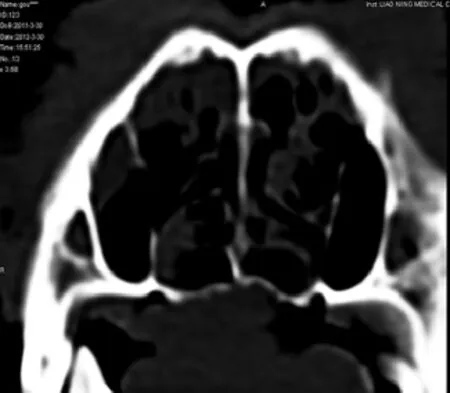
图4 800g组牵引8周后腭骨水平板密度图像
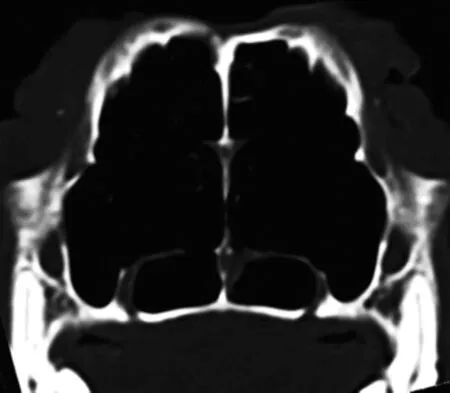
图5 联合组(8周)腭骨水平板骨密度图像
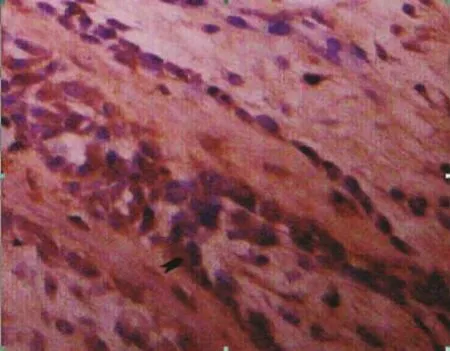
图6 400g组牵引2周时BMP-2细胞形态(箭头示成骨细胞,×200)
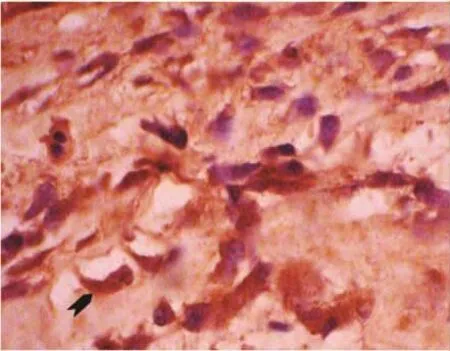
图7 600g组牵引4周时BMP-4细胞形态(箭头示成纤维细胞,×400)

图8 800g组牵引8周时BMP-7细胞形态(箭头示骨细胞,×200)
表4 各组免疫组织化学染色BMP-2IOD值结果(±s)

表4 各组免疫组织化学染色BMP-2IOD值结果(±s)
*:P<0.05,与对照组比较。
组别 n 1周 2周 4周 8周45.0 18 725.0±2 027.0 400g组 8 24 055.0±2 827.0 32 917.0±2 164.0 21 803.0±2 908.0 19 316.0±1 308.0 600g组 8 35 100.0±2 069.0* 61 119.0±3 182.0* 29 507.0±2 508.0 20 135.0±2 128.0 800g组 8 36 463.0±3 159.0* 81 604.0±3 425.0* 20 457.0±2 217.0 17 076.0±2 015.0联合组 8 62 337.0±3 274.0* 99 038.0±4 825.0* 38 546.0±3 275.0*对照组 4 19 867.0±1 725.0 20 390.0±1 842.0 19 231.0±1 8 32 082.0±2 541.0
表5 各组免疫组织化学染色BMP-4IOD值结果(±s)

表5 各组免疫组织化学染色BMP-4IOD值结果(±s)
*:P<0.05,与对照组比较。
组别 n 1周 2周 4周 8周36.0 18 925.0±2 342.0 400g组 8 24 045.0±2 168.0 31 806.0±2 049.0 21 937.0±3 725.0 20 715.0±2 457.0 600g组 8 35 009.0±3 046.0* 61 008.0±2 684.0* 30 782.0±2 557.0 21 483.0±2 506.0 800g组 8 38 451.0±3 846.0* 81 572.0±2 973.0* 20 663.0±1 976.0 17 626.0±1 685.0联合组 8 77 832.0±4 145.0* 43 479.0±3 016.0*对照组 4 17 684.0±1 513.0 18 346.0±2 026.0 17 432.0±1 7 29 845.0±2 160.0 21 974.0±2 827.0
表6 各组免疫组织化学染色BMP-7IOD值结果(±s)

表6 各组免疫组织化学染色BMP-7IOD值结果(±s)
组别 n 1周 2周 4周 8周57.0 24 989.0±2 108.0 400g组 8 11 327.0±2 150.0 15 395.0±1 957.0 21 145.0±2 052.0 26 703.0±1 827.0 600g组 8 12 598.0±1 846.0 18 668.0±2 017.0 21 478.0±2 072.0 28 167.0±1 974.0 800g组 8 13 415.0±1 268.0 17 167.0±2 249.0 15 786.0±1 618.0 24 816.0±1 853.0联合组 8 23 740.0±1 827.0 26 179.0±2 035.0 27 103.0±2 6对照组 4 27 341.0±3 127.0 24 586.0±2 826.0 25 573.0±1 9 39.0 25 704.0±1 893.0
3 讨 论
牵引成骨术已广泛应用于颅颌面畸形治疗,尤其是颌骨畸形较重,正颌手术无法达到预期效果的患者。缺点是存在截骨创伤及较长治疗期,这对患者均有一定心理上影响[5-6]。21世纪初,有研究先后提出采用经骨缝牵引修复颌骨畸形的观点,无需截骨,创伤减小,在临床上也取得了较好的治疗效果[7-9]。本实验根据前期成果[10],利用镍钛合金形状记忆特性制作“M”形牵引丝,通过滑道后板及滑杆固定于腭横缝两侧,以限制牵引丝扩张方向,使上颌骨按预定轨迹相背移动,自行扩张骨缝。手术植入牵引器仅需10~20min,操作简化。各标志点测量结果显示,颅底∠SNA随牵引逐渐增大,颅底∠SNB没有改变。说明新研制牵引器能有效前移上颌骨复合体,没有扭转颌骨等不良结果。但骨缝牵引仍有牵引成骨缺点即治疗周期长,往往需要6个月甚至1年以上固定期。为缩短治疗期,本研究试用3种不同牵引力,期望找到最佳力值,即可快速扩张骨缝,又不致因力值过大造成对骨缝不可复性损伤。实验中发现牵引力越大,上颌骨前移越明显,但超过800g后上颌骨前期前徙虽然较快,后期明显减慢。CT检测也显示800g组骨密度值降低明显(317.8±185.5)HU,因此,本研究认为,当牵引力大于800g后对生长期犬骨缝有一定损伤,甚至影响其后期生长发育。为达到快速牵引目的,在采用800g牵引力同时加入rhBMP-2,以改善因机械力过大对骨缝及周围组织的负面影响。结果表明,∠SNA并未因采用800g力而减小,上颌骨平均前徙距离也超过600g,平均骨密度值也明显增高。说明rhBMP-2在促进骨形成,修复因过大牵引力对骨缝组织损伤方面起到重要作用。
机械牵引力可以刺激和保持骨组织再生与生长,在这个过程中各种生长因子起到至关重要作用,其中BMP是公认的最重要调节因子之一[11-12]。免疫组织化学染色显示 BMP-2、BMP-4阳性染色主要定位在成骨细胞、成纤维细胞及骨细胞细胞质中,于牵引2周内达到峰值,以800g组增高明显。说明牵引力与BMP-2、BMP-4的活性相关,牵引力越大,活性越强。同时也说明这些细胞的BMP-2、BMP-4受体在整个牵引期处于活跃状态。2周后IOD值则急剧下降,可能是弹性牵引力已大幅下降,如需继续延长骨长度,则需要更换牵引器。BMP-7染色一直处于低表达状态,在注射rhBMP-2后表达明显增强。说明rhBMP-2不仅可单独促进骨质改建,而且有调节BMP-7表达的作用。
骨质改建是一个精确平衡过程,控制或改变任一因素皆有可能导致骨量的增加[13]。针对经骨缝牵引成骨治疗周期长的缺点,本研究选择了力值较大的800g牵引力以加快牵引进程,同时注入促进骨质生成的rhBMP-2,以对抗机械力过大造成骨缝损伤,实验结果理想。
[1] Liu C,Liu C,Gao Q,et al.Transsutural distraction osteo-genesis versus osteotemy distraction osteogenesis[J].J Craniofac Surg,2012,23(2):464-471.
[2] Liu SS,Opperman LA,Buschang PH.Effects of recombinant human bone morphogenetic protein-2on midsagittal sutural bone formation during expansion[J].Am J Orthod Dentofacial Orthop,2009,136(6):768.e1-8.
[3] 范伟,张弓,安洪,等.hBMP2和hVEGF165双基因修饰组织工程骨的构建及检测[J].重庆医学,2010,39(24):3317-3319.
[4] Yao Y,Wang G,Wang Z,et al.Synergistic enhancement of new bone formation by recombinant human bone morphogenetic protein-2and osteoprotegerin in trans-sutural distraction osteogenesis:apilot study in dogs[J].J Oral Maxillofac Surg,2011,69(11):e446-455.
[5] 王兴,伊彪,梁成,等.内置式颌骨牵引器的研制及临床研究[J].中华口腔医学杂志,2002,37(2):145-147.
[6] Marchac AC,Arnaud E.Cranium and midface distraction osteogenesis:current practices.Controversies,and future applications[J].J Craniofac Surg,2012,23(1):235-238.
[7] Mccarthy JG.Sutural expansion osteogenesis for management of the Bony-Tissue defect in cleft palate repair:experimental studies in Dogs[J].Plast Reconstr Surg,2000,105(6):2026-2027.
[8] Graewe FR,Morkel JA,Hartzenberg HB,et al.Midface distraction without osteotomies in an infant with upper respiratory obstruction[J].J Craniofac Surg,2008,19(6):1603-1607.
[9] Park DH,Yoon SH.The trans-sutural distraction osteogenesis for 22cases of craniosynostosis:a new,easy,safe,and efficient method in craniosynostosis surgery[J].Pediatr Neurosurg,2011,47(3):167-175.
[10]姚玉胜,柳春明,常世民,等.生长期犬上颌骨缝牵张的实验研究[J].口腔颌面修复学杂志,2008,34(2):81-84.
[11]Yang JH,Kim HJ,Kim SE,et al.The effect of bone morphogenic protein-2-coated tri-calcium phosphate/hydroxyapatite on new bone formation in a rat model of femoral distraction osteogenesis[J].Cytotherapy,2012,14(3):315-326.
[12]刘道华,夏德林.细胞生长因子诱导骨髓基质干细胞成骨的研究进展[J].重庆医学,2010,39(2):244-246.
[13]Fang TD,Salim A,Xia W,et al.Angiogenesis is required for successful bone induction during distraction osteogenesis[J].J Bone Miner Res,2005,20(7):1114-1124.

