代谢综合征与颅内外动脉狭窄的相关性分析*
俞明明,崔 敏,李 瑞,尹泽钢,周华东
(第三军医大学大坪医院野战外科研究所神经内科,重庆400042)
颅内外动脉粥样硬化是引起颅内、外动脉狭窄的主要原因,而颅内、外动脉狭窄与缺血性脑卒中的发生密切相关。早期检测和控制颅内、外动脉狭窄的发生、进展,能够降低缺血性脑血管疾病的发生。腹型肥胖、高血压、糖代谢异常及脂代谢紊乱等单一危险因素对颅内、外动脉狭窄发生进展的影响已经阐述得比较清楚,而多个危险因素的聚集状态,即代谢综合征(metabolic syndrome,MetS)与颅内、外动脉狭窄的关系少见报道[1-4]。与B超仅能检测颈动脉狭窄情况相比,CT血管成像(CTA)能同时检测颅内、外动脉狭窄情况。因此,本研究采用CTA检测颅内、外动脉狭窄情况,探讨MetS与颅内、外动脉狭窄的关系,以便及时干预MetS的进展,延缓颅内、外动脉狭窄的发生进展,从而减少缺血性脑血管事件的发生。
1 资料与方法
1.1 一般资料 连续收集2012年6~12月在大坪医院野战外科研究所神经内科住院并行CTA检查的年龄大于或等于50岁的患者736例,其中男354例,女382例;平均年龄(66.80±9.20)岁。排除由动脉夹层、动脉炎和肌纤维发育不良等所致的非动脉硬化性颅内、外动脉狭窄。MetS诊断依据2007年《中国成人血脂异常防治指南》制订的MetS诊断标准[5],具备以下的3项或更多:(1)腹型肥胖,腰围男性大于90cm,女性大于85cm;(2)血三酰甘油(TG)≥1.70mmol/L;(3)血高密度脂蛋白胆固醇(HDL-C)<1.04mmol/L;(4)血压大于或等于130/85mm Hg;(5)空腹血糖(FBG)≥6.10mmol/L或糖负荷后2h血糖大于或等于7.80mmol/L或有糖尿病史。按照上述MetS诊断标准将患者分为两组,MetS组216例,男106例,女110例,平均年龄(67.49±9.62)岁;非 MetS组520例,男248例,女272例,平均年龄(66.46±8.99)岁。两组患者的年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 危险因素评估 所有患者均在入院后检测收缩压(SBP)、舒张压(DBP),测量身高、体质量、腰围,并计算体质量指数(BMI)。高血压定义为SBP≥140mm Hg和(或)DBP≥90mm Hg,或既往诊断为高血压并接受治疗。次日凌晨空腹状态(至少8h无热量摄入)抽取静脉血,检测FBG、糖化血红蛋白(HbA1c)、总胆固醇(TC)、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)。高脂血症定义为LDL-C≥4.27mmol/L或正接受降脂药物治疗。2型糖尿病定义为FBG≥7.00mmol/L或既往诊断为2型糖尿病并接受降血糖治疗。入院前1年内规则吸烟的患者定义为当前吸烟者。
表1 两组患者FBG及血脂相关指标比较(±s,mmol/L)
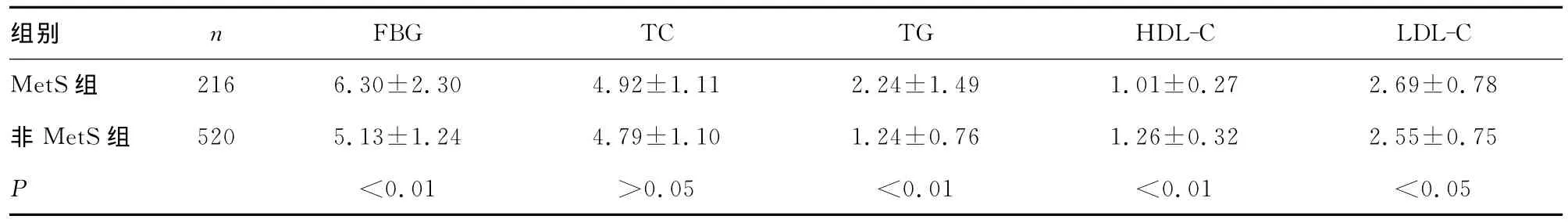
表1 两组患者FBG及血脂相关指标比较(±s,mmol/L)
组别 n 2.69±0.78非 MetS组 520 5.13±1.24 4.79±1.10 1.24±0.76 1.26±0.32 2.55±0.75 P<0.01 >0.05 <0.01 <0.01 <0.05 FBG TC TG HDL-C LDL-C MetS组 216 6.30±2.30 4.92±1.11 2.24±1.49 1.01±0.27
表2 两组患者BMI及腰围等指标比较(±s)

表2 两组患者BMI及腰围等指标比较(±s)
组别 n BMI(kg/m2) 腰围(cm) SBP(mm Hg) DBP(mm Hg) HbA1c(%)4±10.56 6.83±1.33非 MetS组 520 22.85±3.72 80.91±8.53 132.73±16.18 79.93±10.01 6.06±0.82 P<0.01 <0.01 <0.01 <0.01 <0.01 MetS组 216 25.47±3.23 89.70±7.94 138.97±16.48 82.3
1.2.2 CTA检查及影像学分析 所有患者均行头颈部CTA检查。CTA检查采用GE Lightspeed 64层螺旋CT机。患者仰卧,先常规对全脑进行平扫,范围从下颌角水平至颅顶,再从肘正中静脉高压注射碘海醇100mL(300mg/mL,注射速率3 mL/s),延迟16~21s行动脉期增强扫描。扫描参数:电压为120kV,电流为350mA,层厚为2.50mm,层间距为1.25 mm,螺距为0.875,重建层厚为0.625mm,间距 为0.625 mm。根据病变需要分别将动脉期和(或)静脉期扫描原始数据送到ADW4.2工作站上采用层厚1.25mm,螺距1.00,矩阵512×512进行最大密度投影(MIP)、容积再现(VR)及多平面重建(MPR)。颅内动脉狭窄定义为大脑中动脉(MCA)、大脑前动脉(ACA)、大脑后动脉(PCA)、基底动脉(VA)、颈内动脉颅内段和椎动脉颅内段主干血管内径狭窄大于或等于30%。颅内动脉狭窄率参照华法林-阿司匹林症状性颅内动脉狭窄临床试验(WASID试验)测量标准[6]计算。颅外动脉狭窄定义为颈内动脉颅外段、椎动脉颅外段和颈总动脉血管内径狭窄大于或等于30%。颅外动脉狭窄率参照北美症状性颈动脉内膜切除术试验(NASCET)测量标准[7]计算。
1.3 统计学处理 所有数据应用SPSS18.0统计软件进行分析。计量资料采用±s表示,两组间均数比较采用独立样本t检验。计数资料以频数和百分比表示,采用χ2检验。采用单因素和多因素Logistic回归模型分析MetS与颅内、颅外动脉狭窄的关系。所有统计均采用双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床生化特征的比较 与非MetS组比较,MetS组患者的BMI、腰围、SBP与DBP显著升高(P<0.01)。FBG、HbA1c、TG及LDL-C在 MetS组中显著高于非 MetS组(P<0.01),而 HDL-C则显著低于非 MetS组(P<0.01)。两组间TC差异无统计学意义(P=0.14)。MetS组患者高血压、糖尿病和高脂血症的发生率均显著高于非MetS组患者(P<0.01),而两组间吸烟的发生率差异无统计学意义(P=0.07),见表1~3。
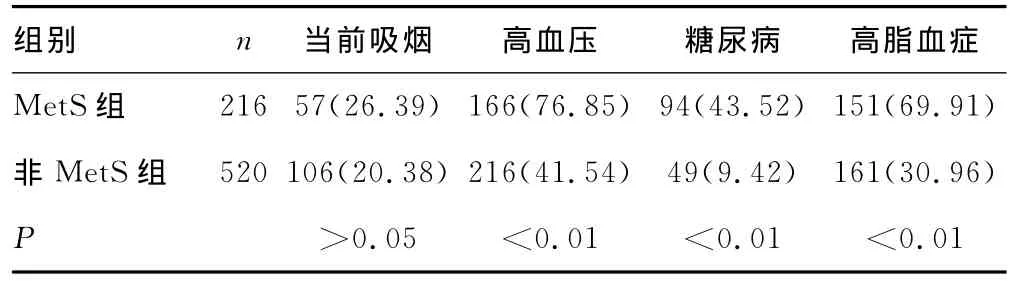
表3 两组患者高血压及糖尿病等发生率比较[n(%)]
2.2 两组患者颅内、外动脉狭窄情况的比较 MetS组患者中发生颅内动脉狭窄100例(46.30%),非 MetS组患者中发生颅内动脉狭窄144例(27.69%),两组患者颅内动脉狭窄的发生率比较,差异有统计学意义(P<0.01)。MetS组患者中发生颅外动脉狭窄73例(33.80%),非 MetS组患者中发生颅外动脉狭窄103例(19.81%),两组患者颅外动脉狭窄的发生率比较,差异有统计学意义(P<0.01)。
2.3 MetS与颅内、外动脉狭窄单因素和多因素Logistic回归分析 以MetS为自变量,分别以颅内动脉狭窄和颅外动脉狭窄为因变量行Logistic回归分析。单因素Logistic回归分析显示MetS、年龄、性别、吸烟、高血压病、糖尿病与颅内、颅外动脉狭窄均显著相关(P<0.01),而高脂血症与颅内、颅外动脉狭窄均无显著相关性(P值分别为0.95、0.44)。多因素Logistic回归分析显示MetS与颅内动脉狭窄独立相关(OR=1.84,95%CI:1.08~2.56,P<0.01),而与颅外动脉狭窄不独立相关(OR=1.13,95%CI:10.73~1.75,P=0.58)。年龄、吸烟、高血压、糖尿病与颅内、颅外动脉狭窄均独立相关(P<0.01),而性别与颅内、颅外动脉狭窄均不独立相关(P值分别为0.15、0.53),见表4、5。
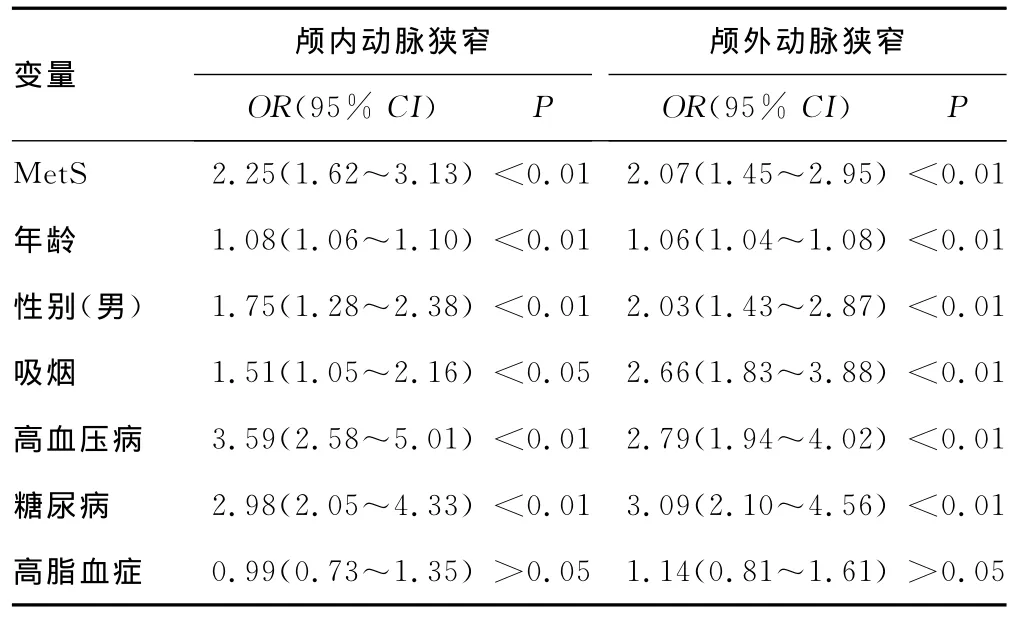
表4 MetS与颅内、外动脉狭窄的单因素Logistic回归分析
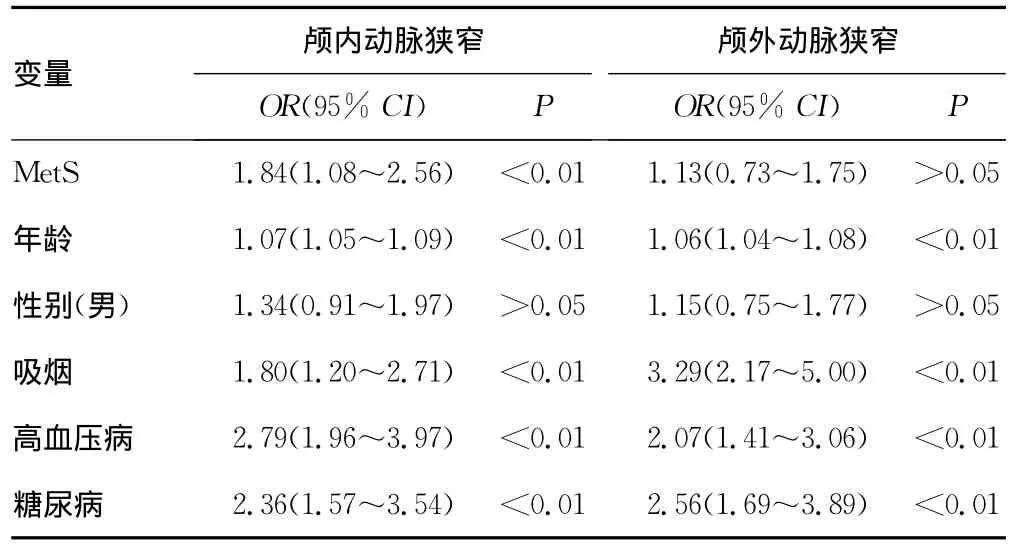
表5 MetS与颅内、外动脉狭窄的多因素Logistic回归分析
3 讨 论
在本研究中,采用CTA评估颅内、外动脉狭窄情况,发现MetS仅与颅内动脉狭窄独立相关,而与颅外动脉狭窄无独立相关性。年龄、吸烟、高血压和糖尿病与颅内、颅外动脉狭窄均独立相关。年龄、吸烟、高血压和糖尿病与颅内、外动脉狭窄的关 系 尚 未 阐 述 清 楚,文 献 报 道 结 果 存 在 冲 突[1,3-4]。 如Ovbiagele等[1]研究发现年龄、吸烟、高血压、糖尿病与颅内、颅外动脉狭窄均无独立相关性。Park等[3]的研究则提示年龄仅与颅内动脉狭窄独立相关,吸烟与颅内和颅外动脉狭窄均不独立相关。在巴塞罗那症状性颅内动脉粥样硬化研究中,年龄、糖尿病与颅内、颅外动脉狭窄均独立相关,而吸烟和高血压则仅与颅外动脉狭窄独立相关[4]。在本研究中年龄、吸烟、高血压和糖尿病与颅内、颅外动脉狭窄均独立相关。
MetS与脑卒中的发生和死亡率显著相关[8-10]。近年来的研究阐述了MetS是颅内、外动脉狭窄的危险因素[1-4]。本研究提示MetS仅与颅内动脉狭窄独立相关,而与颅外动脉狭窄无独立相关性。这与文献[1,3,11]的研究结果相似。而巴塞罗那症状性颅内动脉粥样硬化研究却认为MetS与颅内、颅外动脉狭窄均独立相关[4]。但是,本研究中颅内、外动脉狭窄定义为颅内、外动脉血管内径狭窄大于或等于30%,而文献[1,3]及巴塞罗那症状性颅内动脉粥样硬化研究均定义为颅内外动脉血管内径狭窄大于或等于50%,而张金洪等[11]的研究中未给出颅内外动脉狭窄确切的定义。且本研究中所采用评估颅内、外动脉狭窄的方法和MetS诊断标准与之前的研究都不同。
然而,MetS仅与颅内动脉狭窄独立相关,而与颅外动脉狭窄无独立相关性,Park等[3]推测可能是由于随着年龄的增长,颅内动脉的抗氧化物酶活性降低,与颅外动脉相比降低的程度更加明显,导致氧化应激对颅内动脉的作用不断增强,从而加快了颅内动脉粥样硬化的形成。此外,MetS的主要病理、生理基础是胰岛素抵抗,胰岛素抵抗使颅内动脉扩张功能受损,造成血管壁僵硬度增加、缓冲能力下降,也在一定程度上促进颅内动脉硬化的形成[3]。
本研究仅是一个横断面研究,因此不能说明MetS与颅内、外动脉狭窄是否有因果关系,但研究结果所提示的MetS与颅内动脉狭窄的独立相关性具有重要意义,即早期诊断和干预MetS,针对性防治颅内外动脉狭窄,能够降低缺血性脑血管疾病的发生。
[1] Ovbiagele B.Association of the metabolic syndrome with intracranial atherosclerotic stroke[J].Neurology,2006,66(3):459.
[2] Bang OY,Lee MA,Lee JH,et al.Association of metabolic syndrome and C-reactive protein levels with intracranial atherosclerotic stroke[J].J Clin Neurol,2005,1(1):69-75.
[3] Park JH,Kwon HM,Roh JK.Metabolic syndrome is more associated with intracranial atherosclerosis than extracranial atherosclerosis[J].Eur J Neurol,2007,14(4):379-386.
[4] López-Cancio E,Galán A,Dorado L,et al.Biological signatures of asymptomatic extra-and intracranial atherosclerosis:the Barcelona-AsIA (Asymptomatic Intracranial Atherosclerosis)study[J].Stroke,2012,43(10):2712-2719.
[5] 中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419.
[6] Chimowitz MI,Lynn MJ,Howlett-Smith H,et al.Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis[J].N Engl J Med,2005,352(13):1305-1316.
[7] Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis.North American symptomatic carotid endarterectomy trial collaborators[J].N Engl J Med,1991,325(7):445-453.
[8] Rodriguez-Colon SM,Mo J,Duan Y,et al.Metabolic syndrome clusters and the risk of incident stroke:the atherosclerosis risk in communities(ARIC)study[J].Stroke,2009,40(1):200-205.
[9] Lakka HM,Laaksonen D,Lakka T,et al.The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men[J].JAMA,2002,288(21):2709-2716.
[10]Zhang WW,Liu CY,Wang YJ,et al.Metabolic syndrome increases the risk of stroke:a 5-year follow-up study in a Chinese population[J].J Neurol,2009,256(9):1493-1499.
[11]张金洪,刘俊艳.代谢综合征与颅内外动脉粥样硬化性狭窄的相关性研究[J].脑与神经疾病杂志,2008,16(4):406-409.

