巨噬细胞表型转换在NAFLD发生过程中的可能作用*
邵小娟,王晓敏,王 斌,熊 吉,李 青,陈东风△
(1.第三军医大学大坪医院野战外科研究所消化内科,重庆400042;2.新疆维吾尔自治区人民医院干部保健中心,新疆乌鲁木齐830000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝脏损伤,其病理学改变与酒精性肝病(ALD)相似,但患者无过量饮酒史,疾病谱包括非酒精性单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及其相关肝硬化和肝细胞癌。NAFLD是21世纪全球重要的公共健康问题之一,亦是中国愈来愈重视的慢性肝病。有学者近年来研究认为,NAFLD患者存在全身低度炎症状态,在NAFLD中的NASH及此后进展阶段更为明显,与疾病演进关系密切[1]。巨噬细胞是炎症过程中的关键细胞。学者们既往重视它与肝脏炎症及肿瘤发生中的作用,关于其在NAFLD的形成及进展中的相关研究较少。
巨噬细胞参与了体内的固有免疫和获得性免疫[2]。激活的巨噬细胞将会释放细胞因子及炎症趋化因子来抵御感染及修复组织[3]。有研究表明,脂肪组织的巨噬细胞在与肥胖相关的慢性疾病(如2型糖尿病和心血管疾病)中起到了至关重要的作用[4]。脂肪组织的巨噬细胞存在不同的表型,1型辅助性T细胞(Th1)通过产生白细胞介素(IL)-2、干扰素-γ(IFN-γ)、肿瘤坏死因子(TNF)等细胞因子,诱导巨噬细胞表型转换为M1亚群巨噬细胞,引起细胞免疫和炎症;2型辅助性T细胞(Th2)细胞通过产生IL-4,IL-13,诱导 M2亚群巨噬细胞,减轻炎症的发生[5]。本文对巨噬细胞及其功能转换在NAFLD疾病发生、发展中的作用和意义进行研究,现报道如下。
1 资料与方法
1.1 一般资料 将2012年4~10月在第三军医大学大坪医院野战外科研究所诊断的NAFLD伴单纯性胆囊结石、非NAFLD伴单纯性胆囊结石,且年龄为18~60岁的患者纳入分析。NAFLD的诊断标准符合2010年中华医学会制定的NAFLD诊疗指南中的标准[6]:(1)无饮酒史或饮酒折合乙醇量小于140g/周(女性,<70g/周);(2)除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;(3)肝活检组织学改变符合脂肪性肝病的病理学诊断标准;(4)肝脏影像学表现符合弥漫性脂肪肝的诊断标准且无其他原因可供解释;(5)有代谢综合征相关组分的患者出现不明原因的血清丙氨酸氨基转移酶(ALT)和(或)天冬氨酸氨基转移酶(AST)、γ-谷氨酰转移酶(GGT)持续增高6个月以上。减肥和改善IR后,异常酶谱和影像学脂肪肝改善甚至恢复正常者。明确为NAFLD的患者27例(NAFLD组),男10例,女17例;排除NAFLD及其他一切肝病,且肝功能正常的单纯性胆囊结石患者28例(非NAFLD组),男5例,女23例。所有纳入研究患者均签署知情同意书,伦理中心备案。
1.2 方法
1.2.1 临床资料收集 登记患者姓名、住院号、年龄、性别、BMI、腹围。肝组织标本、网膜脂肪及皮下脂肪在获得患者知情同意后通过腹腔镜手术获得,网膜脂肪从邻近胆囊的大网膜获得,皮下脂肪从上腹部的腹壁脂肪获得。
1.2.2 实验室检测 所有研究对象均于禁食饮水12h后,于入院次日清晨抽取肘静脉血。采用全自动生化分析仪测定如下血液学指标:血糖、ALT、AST、总胆红素(TB)、胰岛素、三酰甘油(TG)、游离脂肪酸(FFA),并计算胰岛素抵抗指数(HO-MA-IR,即空腹血糖×空腹胰岛素/22.5)。
1.2.3 免疫组织化学检测 将皮下脂肪及网膜脂肪分别在甲醛中嵌块包埋,切成5μm厚的薄切片,脱蜡后抗原的修复在乙二胺四乙酸(ethylenediaminetetraacetic acid buffer,EDTA)(pH 9.0)中进行,用微波炉加热8min,然后初级抗体反应CD11c(1∶100,clone EP1347Y,Abcam,Cambridge,Massachusetts),CD206(1∶1 500,clone 5C11,Abnova,Taipei,Taiwan),和 CD68(1∶100,clone KP-1,Dako,Glostrup,Denmark),在4℃冰箱中孵育过夜,接着通过二次抗体(PV2000,中杉金桥)在37℃培育。定位的二次抗体通过有苏木素的抗复染色剂观察,巨噬细胞的计数在×200的视野下取任意3个视野计数。抗CD68免疫组织化学标记巨噬细胞,抗CD11C和抗CD206分别标记M1、M2亚群巨噬细胞[7]。
1.2.4 NAFLD活动度积分(NAFLD activity score,NAS)评分 评估NAFLD的严重程度,本研究采用病理诊断及NAS。标准采用美国国立卫生研究院NASH临床研究网病理工作组指南中的标准,NAS积分范围为0~8分,(1)肝细胞脂肪变:0分(<5%);1分(5%~33%);2分(>33%~66%);3分(>66%);(2)小叶内炎症(20倍镜计数坏死灶):0分(无);1分(<2个);2分(2~4个);3分(>4个);(3)肝细胞气球样变:0分(无);1分(少见);2分(多见)。肝纤维化评估则采用定性诊断,0分:无肝纤维化;1分:存在肝纤维化。NAS<3分可排除NASH,NAS>4分则可诊断NASH,介于二者之间为NASH可能。规定不伴有小叶内炎症、气球样变和纤维化但肝脂肪变大于33%者为NAFL,脂肪变达不到此程度者仅称为肝细胞脂肪变[8]。
1.3 统计学处理 所有数据均采用SPSS19.0统计软件进行分析,符合正态分布的计量资料用±s表示,非正态分布的计量资料以中位数(25%,75%分位数)表示,组间比较采用t检验,计数资料采用百分比,组间比较用χ2检验,相关分析用线性相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者基本特征比较 NAFLD组与非NAFLD患者比较,在年龄、腹围、血糖、ALT、AST、TB、FFA,差异无统计学意义(P>0.05),NAFLD组与非 NAFLD组FFA为0.97(0.05,2.28)mmol/L vs.0.94(0.73,2.16)mmol/L(P=0.556);而BMI、胰岛素、TG、HOMA-IR较非 NAFLD组患者升高(P<0.05),见表1。
表1 两组患者基本特征比较(±s)
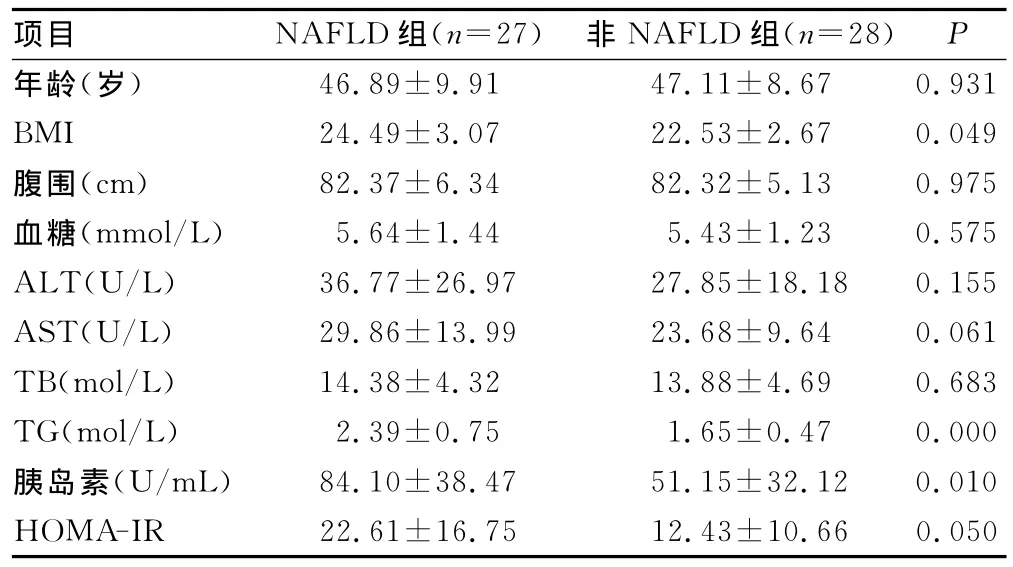
表1 两组患者基本特征比较(±s)
项目 NAFLD组(n=27) 非NAFLD组(n=28)P 46.89±9.91 47.11±8.67 0.931 BMI 24.49±3.07 22.53±2.67 0.049腹围(cm) 82.37±6.34 82.32±5.13 0.975血糖(mmol/L) 5.64±1.44 5.43±1.23 0.575 ALT(U/L) 36.77±26.97 27.85±18.18 0.155 AST(U/L) 29.86±13.99 23.68±9.64 0.061 TB(mol/L) 14.38±4.32 13.88±4.69 0.683 TG(mol/L) 2.39±0.75 1.65±0.47 0.000胰岛素(U/mL) 84.10±38.47 51.15±32.12 0.010年龄(岁)HOMA-IR 22.61±16.75 12.43±10.66 0.050
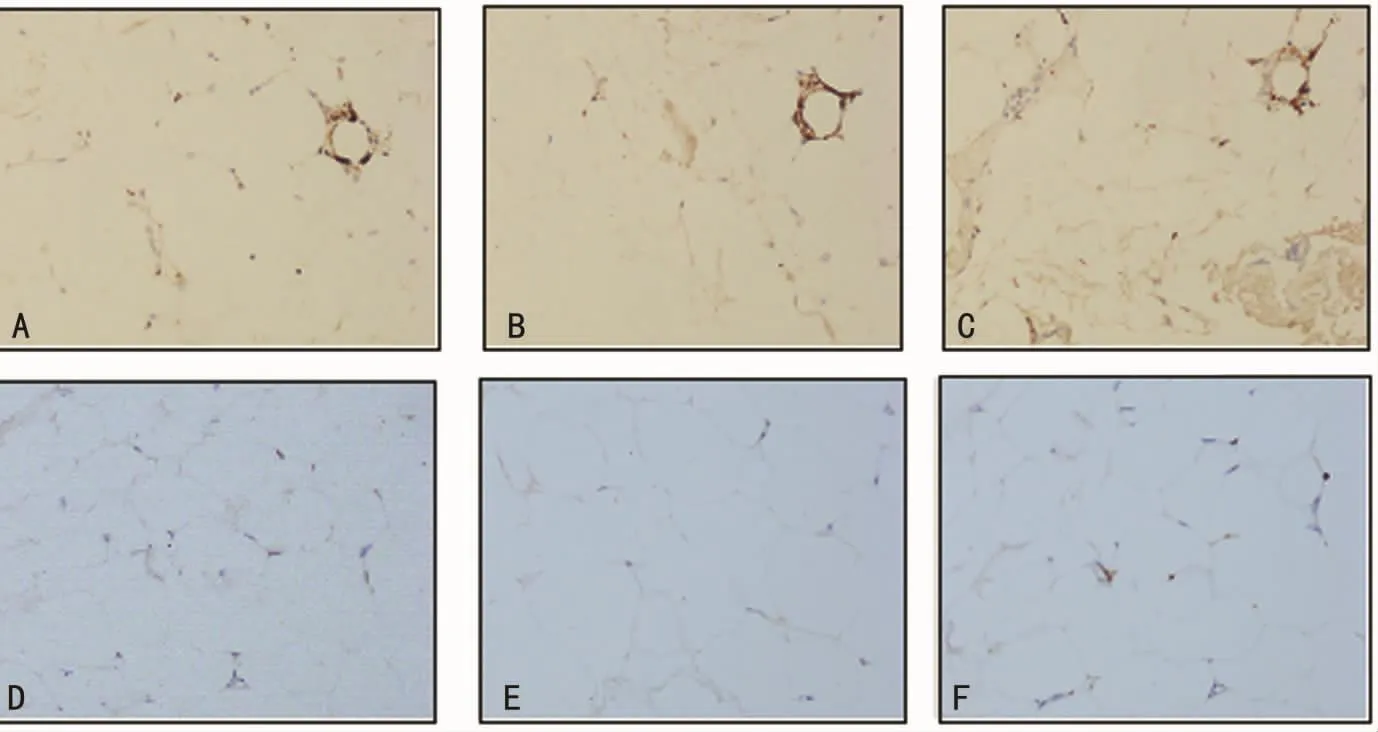
图1 巨噬细胞在NAFLD组患者网膜脂肪及皮下脂肪的免疫组织化学染色(×200)
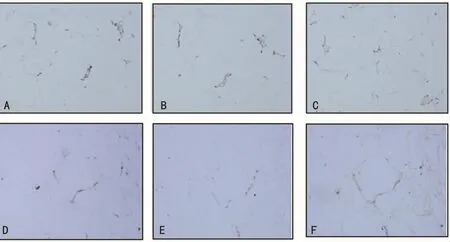
图2 巨噬细胞在非NAFLD组患者网膜脂肪及皮下脂肪的免疫组织化学染色(×200)
2.2 网膜及皮下脂肪巨噬细胞免疫组织化学染色 NAFLD组免疫组织化学染色可见皮下的CD68阳性染色细胞少于网膜,皮下的CD11C及CD206阳性染色细胞均较网膜少(图1)。非NAFLD组也可见同样的趋势(图2)。与非NAFLD组比较,NAFLD组的CD68、CD11C及CD206阳性染色数量均较非NAFLD组增加。
2.3 两组患者网膜、皮下脂肪巨噬细胞及M1、M2亚群细胞巨噬细胞数量比较 NAFLD组网膜、皮下脂肪的巨噬细胞多于非NAFLD组,NAFLD组网膜脂肪巨噬细胞数量的均值为(41.50±10.47)个,皮下脂肪巨噬细胞数量的均值为(26.55±10.74)个;非NAFLD组网膜脂肪巨噬细胞数量的均值为(29.93±11.49)个,皮下脂肪巨噬细胞数量的均值为(15.57±5.67)个,两组比较差异有统计学意义(P<0.01),见表2。在NAFLD组中,皮下、网膜脂肪及M1、M2亚群巨噬细胞的数量都同时增加,以M1亚群巨噬细胞增加更为明显(P<0.05)。
2.4 在NAFLD组中M1、M2亚群巨噬细胞的数量与NAS评分的相关性 对NAFLD患者的肝脏损害进行NAS评分,27例NAFLD患者中,7分的1例,6分4例,5分7例,4分3例,3分7例,2分4例,1分1例。NAFLD患者网膜及皮下脂肪中巨噬细胞与NAS评分的相关性见表3。
表2 两组患者皮下及网膜脂肪巨噬细胞比较(±s)
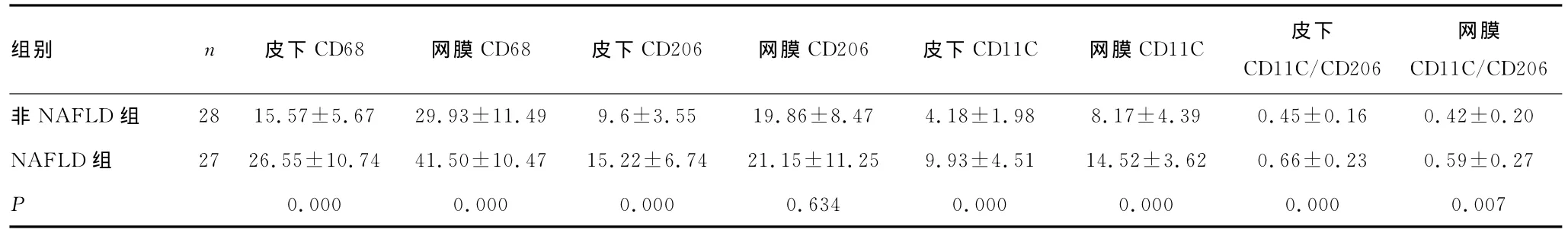
表2 两组患者皮下及网膜脂肪巨噬细胞比较(±s)
组别 n 皮下CD68 网膜CD68 皮下CD206 网膜CD206 皮下CD11C 网膜CD11C 皮下CD11C/CD206 47 4.18±1.98 8.17±4.39 0.45±0.16 0.42±0.20 NAFLD组 27 26.55±10.74 41.50±10.47 15.22±6.74 21.15±11.25 9.93±4.51 14.52±3.62 0.66±0.23 0.59±0.27 P 0.000 0.000 0.000 0.634 0.000 0.000 0.000 0.007 CD206非NAFLD组 28 15.57±5.67 29.93±11.49 9.6±3.55 19.86±8.网膜CD11C/
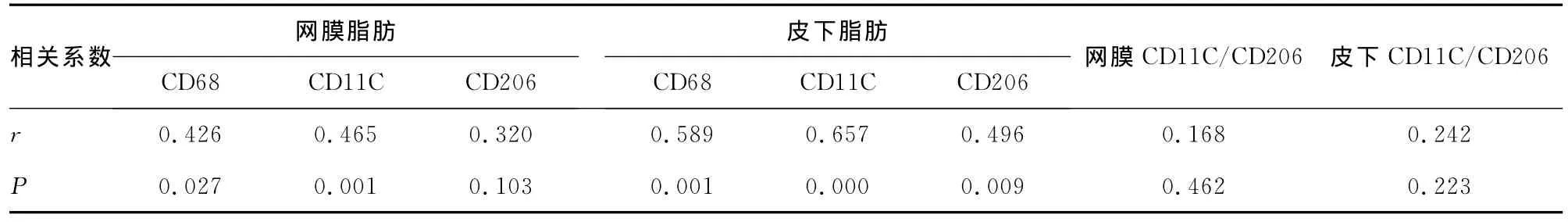
表3 NAFCD组患者NAS评分与网膜及皮下脂肪中巨噬细胞的相关性
2.5 肝细胞脂肪变、炎症、气球样变及纤维化的相关性 分析结果提示网膜脂肪的 M1与脂肪变密切相关(r=0.459,P<0.05),皮下脂肪的 M1与脂肪变、炎症、气球样变及纤维化密切相关(r=0.447、r=0.412、r=0.504,r=0.470,P<0.05),皮下脂肪的巨噬细胞数量与肝脏的脂肪变、气球样变及纤维化密切相关(r=0.408、r=0.403、r=0.434,P<0.05)。
3 讨 论
NAFLD发病机制以“二次打击”学说被广泛接受,IR是“一次打击”的核心,肝细胞脂肪代谢异常,肝脏内脂肪沉积,尤其是TG沉积是第一次打击的直接后果。本研究对人群资料分析发现,NAFLD组患者BMI、胰岛素、TG、HOMA-IR升高,说明了NAFLD患者往往合并了IR及血脂紊乱,这些结果符合NAFLD发生的“一次打击”学说[9]。
本研究发现在NAFLD患者中,肝组织标本出现不同程度的肝细胞肿胀、炎症和纤维化,部分表现出NASH的特征,出现NAFLD的“二次打击”[10]。既往并未重视巨噬细胞在此过程中的变化和作用,本研究主要关注了巨噬细胞及巨噬细胞亚群数量的变化与NAFLD患者肝脏炎症的关系。本研究发现在NAFLD患者中,巨噬细胞、M1亚型巨噬细胞、M2亚型巨噬细胞及M1/M2在皮下脂肪组织及网膜脂肪组织中都明显升高。对NAFLD患者的数据相关分析发现,皮下脂肪的CD68、CD11C及CD206阳性细胞都与NAS评分呈正相关,同时网膜脂肪的CD68,CD11C阳性细胞也与NAS评分呈正相关,提示巨噬细胞及其亚型与NAFLD的严重程度有密切关系。从另一方面提示NAFLD是一种全身慢性炎症疾病,而脂肪组织的炎症是全身炎症反应中易被忽略的炎症形式,在炎症过程中的巨噬细胞发挥着重要的作用。
本文结果表明,无论是网膜脂肪还是皮下脂肪的M1亚群巨噬细胞的数量都与肝组织炎症及脂肪变有一定关系,提示M1亚群巨噬细胞参与了NAFLD脂肪变的发生,可能与M1亚群巨噬细胞分泌脂代谢相关细胞因子,如TNF-α、IL-6等,TNF-α介导氧化应激和脂质过氧化损伤,对肝细胞的毒性增强,诱发线粒体代谢障碍,从而进一步加剧肝细胞发生脂肪变性、炎性反应、坏死甚至纤维化。IL-6可刺激脂肪动员,促进FFA释放,使血液循环中的TG异常增多,从而脂质在肝脏堆积,导致脂肪变。由此可见巨噬细胞的表型转换参与了NAFLD的多个环节。
在NAFLD患者中,人们往往重视内脏脂肪的作用而忽视了皮下脂肪的作用,本研究发现在NAFLD患者中,皮下脂肪与内脏脂肪同样与肝细胞脂肪变、肝脏炎症及NAFLD的严重程度密切相关。有学者们研究表明,在冠心病中患者的心外膜脂肪的巨噬细胞数量增加,而皮下脂肪的巨噬细胞无明显增加,并且在冠心病患者中,M1/M2比值与冠心病严重程度呈正比[8],该研究与本研究结果类似,但冠心病患者皮下脂肪的巨噬细胞无明显变化,说明了冠心病患者的全身炎症不重,而本组资料中发现NALFD患者皮下脂肪中的巨噬细胞、M1亚型巨噬细胞及M2亚型巨噬细胞数量明显增加,可能是因为NAFLD患者的全身低度炎症反应所导致。在动物实验的研究中,发现在NAFLD中Th1免疫反应起主要作用,促进了kupffer细胞的M1激活[11]。大鼠中Kuppfer细胞的 M1激活对肝脏的脂肪变有促进作用[12]。最新研究表明,在NASH大鼠中,脂肪组织巨噬细胞存在表型转换[13],M1/M2与NASH的严重程度相关[14],此结果在本研究中得到了进一步证实。因此,临床上是否可以将皮下脂肪的巨噬细胞数量作为预测NAFLD严重程度指标值得进一步研究。
综上所述,本研究发现在NAFLD患者网膜及皮下脂肪组织中巨噬细胞及其表型转换参与了NAFLD的发生及发展过程,皮下脂肪活检检测巨噬细胞可否作为NAFLD的严重程度的判断指标需进一步深入研究。
[1] 张学力,郗光霞,赵媛媛,等.胰岛素抵抗与非酒精性脂肪性肝病[J].国际内分泌代谢杂志,2012,32(1):59-61.
[2] Mantovani A,Biswas SK,Galdiero MR,et al.Macrophage plasticity and polarization in tissue repair and remodeling[J].J Pathol,2013,229(2):176-185.
[3] 况晓东,周晓燕,艾有生.巨噬细胞极化与代谢性疾病的研究进展[J].实用临床医学,2012,13(4):123-125,129.
[4] Shoelson SE,Herrero L,Naaz A.Obesity,inflammation,and insulin resistance[J].Gastroenterology,2007,132(6):2169-2180.
[5]杨洋.巨噬细胞在子宫内膜异位症中的作用研究进展[J].重庆医学,2011,40(15):1532-1534.
[6] 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):161-163.
[7] Hirata Y,Tabata M,Kurobe H,et al.Coronary atherosclerosis is associated with macrophage polarization in epicardial adipose tissue[J].J Am Coll Cardiol,2011,58(3):248-255.
[8] Kleiner DE,Brunt EM,Van Natta M,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J].Hepatology,2005,41(6):1313-1321.
[9] 李娟,叶菲.非酒精性脂肪性肝病发病机制的研究进展[J].国际药学研究杂志,2011,38(5):341-344.
[10]王万东,陈东风.内质网应激线粒体功能紊乱与非酒精性脂肪性肝病[J].重庆医学,2009,38(4):423-424.
[11]Neyrinck AM,Cani PD,Dewulf EM,et al.Critical role of Kupffer cells in the management of diet-induced diabetes and obesity[J].Biochem Biophys Res Commun,2009,385(3):351-356.
[12]Rivera CA,Adegboyega PA,van Rooijen N,et al.Tolllike receptor-4signaling and Kupffer cells play pivotal roles in the pathogenesis of nonalcoholic steatohepatitis[J].J Hepatol,2007,47(4):571-579.
[13]Oh DY,Morinaga H,Talukdar S,et al.Increased macrophage migration into adipose tissue in obese mice[J].Diabetes,2012,61(2):346-354.
[14]Maina V,Sutti S,Locatelli I,et al.Bias in macrophage activation pattern influences non-alcoholic steatohepatitis(NASH)in mice[J].Clin Sci,2012,122(11):545-553.

