羊痘病毒P32基因的截短表达与鉴定
索南卓玛
(青海省海南州同德县畜牧兽医工作站,青海同德813200)
羊痘(Capripox,CP)是由羊痘病毒(Capripox virus,CPV)引起山羊、绵羊的一种接触性、急性、热性传染病[1-2],以持续高热、全身的皮肤和黏膜上发生特异性痘斑(疤疹、丘疹、淋巴结病变等)为主要临床特征[3]。该病对全球养羊业和毛皮制造行业造成了极大的危害[4],世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国也将其列为一类动物传染病,严重影响了我国羊类制品的出口贸易和国内养羊业的健康发展[1,5]。CPV 属痘病毒科(Poxviridae)脊椎动物痘病毒亚科(Chordopoxvirinae)羊痘病毒属(Capripoxvirus)[5],基因组为双股线性DNA病毒,P32蛋白由Chand等于1994年首次发现[6],后续研究表明P32蛋白是位于CPV囊膜表面的一种主要结构蛋白,含有主要的抗原表位,在病毒感染早期即可诱导体液免疫应答和细胞免疫应答,是激发机体产生抗体并产生保护性免疫的主要成分,是CPV中特异性高、免疫原性强的结构蛋白,是目前羊痘病毒研究的热点[7-10]。王芳 等[11]于 2009年表达了全长P32蛋白,其表达的全长P32蛋白用ELISA方法检测时反应性良好,但表达量非常低,增加了纯化的难度和成本。截短表达P32蛋白的主要抗原区域基本不影响蛋白的免疫原性,陈轶霞等[12]截短表达的羊痘病毒P32蛋白可诱导小鼠产生特异性体液免疫应答,并能刺激小鼠产生较强的细胞免疫应答。鉴于此,本研究选择P32蛋白抗原性好的主要区域进行了表达,以期为CPV诊断方法的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒、载体、菌种、血清 CPV疫苗株、克隆菌株 DH5α、表达菌株 BL21(DE3)、表达载体pET32a(+)均由青海省西宁市动物疾病中心实验室保存;CPV参考阳性、阴性血清购自中国兽医药品监察所。
1.1.2 试剂盒及工具酶 pMD18-T克隆载体、KpnⅠ和NotⅠ限制性内切酶购自宝生物工程(大连)有限公司;病毒基因组提取试剂盒、胶回收试剂盒、质粒提取试剂盒购自上海生工生物工程技术服务有限公司。
1.2 方法
1.2.1 引物的设计与合成 参照GenBank上发表的CPV基因组序列(HM572331.1)设计一对特异性引物,P1:5′-CGGGGTACCGAAATTTCAGATGTAGTTCCA-3′;P2 :5′-ATTT GCGGCCGCGCTCCCATTATAC -T AATATCA-3′,下划线部分表示引入的KpnⅠ和NotⅠ酶切位点,引物由上海生工生物工程技术服务有限公司合成合成。
1.2.2 病毒基因组DNA的提取 按病毒基因组提取试剂盒的使用说明提取CPV基因组DNA。
1.2.3 P32基因片段的PCR扩增 以提取的病毒基因组DNA为模板扩增P32基因片段,PCR反应条件为:95℃5min预变性;95℃45s,58℃45s,72℃1min,共进行30个循环;72℃10min,4℃终止反应。取5μL PCR产物在10g/L琼脂糖凝胶中电泳观测结果。
1.2.4 P32基因片段的克隆及鉴定 PCR产物利用胶回收试剂盒回收纯化后,与pMD18-T载体在4℃过夜连接,连接产物转化DH5α感受态细胞,挑取单菌落接种于液体LB中,37℃振摇培养16h,利用质粒提取试剂盒提取质粒DNA,用KpnⅠ和NotⅠ双酶切鉴定为阳性克隆,送上海生工生物工程技术服务有限公司进行测序鉴定,测序正确的质粒命名为pMD18-T-P32。
1.2.5 表达载体的构建及鉴定 将质粒pMD18-T-P32和原核表达载体pET32a分别用KpnⅠ和NotⅠ双酶切后回收目的片段,利用T4DNA连接酶16℃过夜连接,次日连接产物转化DH5α感受态细胞,挑取单菌落接种于液体LB中,37℃振荡培养16h,用质粒提取试剂盒提取质粒DNA,用EcoRⅠ和XhoⅠ双酶切鉴定为阳性重组质粒,测序正确的质粒命名为pET32a-P32。
1.2.6 重组蛋白的表达和纯化 将质粒pET32a-P32转化感受态表达菌BL21(DE3)。挑取单菌落加入到液体LB中,当OD 600nm达到0.6左右时加入IPTG至终浓度为1mmol/L,继续培养5h后,6 000r/min离心10min,收集菌体沉淀,用PBS洗2遍,利用超声破碎后,12 000r/min离心10min,分别收集上清和沉淀进行SDS-PAGE电泳。对以包涵体形式表达的重组蛋白用8mol/L尿素变性溶解,采用6、4、2mol/L尿素及PBS梯度透析复性,复性后的蛋白采用镍离子亲和树脂过柱纯化,并进行SDS-PAGE电泳分析。
1.2.7 重组蛋白的活性检测 纯化的重组蛋白先进行SDS-PAGE电泳后,转印至硝酸纤维素膜上,用80g/L脱脂奶粉37℃封闭2h,用PBST洗涤膜3次后加入CPV阳性血清(1∶100倍稀释)37℃作用1h,用PBST洗涤膜3次后加辣根过氧化物酶标记的兔抗羊IgG(1∶5 000倍稀释)37℃作用1h,PBST洗涤膜3次后用二氨基联苯胺(DAB)缓冲溶液进行显色。
2 结果
2.1 P32基因片段的PCR扩增
PCR扩增产物经10g/L琼脂糖凝胶电泳后,在约837bp处有一特异性扩增条带,与预期扩增片段大小相符(图1)。
2.2 重组质粒pMD18-T-P32的鉴定
质粒经KpnⅠ和NotⅠ双酶切后得到2个片段,与预期大小相符(图2),阳性质粒pMD18-T-P32送公司测序后的结果与参考毒株序列相同。

图1 P32基因片段PCR扩增结果Fig.1 Result of PCR amplification of P32gene
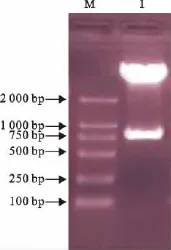
图2 重组质粒pMD18-T-P32双酶切鉴定Fig.2 Identification of recombinant plasmid pMD18-T-P32 by double enzyme digestion
2.3 重组质粒pET32a-P32的鉴定
质粒经KpnⅠ和NotⅠ双酶切后得到2个片段,与预期大小相符(图3),阳性质粒pET32a-P32测序后的结果表明其阅读框正确。
2.4 重组蛋白的表达及纯化
表达菌液按之前的诱导条件诱导表达后,离心菌体沉淀,超声破碎细胞,通过SDS-PAG电泳表明重组蛋白以包涵体形式表达,包涵体经尿素变性、复性处理后,用镍离子亲和树脂过柱纯化得到了较纯的目的蛋白(图4)。
2.5 重组蛋白的Western blot鉴定
纯化后的重组蛋白先进行SDS-PAGE电泳,然后转印至硝酸纤维素膜上,分别与CPV阳性、阴性血清作用。该重组蛋白能与CPV阳性血清发生特异性反应,产生肉眼可见的条带,而空载体表达菌与CPV阳性血清不反应,该重组蛋白与CPV阴性血清也不反应(图5)。

图3 重组质粒pET32a-P32酶切鉴定Fig.3 Identification of recombinant plasmid pET32a-P32by enzyme digestion

图4 重组蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of recombination proteins

图5 表达产物的免疫印迹分析Fig.5 Western blot of expressed products
3 讨论
羊痘是动物痘病最常见的病毒性疾病之一[5],是动物痘病毒病的典型代表。由于我国养羊业的发展,尤其是羊类制品的流行,人们对羊健康的关注度日益增强。为此,制定积极有效的预防措施,获得及时准确的疾病监控信息,是控制该病传播的重要基础工作。这就要求研究人员建立起快速、简便、敏感的诊断方法,为预防和检测该病的发生和传播提供技术支持。羊痘病毒在我国普遍存在,对养羊业危害严重,应该加强对该病毒的检测和疾病的快速诊断。本研究利用原核表达系统成功表达了CPV P32蛋白。选择合适的载体是目的基因能否成功表达的关键。pET表达系统是在大肠埃希菌中克隆和表达重组蛋白的最强大系统。本试验所采用的载体pET-32a具有T7强启动子和组氨酸标签,是一个专为外源基因在大肠埃希菌中表达而研发的高效原核表达系统,其表达的重组蛋白带有6×His标签,可利用Ni+与组氨酸结合的性质直接纯化表达的目的蛋白,基本上不影响目的蛋白的结构与功能。大肠埃希菌表达目的蛋白的形式有两种,即包涵体和可溶性蛋白。以包涵体形式表达的蛋白质能够避免细胞内蛋白水解酶作用,有利于目标蛋白的富集和分离纯化。本研究选择P32基因抗原性好的主要区域进行了截短表达,结果得到了高效表达。本研究所表达的重组P32蛋白经变性、复性、纯化后,Western blot检测表明纯化的重组蛋白具有良好的抗原性与特异性,可以将纯化后的蛋白用于相关诊断试剂盒的研究,为开发CPV抗体诊断试剂奠定了基础。
[1] 江 楠,文 明,许乐仁,等.羊痘病毒致宿主细胞病变研究进展[J].动物医学进展,2012,33(7):75-80.
[2] Das A,Babiuk S,McIntosh M T.Development of a loop-mediated isothermal amplification assay for rapid detection of capri-poxviruses[J].J Clin Microbiol,2012,50(5):1613-1620.
[3] 黄 鹤,李应国,肖进文,等.羊痘病毒环介导等温扩增(LAMP)检测方法的建立[J].中国畜牧兽医,2012,39(6):72-75.
[4] Beard P M,Sugar S,Bazarragchaa E,et al.A description of two outbreaks of capripoxvirus disease in Mongolia[J].Vet Microbiol,2010,142(3-4):427-431.
[5] 赵志荀,吴国华,颜新敏,等.羊痘病毒及其疫苗研究进展[J].动物医学进展,2010,31(4):77-81.
[6] Chand P,Kitching R P,Black D N.Western blot analysis of virus-specific antibody responses for capripox and contagious pustular dermatitis viral infections in sheep[J].Epidemiol Infect,1994,113(2):377-385.
[7] Heine H G,Stevens M P,Foord A J,et al.A capripoxvirus detection PCR and antibody ELISA based on the major antigen P32,the homolog of the vaccinia virus H3Lgene[J].J Immunol Meth,1999,227(1-2):187-196.
[8] 程振涛,岳 筠,周碧君,等.羊痘病毒P32基因生物信息学分析[J].西北农业学报,2011,20(8):20-24.
[9] 赵志荀,王建科,张 强.羊痘病毒P32蛋白的研究进展[J].中国畜牧兽医,2009,36(10):129-133.
[10] 张志成,陈 琼,庞银芳,等.羊痘病毒江苏株P32基因的克隆与序列分析[J].金陵科技学院学报,2010,26(4):79-84.
[11] 王 芳,雷 震,于 力.山羊痘病毒p32基因原核表达及间接ELISA抗体检测方法的建立[J].中国预防兽医学报,2009,31(12):955-958.
[12] 陈轶霞,才学鹏,景志忠,等.羊痘病毒P32基因真核表达载体的构建、表达及其免疫原性[J].病毒学报,2008,24(2):133-137.

