猪瘟病毒福建野毒分离株FJ-1E2基因序列分析
杨小燕,刘建奎,魏春华,戴爱玲,李晓华
(福建龙岩学院生命科学学院/预防兽医学与生物技术福建省高等学校重点实验室/福建省人畜寄生与病毒性疫病防控工程技术研究中心,福建龙岩364000)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起猪的一种以高热稽留、出血和高病死率为特征的高度接触性传染病[1-2],是严重威胁养猪业的主要病毒性疾病之一,世界动物卫生组织(OIE)将其列为必须报告的动物疫病,中国将其列为一类动物疫病。目前,猪瘟在50多个国家和地区都有不同程度的发生与流行[3-4]。
CSFV是有囊膜的RNA病毒,基因组长约12.3 kb,含一个大的开放阅读框(ORF),从5′端至3′端,CSFV的ORF可顺次翻译成衣壳蛋白C和囊膜糖蛋白E2、E1、E3等4种结构蛋白,以及4种非结构蛋白[5]。其中E2基因长度为1 110bp,全长由370个氨基酸残基组成[6-7],是3种囊膜糖蛋白中最主要的保护性抗原,也是中和抗体主要诱发者。
在中国,由于C-株疫苗的长期使用,有效的控制了猪瘟的流行,近些年来,猪瘟的流行特点出现了以温和型猪瘟和母猪持续感染引起的流产、死胎、新生仔猪死亡为主的新变化,并呈现上升趋势。从而导致许多猪场将疫苗剂量加大数倍,疫情依然不能控制[8-9]。2005年,廖素环等研究表明,广西流行毒株与HCLV、Shimen的同源性比较低,表明广西近期流行CSFV与两个标准对照毒株之间存在较大差异,但广西毒株之间同源性高。2006年,曲永利等对流行于国内部分地区的9株猪瘟病毒E2基因进行扩增并分析,结果表明近期流行毒株的变异呈现一定的多样性,并且多数毒株已向远离疫菌株方向变异。杨健等[10]试验结果初步证实,猪瘟病毒贵州流行株E2基因发生了较大的变异,且与疫苗毒株之间差异较大。因此,本研究在国内外对CSFV E2基因编码的抗原结构研究的基础上,对福建流行毒株的核酸序列进行分析研究,构建遗传进化树,了解猪瘟病毒疫苗毒株与流行毒株之间的差异及流行毒株的变异情况,为防控猪瘟提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病料 采集福建省某猪场疑似猪瘟样品(扁桃体、脾、肾、淋巴结等),将采集的病料经过研磨、离心、过滤,接种PK-15细胞,盲传3代后用CSFV E2引物进行RT-PCR扩增。
1.1.2 菌种、载体和试剂 大肠埃希菌DH5α菌种由病原微生物实验室保存;RNA酶抑制剂(40U/μL)、M-MuLV 反转录酶(200U/μL)、rTaq DNA聚合酶(5U/μL)、pMD18-T克隆载体试剂盒、DNA Marker DL 2 000为宝生物工程(大连)有限公司产品;Trizol Reagent为Invitrogen公司产品。
1.2 方法
1.2.1 引物的设计与合成 针对E2基因设计了2对特异性引物,第1对引物P1、P2引用欧盟猪瘟参考实验室推荐的用于CSFV诊断的E2部分基因片段的扩增,扩增片段长度为272bp,引物序列:P1:5′-TCRWCAACCAAYGAGATAGGG-3′,P2:5′-CACAGYCCRAAYCCRAAGTCATC-3′;第 2 对 引 物P3、P4用于CSFV E2全长基因的扩增,预期扩增片段 长 度 为 1 110bp,引 物 序 列:P3:5′-CAGCCAGCGCGTTATACCTCAT -3′,P4:5′-ACAACGCCATCTCTGT TACAGTCC-3′。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 RNA的提取 将细胞培养物反复冻融3次,离心后取上清液,用Trizol试剂盒提取病毒基因组RNA。
1.2.3 CSFV E2扩增 应用 M-MuLV反转录酶试剂盒说明书将提取的病毒基因组RNA反转录为cDNA。以cDNA为模板,进行PCR扩增。PCR反应体系为25μL:10×PCR buffer(Mg2+)2.5μL,dNTPs (2.5mmol/L)1 μL,上、下 游 引 物(20mmol/L) 各 0.5 μL,TaqDNA 聚 合 酶0.25μL,用灭菌去离子水补至25μL。PCR反应程序:94℃5min;94℃45s,56℃45s,72℃ 60s,35个循环;72℃10min。用10g/L琼脂糖凝胶电泳检测。
1.2.4 测序 目的片段经凝胶回收试剂盒回收纯化,将其克隆入pMD18-T载体中,构建重组质粒,按常规方法转化入DH5α中,经酶切鉴定后,交由上海生工生物工程技术服务有限公司测序,测序结果与标准株及国内分离株的序列进行比较分析。
2 结果
2.1 临床样品RT-PCR结果
取病毒基因组RNA,利用第1对引物P1、P2进行E2基因的RT-PCR扩增,经电泳检测证明均获得约272bp的扩增产物,与预期片段大小相符,结果见图1。
2.2 E2全长基因的克隆
取病毒基因组RNA,利用第2对引物P3、P4进行E2全长基因的RT-PCR扩增。经电泳检测证明均获得约1 110bp的扩增产物(图2),与预期片段大小相符,将回收的PCR产物克隆到pMD18-T载体。重组质粒经双酶切鉴定,筛选出阳性重组子pMD18-T-E2。
2.3 E2基因同源性分析
对野毒株E2基因与经典强毒株,Alfort 187(x87939)、 Alfort A19 (U90951)、Shimen(AF092448)、Breseia(AF09166l)和弱毒疫苗株,中国C株(Z46258)、HCLV(AF091507)以及地方分离株广州株 GZ2009(HQ380231)、江西株Jiangxi(EF683616)、广西株 Guangxi(EF014338)、GXBH株 (EF014327)的核苷酸序列进行同源性分析。结果显示,福建野毒株与中国C株、HCLV株、Shi-men、Alfort187、Alfort A19、Breseia 6株标准参考株 的 同 源 性 分 别 为 94.2%、94.4%、91.5%、92.3%、92.3%、90.7%;与国内分离 株 GZ2009、Guangxi、Jiangxi、GXBH分离株的同源性分别为91.8%、93.1% 、81%、98.1%,将该野毒株命名为FJ-1株。

图1 CSFV E2基因的RT-PCR检测Fig.1 Detection of CSFV E2gene by RT-PCR
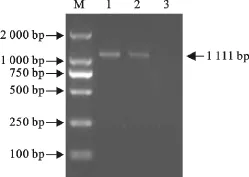
图2 E2全长基因的RT-PCR扩增Fig.2 Amplification of full-length E2gene by RT-PCR
2.4 E2基因遗传进化树构建
FJ-1株E2基因序列与中国C株、HCLV、Alfort/187、Breseia等6株标准参考株和广州株GZ2009等4株国内分离株的E2序列的遗传进化树分析,结果见图3。从进化树可看出E2基因差异较大,明显分为2支,Jiangxi分离株处在一个独立的分支上;6株标准参考株GZ2009株、Guangxi株、GXBH株差异不大,同处于一个分支;而FJ-1株与其他毒株差异较大,处于同一主干的另一分支。这说明国内CSFV毒株之间在进化上存在着某些相关性,可能与国内地域间生猪贸易有关。
2.5 FJ-1株与C株E2推导氨基酸序列的变异分析
对CSFV FJ-1株与C株的E2基因的A、B、C、D 4个结构域蛋白氨基酸序列的分析显示,在A抗原区有21个氨基酸发生了变异,分别由705(N→K)、713(A→V)、714(9I→T)、715(R→Q)、768(P→S)、796(E→G)、834(Y→H)、837(P→L)、838(E→K)、843(P→L)、845(P→K)、850(T→A)、852(N→S)、856(G→V)、857(P→L)、858(L→S)、859(R→G)、861(V→F)、862(W→L)、865(V→L)、866(P→L);在B抗原区有4个氨基酸发生了变异,由705(N→K)、713(A→V)、714(I→T)、715(R→Q);在C抗原区有6个氨基酸发生了变异,分别由705(N→K)、713(A→V)、714(I→T)、715(R→Q)、768(P→S)、796(E→G);在D抗原区有2个氨基酸发生了变异,分别由768(P→S)、796(E→G)。

图3 CSFV E2基因的系统遗传进化树Fig.3 Phylogenetic tree of CSFV E2gene
2.6 FJ-1株与C株E2蛋白抗原性及表面抗原位点的差异分析
应用DNAStar软件对FJ-1株的E2蛋白抗原性及表面抗原位点进行分析,并与中国C株E2蛋白的抗原性进行比较分析,结果表明,FJ-1株E2蛋白的抗原表位可能发生了漂移,如图4箭头所示。
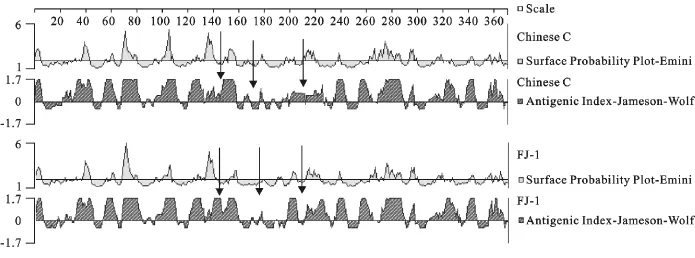
图4 FJ-1株与C株E2蛋白抗原性和抗原表位的变异分析Fig.4 Variation analysis of antigenicity and antigenic epitopes of E2proteins of FJ-1strain and Chinese C strain
3 讨论
E2蛋白是CSFV的主要保护性抗原,参与病毒的感染过程,并刺激中和抗体的产生。CSFV E2基因既是一个最主要的免疫基因,也是一个关键的毒力基因[11-12]。在 CSFV 基因组中,E2基因的变异最大[12]。因此,分析流行毒株的E2基因,了解其抗原变异性,对研究CSFV多样性及其分子进化具有重要意义,有助于从分子水平揭示猪瘟免疫接种失败的原因。
本试验将CSFV FJ-1株的E2基因与标准毒株、国内部分分离株的核苷酸序列进行同源性分析。结果表明,该毒株与中国C株、HCLV株的同源性为94.2%、94.4%;与 Shimen 株 的 同 源 性 为91.5%;与Breseia标准参考株的同源性为90.7%;与Alfort/187、Alfort A19标准参考株的同源性均为92.3%,与国内Jiangxi、Guangxi、GZ2009、GXBH 分离株的同源性为 81%、93.1%、91.8%、98.1%;与GXBH 分离株的同源性最高,为98.1%。说明国内CSFV在分子流行病学上的分布呈多样性。虽然FJ-1株与中国使用的C株疫苗毒核苷酸同源性很高,但是遗传进化树分析表明FJ-1株在核苷酸水平上与C株存在一定的差异,处在一个独立的小分支上,这表明现行的猪瘟疫苗在一定程度虽然可以起到保护作用,但是FJ-1株正在向远离疫苗株的方向变异,这可能是导致福建省部分猪场猪瘟疫苗免疫失败重要原因。
E2基因为CSFV主要保护性抗原,可分为A、B、C、D 4个结构域,位于E2N端690位~866位氨基酸(aa),A 区 (766aa~866aa),可分为 A1、A2和A3 3个亚区,其中A1亚区能诱导机体产生中和抗体;B 区 (691aa~773aa)和 C 区 (691aa~800aa)为非保守区,是诱导机体产生中和抗体的主要部位;D区(766aa~800aa)不诱导产生中和抗体[5,14-18]。因此,E2 主 要 的 氨 基 酸 突 变 位 点 区 域(B、C区)某些氨基酸残基的改变可能导致毒株的抗原性发生变异[17]。结果显示,FJ-1株E2蛋白抗原结构与C-株没有很大差异。Van Rijn P A等[15]发现在B、C区域中的9处(705、710a、713、729、734、833、834、837、858aa)氨基酸的变异能影响抗原决定簇的保守性和特异单抗的产生。而FJ-1毒株主要抗原区(690aa~866aa)与C-株之间存在22个氨基酸的差异,由C-株到FJ-1野毒株的氨基酸变异分别是705(N→K)、713(A→V)、714(I→T)、715(R→Q)、768(P→S)、796(E→G)、834(Y→H)、837(P→L)、838(E→K)、843(P→L)、845(P→K)、850(T→A)、852(N→S)、856(G→V)、857(P→L)、858(L→S)、859(R→G)、861(V→F)、862(W→L)、865(V→L)、866(P→L)。与Van Rijn P A等[15]的研究相比,在705、713、834、837、858位有相同的变异,而在对A区抗原决定簇的保守区和对特异性单抗反应起决定作用的705、710、833、834位氨基酸,在705、834位氨基酸有相同的变异。结果说明FJ-1株E2蛋白的抗原表位与中国C株相比发生了漂移,这可能是近年来导致福建省猪瘟疫苗免疫失败的主要原因之一。
FJ-1株与C-株在主要抗原区的部分氨基酸发生了突变,该差异是否是导致猪瘟病毒变异的主要原因及是否会影响兔化弱毒疫苗对流行野毒株的免疫保护效果等都还需要进一步的研究。此外,本试验对E2基因全长进行了遗传变异分析,不仅补充了CSFV E2基因的分子生物学资料库,而且为分析流行毒株之间的亲缘关系,明确福建目前流行毒株的遗传进化及猪瘟防控与净化提供了理论依据。
[1] Jamin A,Gorin S,Cariolet R,et al.Classical swine fever virus induces activation of plasmacytoid and conventional dendritic cells in tonsil,blood,and spleen of infected pigs[J].Vet Res,2008(39):1-17.
[2] Ruggli N,Summerfield A,Fiebach A R,et al.Classical swine fever virus can remain virulent after specific elimination of the interferon regulatory factor 3-degrading function of Npro[J].J Virol,2009,83:817-829.
[3] Pereda A J,Greiser-Wilke I,Schmitt B,et al.Phylogenetic analysis of classical swine fever virus(CSFV)field isolates from outbreaks in South and Central America[J].Virus Res,2005,110:111-118.
[4] Wu C M,Hsuan S L,Chen Z W,et al.Expression and immunological studies of classical swine fever virus glycoprotein E2in the bi-cistronic baculovirus/larvae expression system[J]Biosci Biotech Bioch,2010(74):1343-1349.
[5] 刘 坤,兰邹然,姜 平.猪瘟病毒分子生物学及检测技术研究进展[J].动物医学进展,2012,33(10):99-104.
[6] Rümenapf T,Meyers G,Stark R,et al.Hog cholera virus:Characterization of specific antiserum and identification of cDNA clones[J].Virology,1989,171:18-27.
[7] 王启宇,兰邹然,姜 平,等.猪瘟病毒E2基因在毕赤酵母中的表达[J].动物医学进展,2012,33(9):66-69.
[8] 施明华.猪瘟免疫失败的原因分析[J].浙江畜牧兽医,2012(5):29-30.
[9] 刘咏梅.非典型性猪瘟的危害及防控措施[J].湖南畜牧兽医,2010(4):20-22.
[10] 杨 健,向智龙,欧德渊,等.猪瘟病毒贵州株E2基因序列的分析[J].贵州农业科学,2011,39(10):128-130.
[11] Dong X N,Chen Y H.Marker vaccine strategies and candidate CSFV marker vaccines[J].Vaccine,2007,25:205-230.
[12] Sun Y,Liu D F,Wang Y F,et al.Generation and efficacy evaluation of a recombinant adenovirus expressing the E2protein of classical swine fever virus[J].Res Vet Sci,2010,88:77-82.
[13] Lowings P,Ibata G,Needham J,et al.Classical swine fever virus diversity and evolution[J].J Gen Virol,1996,77:1311-1321.
[14] Wu Z,Wang Q,Feng Q,et al.Correlation of the virulence of CSFV with evolutionary patterns of E2glycoprotein[J].Front Biosci(Elite Ed),2010,2:204-220.
[15] Van Rijn P A,Miedema G K,Wensvoort G.Antigenic structure of envelope glycoprotein E1of hog cholera virus[J].J Virol,1994,68:3934-3942.
[16] Zhang H,Cao H W,Wu Z J,et al.A Review of molecular characterization of classical swine fever virus(CSFV)[J].Isr J Vet Med,2011,3:89-95.
[17] Zhang H,Wang Y H,Cao H W,et al.Phylogenetic analysis of E2genes of classical swine fever virus in China[J].Isr J Vet Med,2010,65:151-155.
[18] Shen H Y,Wang J Y,Dong X Y,et al.Genome and molecular characterization of a CSFV strain isolated from a CSF outbreak in south China[J].Int Virol,2013,56:122-133.

