犬细小病毒VP2基因测序分析
李世静,嵇辛勤,2*,主 性,阮 涌,傅心亮,王修江
(1.贵州大学动物科学学院,贵州贵阳550025;2.贵州省动物疫病研究室,贵州贵阳550025;3.贵阳市黔灵动物医院,贵州贵阳550004)
犬细小病毒病(Canine parvovirus disease)是由犬细小病毒(Canine parvovirus,CPV)引起的犬的一种急性传染病,以出血性肠炎或非化脓性心肌炎为特征,多发生于幼犬,病死率10%~50%[1]。犬细小病毒最早是在1977年由美国学者Eugster和Nain从患出血性肠炎的病犬粪便中首次观察到的[2],我国于1982年由徐汉坤等首次报道本病的流行。到目前为止,犬细小病毒有 CPV-2、CPV-2a、CPV-2b、CPV-2c(a)和 CPV-2c(b)5个亚型[3]。在我国,CPV-2曾在20世纪80年代早期流行,但1986年后全国范围内主要以CPV-2a占优势地位。2009年杜强等[4]用猫肾(F81)细胞分离鉴定出一株细小病毒为CPV-2a亚型。近年来,该病的诊断方法层出不穷,姜骞等[5]利用重组蛋白建立了间接ELISA检测方法,具有良好的特异性,与常见的犬病毒性传染病阳性血清无交叉反应,重复性良好,与商品化的试剂盒符合率高达96.5%,该方法具有较好的市场前景。林颖等[6]根据GenBank中犬细小病毒和犬冠状病毒基因序列个设计了一对引物,采用双重PCR方法对待检样品进行检测,从而建立了一种能够进行鉴别检测犬细小病毒和犬冠状病毒的双重PCR方法。温海等[7]根据CPV的VP2基因序列,设计4条LAMP特异性引物,对36份临床样本进行检测,结果显示,阳性检出率为80.5%(29/36),检出率高于普通 PCR72.2%(26/36),从而建立了一种利用LAMP检测犬细小病毒感染的新方法。
CPV基因组主要编码4种蛋白(VP1、VP2、NS1、NS2),其中VP1和VP2为结构蛋白。VP2是构成衣壳蛋白的主要组分,是病毒重要的抗原性蛋白,在诱导机体的免疫反应和病毒感染的过程中占主导地位,病毒的遗传变异也主要体现在此蛋白序列中[8]。CPV的中和抗原位点位于VP2上,VP2蛋白可诱导机体产生中和抗体。CPV VP2基因全长1 755bp,编码584个氨基酸,其基因序列决定着抗原和宿主的特异性。CPV容易产生新的突变株,其原因在于VP2基因的N端以及该基因上的蛋白转角结构区loop1和loop3是重要的B细胞抗原表位区,这些区域氨基酸残基的变化会导致其出现抗原漂移[9-11]。
为了解贵阳市CPV VP2基因变异情况,本研究选择CPV的VP2基因作为研究对象,采用PCR方法对其进行扩增,并将测序结果进行相关分析,为贵州省犬细小病毒病的防控提供理论依据及CPV新型疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 样本来源 试验粪便样本采集:经美国衡健犬细小病毒抗原快速检测试剂盒(产品货号:HG02-233)检测为阳性患犬粪便样本13份,均来自于贵阳市黔灵动物医院。
1.1.2 主要试剂 10×PCR buffer、Taq DNA 聚合酶为天根生物工程有限公司产品;dNTPs、DNA Marker DL 2 000、Goldview核酸染料均为宝生物工程(大连)有限公司产品;CPV抗原快速检测试剂盒为美国衡健生物科技有限公司产品;DNA/RNA小量试剂盒为海康生命科技有限公司产品。
1.2 方法
1.2.1 临床样品试剂盒检测 临床上采用试剂盒对疑似患犬的检样进行检测,步骤见说明书。
1.2.2 引物设计与合成 参照GenBank中报道的CPV VP2基因的核酸序列,设计一对特异性引物,其中上游引物为 CPV VP2(F1):5′-TGC CAG AAA GTG AAA ATT ATA G -3′;下 游 引 物 为CPV VP2(F2):5′-TAG TAG CTT CAG TAA TAT AGT T-3′。引物由上海生工生物工程技术服务有限公司合成,预计扩增片段为771bp。
1.2.3 样本DNA的提取及PCR方法的建立 用无菌生理盐水对粪样进行处理,按照DNA提取试剂盒说明书提取样本DNA。以提纯的CPV DNA 4μL为模板,上、下游引物各2μL,10×PCR buffer 5μL,dNTPs 2μL,Taq DNA聚合酶2μL,MgCl23μL,去离子水30μL的反应体系中进行PCR扩增。反应程序为:96℃3min;95℃30s,53℃30s,72℃80s,30个循环;72℃10min。PCR产物进行10g/L琼脂糖凝胶电泳,拍照。
1.2.4 序列测定及分析 将PCR阳性DNA送往上海生工生物工程技术服务有限公司进行测序。对本试验中3个测序结果的VP2基因序列进行比较,通过Blast从GenBank中截取的7个参考序列,经DNA Star进行序列编辑,将7个参考序列与测序结果一同通过DNA Star软件进行同源性比较,并对其进行遗传进化树的构建和分析。
2 结果
2.1 临床检测结果
阳性患犬基本信息见表1。患犬基本表现:病犬大多精神萎顿,鼻镜干燥,体温平均升高2℃~3℃,部分患犬流清鼻涕,有少量眼屎;初期无故干呕,后逐步发展为呕吐胃内容物及便血,重症者表现为严重脱水症状。

表1 患犬基本信息Table 1 The basic information of affected puppies
2.2 CPV VP2基因的PCR扩增结果
利用自行设计的引物进行PCR扩增后进行凝胶电泳,扩增结果与预期片段大小(771bp)相符(图1、图2)。
2.3 VP2基因测序结果
本研究随机挑选3个阳性PCR产物送往上海生工生物工程公司进行测序,结果用DNA Star处理后见图3。
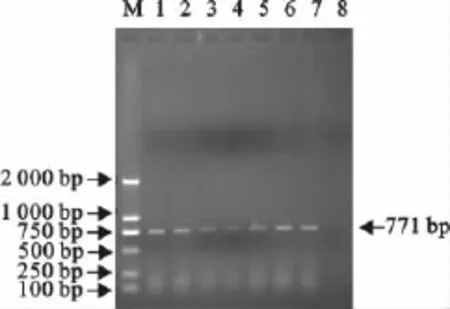
图1 犬CPV VP2基因的PCR扩增结果Fig.1 Amplification of VP2gene of canine by PCR

图2 犬CPV VP2基因的PCR扩增结果Fig.2 Amplification of VP2gene of canine by PCR

图3 3株试验株核苷酸序列比较结果Fig.3 The comparison of 3strain nucleotide sequences
3个试验株相比较而言,CPV-ZA在12、13、24、25、26位出现碱基缺失,相对于CPV-TD(1)而言,第1位由A→T,第5位由T→A,第16位由A→T,第21位由A→G,第22位由T→G,第29位由T→A。CPV-TD(1)相对于另外2株则在1、6、12、13、21、22、29、751位上出现改变。CPV-TD(2)则在1、9、10、11、12、13、29、46、744、751位发生碱基的缺失,而相对于CPV-ZA 而言,则在1、2、4、5、16、21、23位发生碱基改变,这些碱基的改变和缺失是导致3株试验株同源性不能达到100%的最重要的原因。
2.4 VP2核苷酸序列同源性比较
将检测出来的3株[CPV-TD(1)、CPV-TD(2)、CPV-ZA]犬细小病毒VP2基因的核苷酸序列与GenBank上登录的7株(国外分离株:CPV-15、CPV-31、CPV-39、CPV-133、CPV-b;国内分离株:B-2004、CPV-GN)犬细小病毒流行株经过DNA Star软件推导分析出不同毒株之间的同源性(表2)。表右上方为核苷酸同源性,左下方为核苷酸的差异度。从表2可看出,3个试验毒株的VP2基因核苷酸序列之间存在较高的同源性可达96.5%~97.3%;与7株参考毒株的同源性可达95.2%~96.8%。
2.5 进化树分析结果
为进一步分析3个试验毒株与国内外流行毒株在遗传进化上的关系,将试验株与参考毒株进行遗传进化树的构建(图4)。
依据进化树可看出,试验毒株之间存在着一定的亲缘性,与参考毒株之间的同源性不尽相同,其中以CPV-TD(2)与国内外流行毒株之间亲缘性最近,CPV-TD(1)与参考毒株之间的亲缘性较远,而CPV-ZA与参考毒株的亲缘性介于CPV-TD(2)和CPV-TD(1)之间。

表2 VP2基因的核苷酸序列同源性比较结果Table 2 The comparison of CPV VP2nucleotide sequence homology
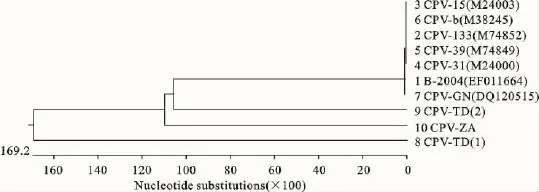
图4 CPV VP2基因进化树分析Fig.4 Phylogenetic tree for CPV VP2gene based on nucleotide sequences
3 讨论
随着分子生物学技术的发展,特别是聚合酶链式反应(PCR)技术的成熟,为CPV的检测提供了更为可靠的方法。本研究采用两种不同检测方法同时对犬细小病毒病进行检测,结果显示符合率高达76.9%。从二者符合率来看,试剂盒的灵敏性较高,但仍可能出现假阳性,这和患犬本身带毒量有关。该病自然潜伏期为7d~14d,潜伏期的不同阶段,犬的带毒量均不同,这给临检带来了一定的困难。现阶段CPV的遗传变异分析和基因进化树的构建主要依据VP2基因,本研究选用了CPV的VP2基因进行扩增并进行同源性和进化树的构建,结果表明,3个试验毒株VP2基因核苷酸序列之间同源性高达96.5%~97.3%;与7株参考毒株同源性可达95.2%~96.8%;3个试验毒株与国内外流行毒株存在一定亲缘性。可初步推断犬细小病毒病在贵州省广泛流行很有可能是由外地传入,但从目前犬细小病毒病的变异趋势来看,贵州省是否存在CPV的遗传变异情况,还需要更进一步的深入研究。
近年来,宠物犬的数量逐年递增,给CPV的防控带来了一定的压力,CPV发病率也逐年呈上升趋势。目前,针对CPV主要采用防制为主的原则,对其防控是以弱毒疫苗进行免疫预防,但弱毒疫苗在使用过程中也常出现一系列问题,如能引起免疫抑制、散毒和发生毒力返强及母源抗体干扰等[12],从而导致免疫失败。笔者认为免疫失败可能存在两个最主要原因:①防疫措施不到位,或者根本就没有进行任何疫苗的接种;免疫预防要取得满意结果,平时就必须严格执行兽医卫生防疫措施,坚持进行免疫注射,但免疫的程序与时机等因素都会影响幼犬的免疫效果[13]。②当地的流行毒株发生了新的变异从而导致免疫失败。随着变异毒株的不断出现,我国近年也首次报道出现CPV-2c的感染[14],证实在中国除了优势毒株CPV-2a和CPV-2b流行外,又新出现了CPV-2c,表明CPV在不断地变异。CPV毒株的变异具有重要的生物学意义,除了导致现有的弱毒疫苗免疫失败,还极有可能导致动物感染谱的扩大,尤其对野生动物存在潜在的威胁[15]。
因此,针对贵阳市的CPV分子流行病学调查研究,对于控制该病在贵阳市的流行就显得非常有必要。本研究通过对3个试验毒株VP2基因的序列分析与比对,对贵阳市CPV变异情况有了初步了解,可为贵阳市CPV的诊断以及防控措施提供重要参考。
[1] 蔡宝祥.家畜传染病学[M].4版.北京:中国农业出版社,2001:354.
[2] 陈博言.兽医传染病学[M].5版.中国农业出版社:北京,2006:422-423.
[3] Parrish C R,Have P,Foreyt W J,et al.The global spread and replacement of canine parvovirus strains[J].J Gen Virol,1988,69:1111-1116.
[4] 杜 强.犬细小的分离鉴定[J].动物医学进展,2009,30(3):55-58.
[5] 姜 骞,李慕瑶,刘家森,等.犬细小病毒ELISA抗体检测试剂盒的研制及应用[J].中国预防兽医学报,2009,31(2):141-144.
[6] 林 颖,耿庆华,付海滨,等.犬细小病毒和犬冠状病毒双重PCR方法的建立及应用[J].动物医学进展,2011,32(10):71-74.
[7] 温 海,秦海斌,朱 骞,等.环介导等温扩增技术快速检测犬细小病毒方法的建立[J].动物医学进展,2012,32(2):9-13.
[8] 杨 莘,王建科,易 立,等.FPLV、CPV、MEV非结构蛋白NS1和结构蛋白VP2遗传特征分析[J].动物医学进展,2011,32(12):31-36.
[9] 吴石金,周建群.运用ELISA快速检测CPV抗体方法的建立于均衡性研究[J].微生物学杂志,2002,22(4):14-15.
[10] 杨 玲,徐向明,殷 俊,等.犬细小病毒分离株VP2基因的克隆与序列分析[J].扬州大学学报:农业与生命科学版,2002,23(3):12-14.
[11] 祝兴林,何剑斌,赵玉军,等.CPV感染的研究现状[J].辽宁畜牧兽医,2004(10):40-42.
[12] 陈胜男,马素贞,陶玉成,等.犬细小病毒VP2基因的克隆表达与免疫印迹分析[J].新疆农业大学学报,2010,33(1):47-52.
[13] 马庆菊.犬细小病毒病防治研究[J].经济动物,2010(8):121-122.
[14] 张仁舟,杨松涛,冯 昊,等.中国国内首次检测到犬细小病毒CPV-2c[J].中国病原生物学杂志,2010,5(4):246-249.
[15] 杨晓农,张焕容,杨发龙,等.成都地区犬细小病毒VP2基因克隆分析及基因型鉴定[J].中国畜牧兽医,2011,38(9):105-110.

