NADPH氧化酶在肿瘤坏死因子-α致乳鼠心肌细胞肥大中的作用
苏兴利 张 鸿 王 爽 霍 健 郭玉芳 王 湘
(西安医学院基础医学部病理生理学教研室,陕西 西安 710021)
各种病因导致的心力衰竭是老年人死亡的主要原因,肿瘤坏死因子(TNF)-α在心脏疾病细胞因子假说中具有重要的地位,心肌组织可以产生内源性TNF-α,心肌细胞、局部巨噬细胞和血管平滑肌细胞都可以合成〔1〕。Yokoyama等〔2〕给予体外培养的成年猫心肌细胞TNF-α,心肌细胞蛋白合成增加了2.4倍。TNF-α的促心肌细胞肥大作用后来也被其他学者所证实。心衰患者循环中TNF-α的增加被认为是导致心脏功能降低,增加心衰致死率的主要因素。活性氧(ROS)是细胞氧化应激反应产物,研究发现ROS参与了心肌细胞肥大和凋亡,NADPH氧化酶是心肌组织ROS的主要来源。AngⅡ可通过NADPH氧化酶途径促进新生大鼠心肌细胞ROS生成并诱导心肌细胞蛋白合成〔3〕。TNF-α是否也由NADPH氧化酶源性ROS介导了心肌细胞肥大,目前尚未有报道。本研究在体外培养乳鼠心肌细胞,探索NADPH氧化酶在TNF-α诱导心肌细胞肥大中的作用,旨在进一步揭示TNF-α致心肌肥大的机制。
1 材料与方法
1.1 材料 SPF级SD乳鼠,由西安交通大学医学院动物中心提供。胎牛血清及DMEM培养基、TRIzol(Gibco公司),TNF-α(R&D 公司),夹竹桃麻素(apocycin,APO)、胰酶(Sigma公司),p22phox兔抗鼠抗体(Santa Cruz公司),RT-PCR试剂盒(TaKa-Ra公司),α-actin抗体、SP免疫组化染色试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司),BCA蛋白浓度检测试剂盒(上海生工公司),RIPA裂解液、活性氧检测试剂盒(上海碧云天生物技术研究所),内源性过氧化物酶阻断剂(广州深达生物制品技术有限公司),Image-Pro plus 6.0图像处理软件(美国Media Cybernetics公司)。
1.2 乳鼠原代心肌细胞的培养及鉴定 出生2 d的SD大鼠,无菌取心室肌,反复剪碎,用1.25 g/L胰酶和1 g/LⅡ型胶原酶消化。收集细胞悬液,过滤,以1 000 r/mim离心5 min。用100 ml/L胎牛血清的DMEM培养液重悬细胞,接种于培养瓶中。用差速贴壁法分离心肌细胞,置于50 ml/L CO2、37℃孵箱中培养24 h,细胞可出现搏动,免疫细胞化学抗α-actin染色鉴定心肌细胞的纯度。
1.3 实验分组 实验分为4组,每组6孔(n=6),即正常对照组(A组),TNF-α 组(B组 80 ng/ml),APO组 (C组100 μmol/L)和 TNF-α +APO 组,实验重复3次。
1.4 心肌细胞蛋白的BCA法测定 将心肌细胞以5×105个细胞/ml的密度接种于24孔板中,每组6孔,孵育48 h后,吸弃培养基,用PBS洗3次,每孔加入RIPA裂解缓冲液100 μl,充分接触细胞,冰浴下作用5 min后收集心肌细胞,超声破碎细胞,于4℃离心30 min。取上清液,按检测试剂盒的说明操作,计算每孔心肌细胞的蛋白质含量。
1.5 细胞内ROS的测定 DCHF-DA可以自由穿过细胞膜,被胞内酯酶水解生成DCHF,细胞内的活性氧可氧化无荧光的DCFH,生成有荧光的DCF,通过荧光强度反映细胞内的活性氧的水平。将各组细胞用无血清培养基稀释的10 μmol/L DCFHDA避光孵育37℃ 20 min,无血清培养液洗涤细胞3次,激光共聚焦显微镜观察,激发波长488 nm,发射波长525 nm,摄像。用Image-Pro plus6.0软件对图像进行分析,以平均光密度反应ROS的相对含量。
1.6 RT-PCR检测p22phox mRNA的表达 采用TRIzol法提取各实验组细胞总RNA,按照反转录试剂盒说明,以 Oligo(dT)18为引物,在20 μl体系中合成cDNA。以各组cDNA为模板,分别加入大鼠p22phox上、下游引物进行PCR,GAPDH作为内参照。p22phox上游引物为:5'-TCCACTTACTGCTGTCCGT-3',下游引物为:5'-TCAATGGGAGTCCACTGCT-3'。GAPDH 上游引物为:5'-TGAACGGGAAGCTCACTGG-3',下游引物为:5'-TCCACCACCCTGTTGCTGTA-3'。25 μl体系反应条件:94℃ 预变性 3 min,94℃ 变性 30s,退火 53℃ (p22phox 基因),56℃(GAPDH基因)30 s,72℃延伸45 s,共30个循环后,于72℃再延伸5 min。产物经1%琼脂糖凝胶电泳,Chemi-Genius Bio照相系统(Syngene,Cambridge,U.K.)采集图像并进行分析。以样品RNA为模板扩增时未见条带。
1.7 免疫细胞化学染色检测p22phox表达 制作各实验组细胞爬片,经多聚甲醛固定,PBS充分漂洗,3%H2O2灭活内源性过氧化物酶,正常山羊血清封闭,滴加一抗(p22phox兔抗鼠多克隆抗体,1∶100),湿盒中4℃过夜,滴加二抗,辣根过氧化物酶标记的链霉卵白素孵育,DAB显色,苏木素复染,脱水透明封片。Nikon E200显微镜照相,镜下观察摄像,阴性对照以PBS代替一抗。每组随机选取至少5个高倍视野采集数码照片,用Image-Pro plus6.0图像处理软件进行分析,以平均光密度反应免疫阳性产物含量。
1.8 统计学处理 数据分析采用SPSS15.0软件,实验结果用±s表示,两组间均数比较采用t检验,多组均数比较采用ANOVA方差分析。
2 结果
2.1 乳鼠心肌细胞的鉴定及纯度 倒置显微镜下观察,培养细胞呈圆形或椭圆形,贴壁后细胞为多角形,搏动效果较好,抗α-actin免疫细胞化学染色阳性率大于95%,说明培养细胞主要为心肌细胞,细胞纯度达到实验要求。
2.2 心肌细胞蛋白合成检测结果 给予心肌细胞80 ng/ml TNF-α作用48 h后,心肌细胞蛋白合成与对照组比较,增加了65.8%(P<0.01),显微镜下观察,细胞体积增大,说明TNF-α具有刺激心肌细胞蛋白合成,导致细胞肥大的作用。AOP单独作用,对心肌细胞蛋白合成无明显影响,但可将TNF-α促心肌细胞蛋白合成降低89.8%(P<0.01)。提示TNF-α的作用可能与增强NADPH氧化酶活性有关。
2.3 心肌细胞活性氧水平检测结果 图1所示,TNF-α作用心肌细胞后,与对照组比较,绿色荧光明显增强,ROS含量增加61%(P<0.01),APO作用后,荧光较对照组略强。APO可将TNF-α诱导心肌细胞ROS产生的作用降低84.6%(P<0.01),提示TNF-α致心肌细胞肥大作用可能与NADPH氧化酶介导ROS产生有关。
2.4 心肌细胞p22phox mRNA表达结果 如图2所示,TNF-α作用心肌细胞后,NADPH氧化酶亚基p22phox mRNA表达水平明显增加,与对照组比较,表达水平增加65.4%(P<0.01),APO组p22phox mRNA表达水平略有下降,APO可明显逆转TNF-α对p22phox mRNA表达的影响(P<0.01)。说明TNF-α可能通过上调p22phox基因表达介导心肌细胞ROS的产生。

图1 各组心肌细胞ROS生成比较
2.5 心肌细胞p22phox蛋白表达结果 图3可见,TNF-α作用心肌细胞后,NADPH氧化酶亚基p22phox蛋白表达水平明显增加,与对照组比较,表达水平增加112.3%(P<0.01),APO可将TNF-α促p22phox表达作用降低91.2%(P<0.01)。进一步提示TNF-α通过上调NADPH氧化酶亚基p22phox表达水平介导心肌细胞ROS的产生。

图2 各组心肌细胞NADPH氧化酶亚基p22phox mRNA表达
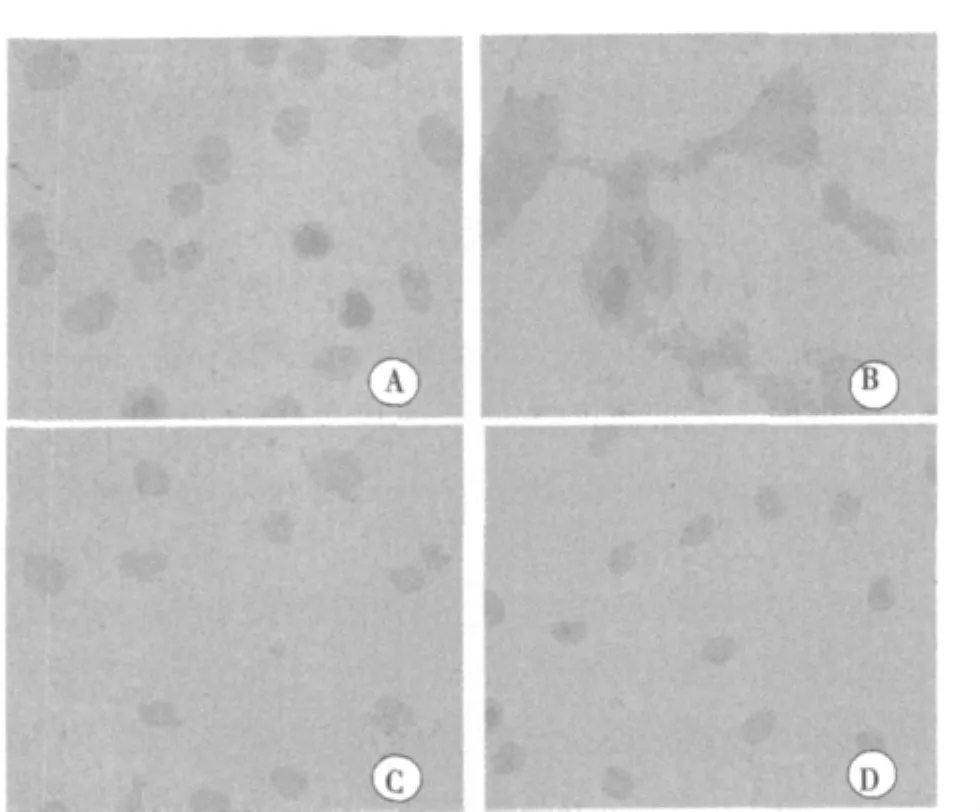
图3 各组心肌细胞NADPH氧化酶p22phox蛋白表达(×400)
3 讨论
近年来实验和人体研究发现NADPH氧化酶来源的ROS在心血管重塑中具有重要作用。NADPH氧化酶是多种蛋白酶的复合物,可通过催化电子从NADPH转移至分子氧而产生超氧化物。根据催化亚基的不同,分为5种亚型,分别是Nox1~Nox5。Nox1、Nox2和Nox4在心血管细胞表达。与其他来源的ROS,如线粒体、黄嘌呤氧化酶和解偶联的 NO合酶相比较,NAPDH氧化酶主要被特异的激动剂刺激后产生ROS,特别是AngⅡ、ALD、TNFα、TGFβ、PDGF 和机械应力〔4〕。实验证实,NADPH氧化酶来源的ROS在内皮功能障碍、动脉粥样硬化、糖尿病血管病变、RAAS相关的高血压和缺血性血管重塑中发挥重要作用〔5〕。TNF-α是一种具有多种生物效应的细胞因子,在炎症、细胞生存、生长、分化和凋亡等生理和病理过程中具有重要作用〔6〕。结合文献报道和我们前期的研究发现,压力超负荷大鼠心肌组织中TNF-α的浓度升高,并伴随心肌细胞肥大,提示在压力应激下,TNF-α可能以自分泌、旁分泌的方式参与了超负荷下的心肌重构〔7〕。离体实验发现,TNF-α呈浓度依赖性的刺激乳鼠心肌细胞蛋白合成,心肌细胞体积增大。而且TNF-α还可促进心肌细胞内源性分泌AngⅡ,促进心肌细胞AT1受体表达增加,提示TNF-α和AngⅡ都参与了心肌细胞的肥大反应。有研究发现,AngⅡ刺激培养的心肌成纤维细胞,通过NADPH氧化酶p22phox亚基促进ROS产生,可能参与了心肌组织病变的发生〔8〕。在压力超负荷心肌肥厚大鼠模型的实验研究也证实NADPH氧化酶源性的ROS参与了心肌肥大的发生〔9〕。由此提示心肌组织ROS的产生与心肌肥大病变存在密切关系。TNF-α作用于培养的动脉平滑肌细胞,NADPH氧化酶亚基p22phox mRNA表达增加,ROS生成明显增多,应用反义p22phox cDNA转染平滑肌细胞,则TNF-α不能引起ROS的产生增加〔10〕,这说明TNF-α是通过 p22phox表达增加导致NADPH氧化酶活性增强,而介导ROS产生的。
本研究发现,TNF-α可刺激乳鼠心肌细胞蛋白合成增加,ROS生成增多,引起心肌细胞肥大,应用NADPH氧化酶抑制剂可逆转TNF-α的作用,说明TNF-α通过心肌NADPH氧化酶活性增加导致心肌ROS生成介导了心肌细胞肥大。通过基因水平和蛋白水平的研究提示,NADPH氧化酶活性的增强可能与其亚基p22phox高表达有关。从而表明TNF-α可能是通过增加心肌细胞NADPH氧化酶亚基p22phox表达,导致心肌细胞NADPH氧化酶活性增强,引起心肌组织ROS生成,从而介导了心肌细胞肥大,参与了氧化应激下的心肌重塑。
1 Armstrong EJ,Morrow DA,Sabatine MS.Inflammatory biomarkers in acute coronary syndromes,part I:introduction and cytokines〔J〕.Circulation,2006;113(6):e72-e75.
2 Yokoyama T,Nakano M,Bednarczyk JL,et al.Tumor necrosis factor-alpha provokes a hypertrophic growth response in adult cardiac myocytes〔J〕.Circulation,1997;95(5):1247-52.
3 Nakagami H,Takemoto M,Liao JK.NADPH oxidase-derived superoxide anion mediates angiotensin II-induced cardiac hypertrophy〔J〕.J Mol Cell Cardiol,2003;35(7):851-9.
4 Griendling KK.Sorescu D,Ushio-Fukai M.NAD(P)H oxidase:role in cardiovascular biology and disease〔J〕.Circ Res,2000;86(5):494-501.
5 Maejima Y,Kuroda J,Matsushima S,et al.Regulation of myocardial growth and death by NADPH oxidase〔J〕.J Mol Cell Cardiol,2011;50(3):408-16.
6 Haudek SB,Taffet GE,Schenider MD,et al.TNF provokes cardiomyocyte apoptosis and cardiac remodeling through activation of multiple cell death pathways〔J〕.J Clin Invest,2007;117(9):2692-701.
7 苏兴利,高广道,罗秀成,等.大鼠压力负荷性肥大心肌中TNF-α mRNA表达变化〔J〕.中国病理生理杂志,2004;20(8):1414-7.
8 国 荣,周 娟,邓秀玲,等.心肌成纤维细胞在血管紧张素II作用中活性氧水平及p22phox的表达〔J〕.南方医科大学学报,2009;29(2):202-4.
9 刘 艳,袁祖贻,田雨灵,等.心肌AngⅡ和NADPH氧化酶源性的ROS在心肌肥厚中的作用〔J〕.中国分子心脏病学杂志,2009;9(6):348-52.
10 De Keulenaer GW,Alexander RW,Ushio-Fukai M,et al.Tumour necrosis factor alpha activates a p22phox-based NADH oxidase in vascular smooth muscle〔J〕.Biochem J,1998;329(Pt 3):653-7.

