体外法评定大豆低聚糖对乳酸菌增殖和抑菌效果的影响
王 晶,季海峰,王四新,张董燕,刘 辉,王雅民
(北京市农林科学院畜牧兽医研究所,北京 100097)
乳酸菌类微生态制剂具有良好生物学功能和益生特性,近年来受到研究者广泛关注。大量研究已证实乳酸菌制剂在动物生产中应用,可以抑制肠道病原菌繁殖,从而防止动物腹泻、增加营养物质利用率、提高其生产性能[1-2]。但是,这些益生作用显著菌株在通过动物胃肠道前消化道时易被酸性环境破坏,导致到达后肠段存活率低、有效菌数少,同时饲料加工、运输过程,以及保存方式等对其存活率也有很大程度影响。因此,限制了乳酸菌类益生菌制剂益生作用有效发挥。有研究表明虽然益生素寡糖本身不具有营养作用,不能被动物消化道吸收利用,但其到达消化道后肠段后能被其中有益微生物选择性地利用,从而促进肠道有益菌群增殖,起到改善宿主健康、提高生产性能作用。近年来已有研究将乳酸菌与寡糖进行配伍使用以提高益生菌益生效果。
大豆低聚糖(Soybean oligosaccharides,SBOS)是大豆中含有2~10个单糖基低分子糖类总称,其主要成分是水苏糖、棉子糖和蔗糖。大豆低聚糖来源广泛,其特性及生理保健功能近年来得到广泛研究与开发[3]。以往研究表明,大豆低聚糖对不同菌株促进生长作用结果不尽相同[4]。植物乳杆菌(Lactobacillus plantarum ZPL001)是本试验室从健康仔猪肠道中成功分离的一株有益菌株。前期研究结果表明,大豆低聚糖是可被植物乳杆菌ZLP001选择性利用低聚糖之一。为进一步研究植物乳杆菌与大豆低聚糖实际配伍效果,获得更有效合生素产品,主要从体外探讨大豆低聚糖代替葡萄糖作为培养基碳源对植物乳杆菌生长和抑菌效果影响,探寻促进益生菌生长有效途径,为植物乳杆菌与寡糖科学配伍和更有效合生素产品开发提供科学依据。
1 材料与方法
1.1 菌株及寡糖
研究所用植物乳杆菌ZLP001(Lactobacillus plantarum ZLP001)为本试验室分离自健康仔猪肠道,已通过中国工业微生物菌种保藏管理中心鉴定。大豆低聚糖(Soybean oligosaccharides,SBOS)购自山东荔诺生物科技有限公司,纯度为90%。
1.2 培养基
植物乳杆菌活化和平板计数用MRS培养基,大肠杆菌、金色葡萄球菌和沙门氏菌活化和抑菌圈测定用Mueller Hinton培养基。
1.3 试验方法
活化:将植物乳杆菌冻存菌液以1%接种量接种于MRS液体培养基中,37℃恒温培养18 h备用(活菌数相当于109CFU·mL-1)。抑菌试验指示菌(大肠埃希菌、猪霍乱沙门菌、金黄色葡萄球菌)种子菌液以1%接种量分别接种于MH液体营养基中,37℃恒温培养18 h备用(活菌数相当于109cfu · mL-1)。
增殖试验:以不同剂量大豆低聚糖代替葡萄糖作为MRS培养基碳源,添加浓度分别为0%,1%,3%,5%,7%(m/V),进行植物乳杆菌ZLP001体外培养,温度为37℃。分别于培养后0、3、6、9、12和24 h测定发酵液pH值、OD600nm值和乳酸生成量,并于24 h测定活菌数,以确定最适添加比例。
生长曲线:通过上述试验,确定大豆低聚糖作为碳源在MRS培养基中最适添加比例。按1%接种量,将活化好菌液接种到已灭菌以大豆低聚糖为碳源MRS液体培养基中,采用Bioscreen全自动生长曲线分析仪(谓载国际集团(香港)有限公司)连续测定48 h。测定条件为37℃,每隔1 h测定一次菌液OD600nm。
抑菌试验:在灭菌平板中,注入10 mL 2%灭菌琼脂,冷凝后,放入已灭菌牛津杯,再将含有1%已活化并稀释至106指示菌营养琼脂培养基20 mL注入平板,冷凝后取出牛津杯。孔中注入200 μL已用葡萄糖和大豆低聚糖分别培养植物乳杆菌发酵液、离心上清液或沉淀后菌悬液,无糖培养基作为空白对照。平板放置在4℃扩散4 h,37℃培养10 h后,测量抑菌圈直径,每个处理做3次重复。
1.4 指标测定
OD600nm测定:于接种后0、3、6、9、12、24 h取发酵液用UV-4802型紫外可见分光光度计(上海尤尼柯仪器有限公司)测OD600nm值,以未接种培养基作为空白对照调零。
pH值测定:于接种后0、3、6、9、12、24 h使用pH 213型酸度计(北京哈纳公司)测定发酵液pH值。
乳酸浓度测定:乳酸浓度测定参照张龙翔等[5]方法进行。分别取发酵0、3、6、9、12、24 h后发酵液于-20℃保存,比色法测定乳酸浓度。
平板计数:取一定时间发酵液,采用10倍梯度倍比稀释法对其进行稀释,用MRS培养基以平板涂布法对植物乳杆菌进行计数。平板于37℃培养48 h计数。
1.5 数据分析
数据采用SPSS(13.0)软件One-Way ANOVA程序进行显著性分析,图中数据标注标准差,表中数据以平均值±标准差表示。
2 结果与分析
2.1 大豆低聚糖作为碳源对植物乳杆菌OD值影响
图1显示不同浓度大豆低聚糖作为碳源对植物乳杆菌发酵液OD600nm值影响。从图可以看出,随着图1培养时间延长,添加大豆低聚糖发酵液OD600nm值均呈明显上升趋势,24 h时,添加不同浓度大豆低聚糖OD600nm值分别为1.69、1.78、1.58、1.36。没有添加糖对照组增速则非常缓慢,到24 h时,其OD值仅为0.40。说明大豆低聚糖添加对植物乳杆菌体外生长有明显促进作用。当寡糖添加比例达到3%或5%时,植物乳杆菌增殖效果最好,24 h活菌数可以达到109cfu·mL-1以上。而当大豆低聚糖添加比例达到7%时,植物乳杆菌生长有明显降低,仅为108cfu·mL-1。
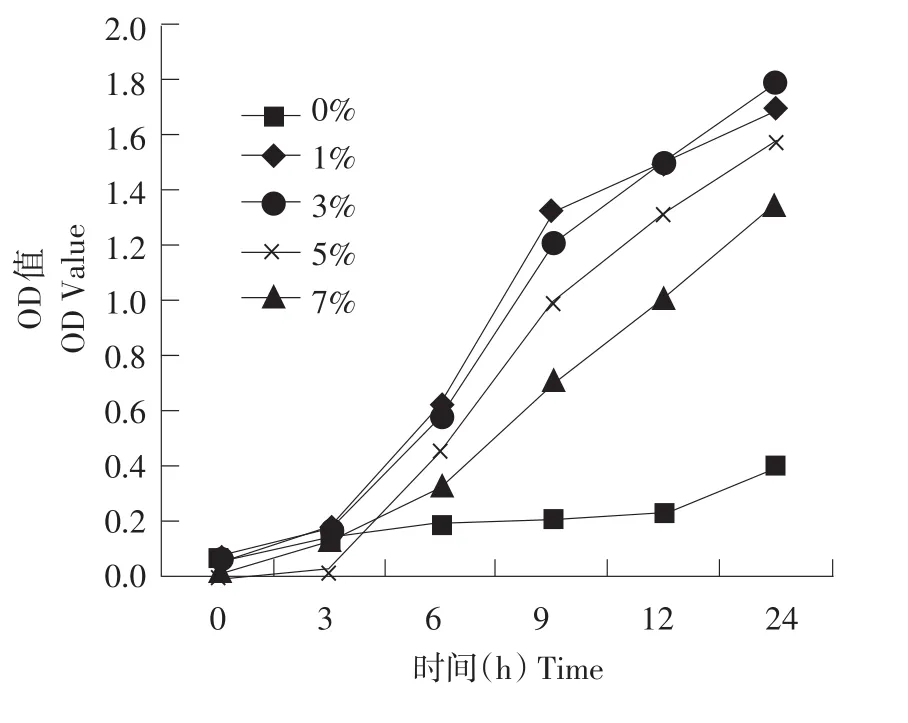
图1 不同浓度大豆低聚糖对植物乳杆菌发酵液OD600nm影响Fig.1 Effect of different level of soybean oligosaccharide on OD600nmof fermentation broth of Lactobacillus plantarum ZLP001
2.2 大豆低聚糖作为碳源对植物乳杆菌pH影响
不同浓度大豆低聚糖作为碳源对植物乳杆菌发酵液pH影响趋势则与OD600刚好相反(见图2)。随着培养时间延长,添加大豆低聚糖发酵液pH值均呈明显下降趋势,24 h时,添加不同浓度大豆低聚糖pH分别为5.00、4.32、4.30、4.43。没有添加糖对照pH没有表现明显降低,反而到24 h时,其pH还略有升高。结果表明,植物乳杆菌可以利用培养基中大豆低聚糖产生酸性物质,使得发酵液pH迅速降低。
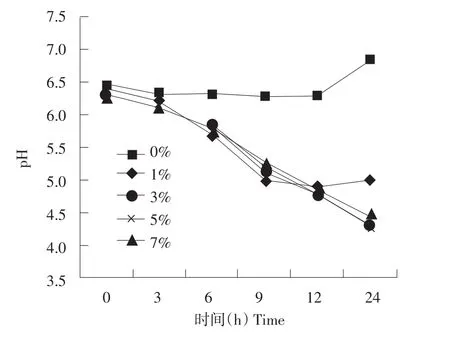
图2 不同浓度大豆低聚糖对植物乳杆菌发酵液pH影响Fig.2 Effect of different level of soybean oligosaccharide on pH of fermentation broth of Lactobacillus plantarum ZLP001
2.3 大豆低聚糖对植物乳杆菌发酵液乳酸浓度影响
大豆低聚糖作为碳源对于植物乳杆菌发酵液中乳酸生成量影响如图3所示。

图3 不同浓度大豆低聚糖对植物乳杆菌发酵液乳酸生成量影响Fig.3 Effect of different level of soybean oligosaccharide on lactic acid production of Lactobacillus plantarumZLP001
随着植物乳杆菌培养时间延长,添加大豆低聚糖发酵液中乳酸生成量明显上升,24 h时,添加不同浓度大豆低聚糖(1%~7%)乳酸生成量分别为47.80、66.53、59.52、58.44 mmol· L-1。没有添加糖对照组乳酸生成量只有小幅增加,到24 h时其乳酸含量仅为7.79 mmol·L-1。结果说明,植物乳杆菌正是发酵和利用大豆低聚糖产生乳酸等酸性物质,从而使发酵液呈酸性环境。
2.4 大豆低聚糖作为碳源植物乳杆菌生长曲线
植物乳杆菌在不同碳源条件下形成生长曲线如图4所示。
由图4可见,在0~32 h内,葡萄糖和大豆低聚糖添加可以明显增加植物乳杆菌增殖速度,均可作为植物乳杆菌良好碳源。大豆低聚糖作为碳源相比于葡萄糖作为碳源,植物乳杆菌迅速进入对数生长期,适应期短,且对数生长期较长,至16 h进入稳定期,生长后期OD值也略高于葡萄糖作为碳源。此外,两种碳源在32 h时均未出现明显衰亡表现,说明稳定期较长。

图4 植物乳杆菌生长曲线(不同碳源)Fig.4 The growth curve of Lactobacillus plantarumZLP001(different carbon source)
2.5 大豆低聚糖作为碳源植物乳杆菌抑菌特性
本研究对大豆低聚糖作为碳源对植物乳杆菌抑菌特性进行研究,并以葡萄糖作为碳源和不添加碳源作为比较(见表1)。结果表明,植物乳杆菌对大肠杆菌、金色葡萄球菌和沙门氏菌都有一定抑制作用,而且其抑菌效果主要表现在发酵液和上清液,菌泥不表现抑菌性。相比于没有添加任何糖无糖培养基,葡萄糖和大豆低聚糖添加都能明显增加植物乳杆菌抑菌性。而利用葡萄糖或大豆低聚糖作为植物乳杆菌碳源,对植物乳杆菌本身抑菌特性没有明显影响,只有葡萄糖为碳源发酵液对沙门氏菌抑菌性显著高于大豆低聚糖作为碳源。
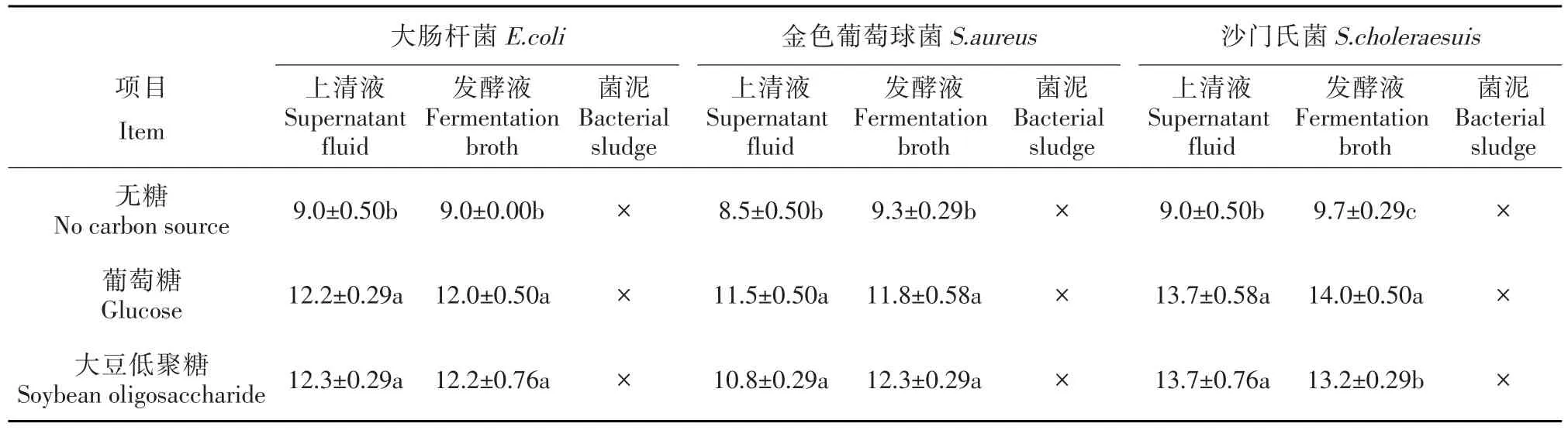
表1 大豆低聚糖作为碳源对植物乳杆菌抑菌特性研究(抑菌圈,mm)Table1 Effect of soybean oligosaccharide as carbon source on antibacterial characteristic of Lactobacillus plantarum ZLP001
3 讨论
有关大豆低聚糖对乳酸杆菌选择性利用报道较少,本研究针对大豆低聚糖对植物乳杆菌增殖和抑菌特性影响进行体外研究。研究结果表明,大豆低聚糖添加对猪源植物乳杆菌ZLP001体外增殖有明显促进作用,可以显著提高乳酸菌活菌数,降低发酵液pH。大豆低聚糖表现最佳效果添加比例为3%。
罗予等体外研究结果表明,按1%大豆低聚糖含量配制培养基,可明显促进肠道菌群中双歧杆菌生长,经24 h培养,添加大豆低聚糖培养液其OD600nm值>1.5,pH降到4.3[4]。本研究中当大豆低聚糖添加比例达到7%时,活菌数较添加3%和5%时明显下降,这说明乳酸菌在培养过程中,代谢糖发酵后产生代谢产物过多,可能使细菌生长产生自限性,因此碳源量过高反而会抑制菌生长。这和郝林华等[6]利用低聚果糖体外增殖双歧杆菌和李艳丽等[7]利用低聚木糖体外增殖乳酸杆菌和枯草芽孢杆菌试验结果一致。此外,熊德鑫等[8]研究表明,低聚葡甘糖和低聚异麦芽糖对双歧杆菌促生长作用有明显梯度效应,随着低聚糖添加比例增加(0.5%~2%),促生长作用明显增加。而李晓卉[9]研究低聚果糖和低聚异麦芽糖对双歧杆菌和乳酸杆菌增殖作用则不呈现梯度效应,0.2%~1%添加比例均无显著差异。这和本试验结果有些不同,其原因有可能是寡糖种类和纯度或不同乳杆菌菌种造成,也有可能是添加梯度比例设置不同造成。
乳酸是乳酸菌经糖酵解途径关键终产物之一,它能够降低消化道pH,从而抑制病原菌生长和繁殖[10]。本研究测定不同大豆低聚糖添加比例发酵24 h内发酵液中乳酸生成量变化。由结果可以看出,随着发酵时间延长,发酵液中乳酸生成量不断增加,这和Rycroft等[11]利用低聚果糖和龙胆低聚糖体外发酵以及张晓萍等[12]利用低聚木糖体外发酵青春双歧杆菌生成乳酸趋势是相同。此外,发酵液中乳酸浓度上升和pH下降存在着很强一致性,说明pH下降确由乳酸等代谢产物生成引起。本研究中大豆低聚糖3%添加比例,其乳酸生成量要达到66.53 mmol· L-1。这要比Rycroft等[13]报道体外发酵大豆低聚糖(乳酸产量为18.90 mmol·L-1)所产生乳酸量高。其可能原因是研究所利用寡糖来源和有效成分含量以及不同菌种代谢能力和产酸能力不同造成。
大豆低聚糖作为碳源能够有效促进植物乳杆菌增殖,形成典型生长曲线。本研究绘制大豆低聚糖添加比例为3%时植物乳杆菌生长曲线,并与葡萄糖和不添加碳源对照组进行对比。相比于葡萄糖作为碳源,大豆低聚糖可使植物乳杆菌迅速进入对数生长期,且缩短适应期,延长对数生长期,稳定期OD值也略高于葡萄糖。吴大畅等[14]用壳寡糖取代MRS培养基中葡萄糖后,并不能有效促进乳酸杆菌增殖,且不能形成典型生长曲线。但当以1 g·L-1壳寡糖比例加入正常MRS培养其中,却可以明显提高乳酸杆菌增殖速度,提前进入对数生长期,缩短生长适应期,且对数生长期延长。其研究结果表明,壳寡糖与葡萄糖协同作用更适于为乳酸杆菌生长提供碳源。大豆低聚糖与葡萄糖是否对植物乳杆菌增殖有明显协同作用还需进行后续研究来证明。
植物乳杆菌可以分泌细菌素等抗菌物质,从而体现一定抑菌特性[15]。本研究结果可以看出,利用葡萄糖和大豆低聚糖作为植物乳杆菌碳源,对植物乳杆菌本身抑菌特性影响没有明显差别。这有可能是因为葡萄糖和大豆低聚糖被植物乳杆菌利用代谢途径(糖酵解途径或磷酸戊糖途径)和代谢产物(乳酸、乙酸和乙醇)相似,以使抑菌物质组成和产生量差异不大适成。植物乳杆菌是兼性乳酸发酵菌,同时进行同型乳酸发酵和异型乳酸发酵,这两种代谢进行程度和比例取决于菌种性质和外界培养条件,从而影响其抑菌特性。这一点还需要进行更进一步研究和验证。另外,虽然研究表明大豆低聚糖本身可能具有一定抑菌作用[16-17],但本试验中大豆低聚糖仅作为植物乳杆菌碳源,到发酵后期被利用已经所剩无几,因此对抑菌特性未表现明显影响。
4 结论
大豆低聚糖对植物乳杆菌体外生长具有显著促进作用。培养基中大豆低聚糖适宜添加比例为3%时表现最好增殖效果。大豆低聚糖作为植物乳杆菌碳源,和葡萄糖相比对植物乳杆菌本身抑菌特性没有明显影响。
[1]刘虎传,张敏红,冯京海,等.益生菌制剂对早期断奶仔猪生长性能和免疫指标影响[J].动物营养学报,2012,24(6):1124-1131.
[2]徐基利,许丽.不同乳酸菌及其添加水平对肉仔鸡生长性能、免疫机能和肠道结构影响[J].动物营养学报,2011,23(11):1976-1983.
[3]蔡琨,苏东海,陈静,等.大豆低聚糖生理功能研究进展[J].中国食物与营养,2012,18(12):56-61.
[4]罗予,毛理纳,蔡访勤.大豆低聚糖对肠道双歧杆菌和肠杆菌促生长作用[J].现代生物医学进展,2007,7(3):399-400.
[5]张龙翔,张庭芳.生化实验方法和技术[M].北京:高等教育出版社,1997,90-95.
[6]郝林华,陈靠山,李光友.牛蒡寡糖对双歧杆菌体外生长促进作用[J].海洋科学进展,2005,23(3):347-352.
[7]李艳丽,许少春,柳永,等.低聚木糖制备及其对益生菌体外增殖作用[J].浙江大学学报(农业与生命科学版),2011,37(3):245-251.
[8]熊德鑫,李剑秋,徐殿霞,等.低聚糖体外选择性促进双歧杆菌生长研究[J].食品科学,1998,19(6):24-36.
[9]李晓卉.低聚糖体外促进肠道有益菌增殖研究[J].青海畜牧兽医杂志,2009,39(2):15-16.
[10]Vázquez J A,González M P,Murado M A.Effects of lactic acid bacteria cultures on pathogenic microbiota from fish[J].Aquacul⁃ture,2005,245:149-161.
[11]Rycroft C E,Jones M R,Gibson G R,et al.Fermentation proper⁃ties of gentio-oligosaccharides[J].Letters in Applied Microbiolo⁃gy,2001,32:156-161.
[12]张晓萍,勇强,余世袁.青春双歧杆菌体外代谢低聚木糖研究[J].南京林业大学学报(自然科学版),2010,34(1):5-8.
[13]Rycroft C E,Jones M R,Gibson G R,et al.A comparativein vitro evaluation of the fermentation properties of prebiotic oligosaccha⁃rides[J].Journal of Applied Microbiology,2001,91:878-887.
[14]吴大畅,王丽新,张翠丽,等.壳寡糖对乳酸杆菌体外生长影响[J].现代生物医学进展,2012,12(5):849-851,839.
[15]Cebeci A,Gürakan C.Properties of potential probiotic Lactobacil⁃lus plantarum strains[J].Food Microbiology,2003,20:511-518.
[16]刘欣,冯杰.大豆低聚糖生理功能及其应用[J].中国饲料,2005,6:15-16.
[17]Lan Y,Williams B A,Verstegen M W A,et al.Soy oligosaccha⁃rides in vitro fermentation characteristics and its effect on caecal microorganisms of young broiler chickens[J].Animal Feed Sci⁃ence and Technology,2007,133:286-297.

