丹参酮IIA对脑缺血再灌注损伤大鼠磷酸化p38MAPK和MMP-9表达及细胞凋亡的影响
李 浩, 张多斌, 吴 岚, 冯华坤
研究表明,脑缺血再灌注损伤发生后,细胞内p38 MAPK信号通路激活,参与了脑缺血神经元死亡过程的调控[1]。脑组织中基质金属蛋白酶9(matrixme talloproteinase,MMP-9)与缺血后血脑屏障损伤密切相关[2]。丹参酮ⅡA(Tanshinone ⅡA,TanⅡA)为丹参酮中含量最高的活性成分,我们前期研究发现,TanⅡA对大鼠脑缺血再灌注损伤具有保护作用,其机制与抑制炎症和凋亡基因蛋白表达有关[3~7],但是否对神经细胞凋亡和血脑屏障有影响?本实验通过建立大鼠局灶性脑缺血再灌注模型,研究TanⅡA对大鼠脑缺血再灌注损伤磷酸化p38MAPK和MMP-9表达的影响及对细胞凋亡的作用,进一步探讨其保护作用的可能分子生物学机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 雄性SD大鼠,清洁级,质量300±20g,桂林医学院SPF级动物实验中心提供。随机分成Sham组、IR组、TanⅡA高、低剂量治疗组,每组15只。
1.1.2 药品和试剂 TanⅡA(陕西昂盛生物医药科技有限公司提供,纯度98%);2,3,5-三苯基氯化四氮唑(TTC)(Sigma公司);兔抗MMP-9抗体,兔抗p38多克隆抗体、SABC免疫组化试剂盒、T UNEL试剂盒和DAB显色试剂盒均由武汉博士德生物工程有限公司提供。
1.2 方法
1.2.1 给药途径与药量 TanⅡA低剂量治疗组(15mg/kg)和高剂量治疗组(30mg/kg)均于术前连续灌胃给药3d,每天1次;假手术组和缺血再灌注组给予等量的生理盐水灌胃。3d给药后1h建立局灶性脑缺血120min再灌注24h动物模型。
1.2.2 动物模型的建立及评分 参照Longa等[8]的方法制备大鼠局灶性脑缺血再灌注模型。采用颈外动脉插入线栓法,各组均进行左侧大脑中动脉栓塞,线栓采用石蜡线栓。线栓直径约0.27mm,插入深度约18mm,此时线栓头位于大脑中动脉起始部。缺血90min时,抽提线栓实现再灌注。神经功能缺陷评分:按照Longa等[8]评分标准,各组分别在再灌注24h进行评分。0分:正常,无神经学征象;1分:动物不能完全神展右前肢;2分:动物右侧肢体瘫痪,行走时向右侧转圈,出现追尾现象;3分:动物行走向右侧跌倒,或动物不能站立或动物打滚;4分:无自发活动,有意识障碍。神经功能缺陷评分在1~3分为模型成功。0分和4分为模型不成功予剔除,在后续实验中补充剔除出组的动物,保证每组动物数。
1.2.3 免疫组化检测 缺血再灌注后24h,各组随机取5只大鼠,生理盐水和多聚甲醛进行心脏灌流固定,断头取脑。在左侧大脑半球距离嗅球尖端7~11mm之间冠状切取约5mm厚脑组织块,固定、脱水、包埋成腊块,连续切片,厚5μm。用SABC法进行磷酸化p38MAPK和MMP-9蛋白的免疫组织化学染色;阴性对照片用PBS液代替一抗。磷酸化p38MAPK阳性反应为细胞浆呈现棕黄色粒状或点状免疫标记,MMP-9阳性反应为细胞浆棕黄色淡染。于每个鼠脑分别取磷酸化p38MAPK和MMP-9切片,每张切片分别随机选取左侧大脑半球额顶部皮质5个不重复高倍镜视野(×400),计数每个视野阳性细胞数,算出平均数即为每张切片阳性细胞数。
1.2.4 细胞凋亡的检测 再灌注24h,各组随机取5只大鼠,用生理盐水和多聚甲醛进行心脏灌流固定,断头取脑。在左侧大脑半球距离嗅球尖端7~11mm之间冠状切取约5mm厚脑组织块,固定、脱水、包埋成腊块,连续切片,厚5μm。连取5张,1张作HE染色,其余4张作细胞凋亡。采用TUNEL法检测细胞凋亡,具体操作按试剂盒说明书进行。以胞核出现棕黄染色颗粒代表 TUNEL阳性细胞数。每张切片分别随机选取左侧大脑半球额顶部皮质5个不重复高倍镜视野(×400),计数每个视野阳性细胞数,算出平均数即为每张切片阳性细胞数。计数T UNEL阳性细胞数和细胞总数,以 T UNEL阳性率表示细胞凋亡。
1.2.5 血脑屏障通透性检测 参照 Matsuo等[9]的方法,采用EB染料检测BBB通透性。再灌注24h,各组随机取5只大鼠,经股静脉注射2%EB生理盐水3ml/kg。2h后,大鼠麻醉,由左心室用生理盐水灌流至右心耳流出清亮液体,然后断头取脑,称湿质量后置入装有0.5ml1mo l/L KOH溶液的离心管中,37℃ 过夜,然后加入/丙酮。离心15min,重复3次取上清液,用751型分光光度计在波长620nm处测定吸光度值。根据EB液的标准曲线,计算脑组织中的EB水平。
1.2.6 统计学处理 数据处理采用SPSS11.9统计软件进行运算,结果以±s表示,组间差异显著性检验采用方差分析。
2 结 果
2.1 TanⅡA A对磷酸化p38MPAK表达的影响 见表1。Sham组在缺血侧脑组织切片可见少量磷酸化p38表达,免疫反应产物颗粒分布弥散,胞浆、突触内少量存在(见图1)。与Sham组比较,IR组磷酸化p38表达增多,部位主要分布于缺血周边区的额顶皮质,差异有统计学意义(P<0.05)(见图2)。与IR组比较,anⅡA高、低剂量治疗组磷酸化p38表达明显减少,差异有统计学意义(P<0.05),且高TanⅡA组明显低于低TanⅡA组(P均<0.05)(见图3、图4)。
2.2 TanⅡA对MMP-9活性的影响 见表1。再灌注24h,Sham组的脑组织皮质有少量MMP-9阳性表达细胞(见图5)。与 Sham组比较,IR组的MMP-9阳性表达细胞数目明显增加(见图6),差异有统计学意义(P<0.05)(P<0.05)。与 IR组比较,TanⅡA高、低剂量治疗组MMP-9阳性表达细胞数明显减少,差异有统计学意义(P<0.05),且高TanⅡA组明显低于低TanⅡA组(P均<0.05)(见图7、图8)。
2.3 TanⅡA对神经元凋亡的比较 见表2。假手术组可见到少量凋亡细胞。IR组凋亡细胞数阳性率增加,与假手术组比较,差异有统计学意义(P<0.05)(见图9)。与IR组比较,TanⅡA高、低剂量治疗组凋亡细胞数阳性率均明显减少,差异有统计学意义(P<0.05),且高TanⅡA组明显低于低TanⅡA 组(P 均 <0.05)(见图10、图11)。
2.4 TanⅡA对EB含量的影响 IR组EB含量明显升高,与假手术组比较,差异具有统计学意义(P<0.05);与 IR 组比较,TanⅡA 高、低剂量治疗组EB含量明显降低(P<0.05),且高TanⅡA组明显低于低TanⅡA组(P均<0.05)。

图1 Sham组可见少量磷酸化p38MAPK表达

图2 IR组可见大量的磷酸化p38MAPK表达

图3 TanⅡA低剂量组p38MAPK表达较IR组减少

图4 TanⅡA高剂量组p38MAPK表达较低剂量组减少

图5 Sham组可见少量MMP-9表达

图6 IR组MMP-9表达增加

图7 TanⅡA低剂量组MMP-9表达较IR组减少

图8 TanⅡA高剂量组MMP-9表达较低剂量组减少
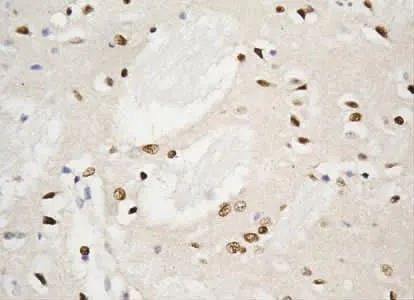
图9 IR组可见较多凋亡阳性细胞表达

图10 TanⅡA低剂量治疗组凋亡阳性细胞较IR组减少

图11 TanⅡA高剂量治疗组凋亡阳性细胞较低剂量治疗组减少(图片均为SP染色,×400)
表1 TanⅡA对磷酸化p38MPAK和MMP-9表达的影响(±s)

表1 TanⅡA对磷酸化p38MPAK和MMP-9表达的影响(±s)
与 Sham组比较*P<0.05;与 IR组比较 △P<0.05;与TANⅡA低剂量治疗组比较▲P<0.05
组别 n 磷酸化p38MAPK MMP-9 Sham组IR组TanⅡA低剂量组TanⅡA高剂量组5 5 5 5 20.60 ±2.19 99.00 ±11.13*67.27 ±4.13△30.80 ±2.70△▲92.20 ±3.27 144.40 ±14.94*105.13 ±2.32△85.93 ±1.79△▲
表2 TanⅡA对凋亡细胞数和EB含量的影响(±s)

表2 TanⅡA对凋亡细胞数和EB含量的影响(±s)
与 Sham 组比较*P<0.05;与 IR组比较△P<0.05;与TANⅡA低剂量治疗组比较▲P<0.05
组别 n 凋亡细胞数阳性率 EB含量(μg/g)假手术组IR组TanⅡA低剂量组TanⅡA高剂量组5 5 5 5 3.48 ±1.15 40.31 ±4.35*34.42 ±3.86△20.15 ±2.38△▲56.18 ±2.11 92.17 ±3.55*81.27 ±3.14△72.55 ±1.59△▲
3 讨论
P38MAPK是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)成员之一,参与调节细胞的增殖、分化和调控,是将细胞外刺激信号传导至细胞内,并调控其它基因表达的重要通路之一。近年有研究表明,脑缺血再灌注后P38MAPK显著升高,给予P38MAPK特异性抑制剂SB203580可以不同程度的减少梗死体积和神经元损害,提示P38MAPK通路参与了缺血后继发性脑损伤的信号传导[10,11]。MMP-9 是一组 Zn2+依赖的金属蛋白酶家族,目前认为与脑缺血后血脑屏障损伤的关系最为密切,抑制它的活化可在一定程度上减轻再灌注血脑屏障损伤[12]。
本实验研究显示,大鼠脑缺血再灌注24h,脑组织磷酸化的p38MAPK在缺血侧额顶部皮质的梗死区表达明显增多,并且该区域凋亡细胞明显增加,表明p38MAPK信号通路在脑缺血中参与了神经元凋亡过程,这与Sasaki等[13]的研究基本一致。大鼠脑缺血再灌注24h,缺血侧额顶部皮质MMP-9表达明显增加,并且缺血侧脑组织EB含量亦明显增加,表明脑缺血再灌注损伤后血脑血脑屏障破坏,与以往研究相符[14]。
TanⅡA为丹参酮中含量最高的活性成分,我们前期研究发现[3,4],TanⅡA 能够显著减小脑梗死体积具有脑保护作用。本实验研究结果表明,给予不同剂量的TanⅡA治疗脑缺血再灌注损伤大鼠,可明显减少缺血侧磷酸化p38MAPK表达,减少细胞凋亡。有研究发现,p38MAPK通过调控c-fos或 c-Jun表达,改变凋亡晚期基因 caspase-3的表达介导凋亡[15]。因此,我们推测,TanⅡA抗凋亡作用与抑制再灌注损伤后p38MAPK通路而下调caspase-3的表达有关[3]。
本实验研究还发现,给予不同剂量的TanⅡA治疗脑缺血再灌注损伤大鼠,可明显减少缺血侧MMP-9的表达,减少缺血侧脑组织EB含量,表明TanⅡA具有减少再灌注损伤后血脑屏障破坏的作用。近期研究表明,p38MAPK的表达与MMP-9存在相关性[16]。p38MAPK通过影响一氧化氮合酶(NOS)的表达而调节一氧化氮(NO)含量[17],而NO可以通过鸟苷酸环化酶以及cGMP水平对MMP-9 活 性 起 到 重 要 调 节 作 用[18,19],提 示p38MAPK、NO和MMP-9三者间可能存在序贯的激活关系。我们前期研究发现[20],TanⅡA能明显抑制NO及NOS的表达。因此我们推测,TanⅡA通过抑制p38MAPK通路,减少NOS的表达和NO的生成,从而下调MMP-9的表达,这可能是其减少血脑屏障破坏的机制之一。
[1]Strassburger M,Braun H,Reymann KG.Anti-inflammatory treatment with the p38 mitogen-activated protein kinase inhibitor SB239063 is neuroprotective,decreases the number of activatedmicroglia and facilitates neurogenesis in oxygen-glucose-deprived hippocampal slice cultures[J].Eur JPharmacol,2008,592(1-3):55-61.
[2]阎 伟,孙 微,张翠荣,等.脑缺血/再灌注损伤时MMP-9的表达及银杏叶提取物的干预作用[J].中风与神经疾病杂志,2007,24(1):83-85.
[3]李 浩,刘开祥,俸军林,等.丹参酮ⅡA对鼠脑缺血再灌注损伤Bcl-2和Caspase-3表达的影响[J].中国康复医学杂志,2008,23(8):691-693.
[4]李 浩,刘开祥,俸军林,等.丹参酮ⅡA对脑缺血再灌注损伤大鼠的保护作用及机制[J].时珍国医国药,2008,19(7):1648-1649.
[5]李 浩,刘开祥,俸军林,等.丹参酮ⅡA对鼠脑缺血再灌注损伤凋亡基因表达的影响[J].时珍国医国药,2009,20(1):82-84.
[6]李 浩,刘开祥,俸军林,等.丹参酮ⅡA对脑缺血再灌注损伤大鼠P-选择素和细胞间黏附分子-1表达的影响[J].中国医师杂志,2008,10(4):444-447.
[7]李 浩,刘开祥,俸军林,等.丹参酮ⅡA对大鼠脑缺血-再灌注损伤细胞间黏附分子-1表达及髓过氧化物酶活性的影响[J].中国现代神经疾病杂志,2008,8(4):349-352.
[8]Longa EZ,Weinstein PR,Carlson S,etal.Reversiblemiddle cerebral artery occusion wit hout cranietomy in rats[J].Stroke,1989,20(1):84-91.
[9]Matsuo Y,M ihara S I,Ninom iya M,etal.P ro tective effect of endothelin type A receptor antagonist on brain edema and injury after transientm iddle cerebral artery occlusion in rats[J].Stroke,2001,32(9):2143-2148.
[10]Zheng GY,Chen XC,Du J,etal.Inhibitory action of propyl gallate on the activation of SAPK/JNK and p38MAPK induced by cerebral ischemia-reperfusion in rats[J].Yao Xue Xue Bao,2006,41(6):548-554.
[11]Lu Q,Rau TF,Harris V,etal.ncreased p38 mitogen-activated protein kinase signaling is involved in the oxidative stress associated with oxygen and glucose deprivation in neonatal hippocampal slice cultures[J].Eur JNeurosci,2011,34(7):1093-1101.
[12]Yang Y,Estrada EY,Thompson JF,etal.Matrixmetalloproteinasemediated disruption of tight junction proteins in cerebral vessels is reversed by synthetic matrix metalloproteinase inhibitor in focal ischemia in rats[J].JCerebral Blood Flow Metab,2007,27(4):697-709.
[13]Sasaki K,Chiba K.Induction of apoptosis in starfish eggs requires spontaneous inactivation of MAPK(extracellular signal2regulated kinase)followed by activation of p38αMAPK[J].Mol Biol Cell,2004,15(3):1387-1396.
[14]Li Q,Zhang R,Ge YL,etal.Effects of neuregulin on expression of MMP-9 and NSE in brain of ischemia/reperfusion rat[J].JMol Neurosci,2009,38(2):207-215.
[15]李广明,李 军,曹 红,等.SB202190减轻沙鼠海马CA1区脑缺血再灌注的作用及磷酸化Caspase-3含量变化关系[J].中国药理学通报,2005,21(9):1150-1151.
[16]Ralay Ranaivo H,Hodge JN,ChoiN,etal.Albumin induces upregulation ofmatrixmetalloproteinase-9 in astrocytes via MAPK and reactive oxygen species-dependent pathways[J].J Neuroinflammation,2012,9(1):68.
[17]Ratajczak-WronaW,Jablonska E,Marcinczyk M,etal.Role of p38 MAPK pathway in induction of iNOS expression in neutrophils and peripheral blood mononuclear cells in patients with squamous cell carcinoma of the oral cavity[J].JOral Maxillofacial Suer,2009,67:2354-2363.
[18]Shin CY,Lee WJ,Choi JW,etal.Down-regulation ofmatrixmetalloproteinase-9 expression by nitric oxide in lipopolysaccharide-stimulated rat primary astrocytes[J].Nitric Oxide,2007,16(4):425-432.
[19]Ridnour LA,Windhausen AN,Isenberg JS,etal.Nitric oxide regulatesmatrix metalloproteinase-9 activity by guanylylcyclase-dependent and-independent pathways[J].Proc Natl Acad Sci USA,2007,104:16898-16903.
[20]李 浩,刘开祥,俸军林.丹参酮ⅡA对鼠脑缺血再灌注损伤一氧化氮及一氧化氮合酶的影响[J].中国康复理论与实践,2008,14(5):430-432.

