食药兼用真菌姬松茸胞外多糖的结构分析及其生物活性
张 卉
(沈阳化工大学 制药与生物工程学院,辽宁 沈阳 110142)
0 引 言
自从20世纪70年代真菌多糖抑制肿瘤的活性被发现以来,真菌多糖一直是生物化学、免疫学、医药学和食品科学等学科的一个热点研究领域[1-2]。但由于真菌多糖是极其复杂的多聚体,来自不同真菌的多糖即使具有相同的单糖组成,其理化性质、生物活性也可能差别很大。目前已发现真菌多糖的生物活性与其精细结构和空间构象有关,但在多糖构效关系等方面仍有许多问题有待阐明[3]。
姬松茸(AgaricusblazeiMurr.)是一种珍贵的食药兼用真菌。20世纪80年代开始,因发现姬松茸子实体多糖具有免疫力调节、抗肿瘤和抗氧化等功效而受到广泛关注[4-5]。由于栽培条件要求高等因素,姬松茸子实体供应量远远不能满足市场需求。随着研究的深入,研究者发现采用液态深层发酵替代固态栽培产生的姬松茸菌丝体和发酵液中也含有丰富的活性多糖成分[6-8],而且该法可实现姬松茸菌丝体和发酵液的工厂化周年生产,为真菌生物活性多糖的来源开辟了新途径。
本项目对姬松茸液态深层发酵液中的胞外多糖的结构及其动物体内对免疫器官的影响和抗肿瘤活性进行了研究,以探索多糖的构效关系,为更好地开发和利用姬松茸多糖奠定基础。
1 材料与方法
1.1 材 料
真菌多糖AbEXP1a:由真菌姬松茸发酵液经冷乙醇沉淀,Sevag法脱蛋白8~12次,H2O2脱色、透析、DEAE-纤维素柱层析和Sephadex G-200凝胶过滤获得[9]。
S-180实体肿瘤:由中国医科大学肿瘤研究所提供。
实验动物:昆明种小鼠,体重18~20g,40只,雌雄各半,购于中国医科大学实验动物部。
1.2 主要仪器
高效液相色谱仪,Waters 510型;傅里叶变换红外光谱仪,NIGOLT 550型;核磁共振仪,Bruker AVANCE 500。
1.3 多糖结构分析方法
1.3.1 单糖组分分析
称取纯化多糖20.0mg,溶解于4mL浓度为2mol/L 硫酸中,封管,105 ℃ 水 解8h[10-11]。切开封管,水解液BaCO3中和,在4℃、10 000g条件下离心5min,所得上清液经真空浓缩,采用HPLC法分析其单糖组分。HPLC色谱条件:Sugar Pak-1柱(30cm×5.9cm),柱温70℃,流动相为1mmol/L EDTA 二钠钙,体积流量0.4mL/min,示差折光检测器检测[12]。
1.3.2 红外光谱分析
KBr压片法:取干燥样品2mg左右,KBr压片,400~4 000cm-1扫描[13]。
1.3.3 核磁共振分析
将多糖AbEXP1a溶解于D2O,进行13C和1H核磁共振分析.
1.4 多糖抗肿瘤活性检测
小鼠常规接种S-180实体瘤,次日随机分组,每组10只。给药组分别按照5、10和20mg/(kg·d)剂量进行腹腔注射多糖,每日1次,连续给药10d。对照组给予等量的生理盐水。末次给药后的次日,眼眶放血处死小鼠,称体重,再剥取脾脏、胸腺称重,计算脾指数和胸腺指数,比较与对照组的差异显著性;剖取瘤块称重并计算抑瘤率[14-15]。
2 结果与分析
2.1 多糖AbEXP1a的结构
2.1.1 AbEXP1a的单糖组成
图1中2个峰的保留时间分别为11.936和13.422min,与相同色谱条件下葡萄糖标准品的保留时间(11.938min)和甘露糖标准品的保留时间(13.534min)基本相同,表明AbEXP1a含有葡萄糖和甘露糖2种单糖组分。两峰的峰面积比约为3∶1,表明多糖AbEXP1a分子中葡萄糖和甘露糖的比例为3∶1。
2.1.2 AbEXP1a的红外光谱分析结果
多糖AbEXP1a的红外光谱见图2。根据《Sadtler Reference Spectra Collection》中多糖的标准谱图及有关资料对图2进行分析,结果如下:在3 406.75cm-1处有O—H键的伸缩振动的强宽吸收峰,表明多糖AbEXP1a分子中有大量氢键;在2 929.50cm-1处有糖环上C—H键的伸缩振动产生的吸收峰,表明分子中有C—H结构;在1 647.38和1 422.66cm-1处是多糖类物质的特征吸收峰;在1 149~1 017cm-1是糖环上C—O键的吸收峰;在810cm-1处是甘露糖的特征吸收峰;在749.99cm-1处是吡喃环的特征吸收峰;在416.56cm-1处的是吡喃环碳骨架强吸收峰。在930~950cm-1无吸收峰,而在890和850cm-1处有吸收峰,表明分子中存在α型和β型糖苷键,且根据吸收峰的强弱可知该多糖分子中以β型糖苷键为主[16-18]。

图2 多糖AbEXP1a的红外光谱图Fig.2 IR spectrum of AbEXP1a
2.1.3 AbEXP1a的核磁共振分析结果
图3为AbEXP1a的1H-NMR谱图,由图3可见,共振信号的主要化学位移小于5.0,表明该多糖分子中以β型糖苷键为主。而化学位移大于5.0处也有吸收峰,表明其分子中也含有α型糖苷键。化学位移在4.95和5.2~5.4处有吸收峰,表明该多糖分子中有葡萄糖和甘露糖。
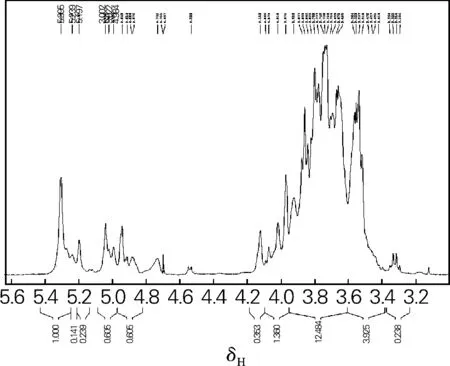
图3 AbEXP1a的1 H-NMR谱图Fig.3 1 H-NMR spectrum of AbEXP1a
图4为AbEXP1a的13C-NMR谱图,由图4可见,δ为100.3、101.9处有吸收峰,表明分子中含有葡萄糖和甘露糖;δ为86.52附近无吸收峰,表明无C3取代;δ在70~78范围内有吸收峰,表明无C4取代;δ在60.6、60.0附近有吸收峰,且δ在68.8处有吸收峰,表明其分子中有部分C6被取代。此外,在82~84及103~112均无信号,表明糖环非呋喃糖型,而是吡喃型[19]。

图4 AbEXP1a的13C-NMR谱图Fig.4 13 C-NMR spectrum of AbEXP1a
综合以上结果,推测多糖AbEXP1a分子由葡萄糖和甘露糖构成,二者的比例为3∶1,其主链由3个吡喃葡萄糖分子通过β-(1→6)糖苷键连接,再以α-(1→6)或β-(1→6)与吡喃甘露糖连接。
2.2 多糖AbEXP1a抗肿瘤活性检测结果
多糖AbEXP1a对小鼠免疫器官指数的影响及对小鼠移植肿瘤的作用见表1。由表1可见,各受试组小鼠的体重与对照组相比无显著性差异。3种剂量的胞外多糖均对小鼠的脾指数有显著影响,但只有较高浓度组对于胸腺指数才有显著影响。与对照相比,三剂量组对小鼠S-180移植肿瘤的抑制率均有显著性差异,但中高剂量组之间的肿瘤抑制率没有显著差别。10mg/mL剂量对S-180移植肿瘤的抑制率可达64.04%。

表1 多糖AbEXP1a对小鼠脾指数、胸腺指数和移植肿瘤的抑制作用(ip)Tab.1 Influence of polysaccharide AbEXP1aon spleen index,thymus index and transplantation tumor inhibition effect in mice(ip)
3 结论与讨论
3.1 结 论
姬松茸胞外多糖AbEXP1a由葡萄糖和甘露糖构成,二者的比例为3∶1。AbEXP1a分子的主链由3个连续的吡喃型葡萄糖分子通过β-(1→6)糖苷键连接,再通过α-(1→6)或β-(1→6)糖苷键与吡喃型甘露糖连接而成。
多糖AbEXP1a具有提高小鼠免疫器官质量指数,即提高小鼠机体免疫作用,还具有抗肿瘤作用。
3.2 讨 论
关于真菌多糖的结构与功效之间的关系一直是糖生物学研究的主要方向之一,比较一致的观点认为多糖链连接键的类型、多糖的相对分子质量和立体结构对生物活性有重要影响,但是至今尚未有突破。
多糖主链的构型是决定其功效的关键因素之一。一般认为以β-(1→3)糖苷键或β-(1→6)糖苷键构成主链的真菌多糖大多具有抗肿瘤、免疫增强等生物活性[20]。对β-(1→3)葡聚糖的研究表明,此种构型有利于形成螺旋状结构,具有较高的生物活性和抗肿瘤活性。对香菇多糖、云芝多糖、灰树花多糖、金针菇多糖和虫草多糖等[21-23]的结构分析都符合这一规律。本文研究的姬松茸多糖具有β-(1→6)糖苷键,为其抗肿瘤等生物活性提供了结构上的依据。
[1]杜巍,李元瑞,袁静.食药用菌多糖生物活性与结构的关系[J].食用菌,2001(2):3-5.
[2]高小荣,刘培勋.多糖构效关系研究进展[J].中草药,2004,35(2):229-231.
[3]王文平,郭祀远,李琳.生物活性多糖的结构及构效关系研究进展[J].中华实用中西医杂志,2006(19):2363-2367.
[4]KAWAGISHI H,INAGAKI R.Fractionation and antitumor activity of the water-insoluble residue ofAgaricusblazeifruiting bodies[J].Carbohydrate Research,1989,186(2):267-273.
[5]KAWAGISHI H,KANAO T.Formolysis of a potent antitumor complex fromAgaricusblazeifruiting bodies and antitumor activity of the resulting products[J].Carbohydrate Polymers,1990,12(4):393-403.
[6]张卉.姬松茸发酵液多糖的分离纯化及理化性质分析[J].沈阳化工学院学报,2005,19(4):245-248.
[7]贾薇,刘艳芳,张劲,等.姬松茸菌丝体多糖提取方法初探食用菌学报[J].食用菌学报,2003,10(3):41-44.
[8]张龙涛,王舒宁,龚晖,等.姬松茸液体发酵各组分多糖对小鼠脾淋巴细胞增殖的影响[J].福建农林大学学报:自然科学版,2007,36(1):72-76.
[9]张劲松,韩玮玮,潘迎捷.云芝子实体多糖(CVP)化学结构的研究[J].菌物系统,2001,20(4):531-535.
[10]GUTIÉRREZ A,PRIETO A,MARTÍNEZ A T.Structural characterization of extracellular polysac-charides produced by fungi from the genusPleurotus[J].Carbohydrate Research,1996,281(1):143-154.
[11]CHEN Jinghua,ZHOU Jinpin,ZHANG Lina,et al.Chemical structure of the water-insoluble polysaccharide isolated from the fruiting body ofGanodermalucidum[J].Polymer Journal,1998,30(10):838-842.
[12]张卉.真菌多糖AbEXP1-a的结构及其免疫调节活性研究[J].科技导报,2005,23(11):50-53.
[13]SOUMITRA M,INDRANIL C,DILIP R.Isolation and structural elucidation of water-soluble polysaccharide of a wild edible mushroom,Termitomyces striatus[J].Carbohydrate Research,2006,341(7):878-886.
[14]夏丙南,孙瑞元,张家铨,等.药理学实验教程[M].贵阳:贵州人民出版社,1983:163-169.
[15]张卉,孙丽霞,陶明明.姬松茸胞外多糖AbEXP1-a免疫调节活性研究[J].沈阳化工学院学报,2007,21(2):102-104.
[16]夏朝红,戴奇,房韦,等.几种多糖的红外光谱研究[J].武汉理工大学学报,2007,29(1):45-47.
[17]赵明,常钰,王佩香,等.桑叶多糖PMP12的分离纯化及结构初步分析[J].江苏大学学报:医学版,2010,20(2):154-156.
[18]孙希云,刘宁,孟宪军,等.蓝莓多糖BBP3-1的分离及结构分析[J].天然产物研究与开发,2011,23(6):1080-1084.
[19]杜秀菊,张劲松,潘迎捷.核磁共振技术在食用菌多糖结构分析中的作用[J].中国食用菌,2010,29(1):3-6.
[20]VIJAYABASKAR P,BABINASTARLIN S,SHANKAR T,et al.Quantification and characterization of exopolysaccharides fromBacillussubtilis(MTCC 121)[J].Advances in Biological Research,2011,5(2):71-76.
[21]BADALYAN S,HAMBARDZUMYAN L A.Investigation of immunomodulating activity of the medicinal mushroomFlammulinavelutipes(Curt.Fr.)P Karst.in vitro.cytokine induction by fruiting body extract[J].International Journal of Medicinal Mushrooms,2001,3(2/3):110.
[22]BISKO N A,GULICH M A,OLISHEVSKAYA O D,et al.Immunological studies of the edible and medicinal mushroomLentinusedodes(Berk.)Sing[J].International Journal of Medicinal Mushrooms,2001,3(2/3):121.
[23]于广利,王莹,赵峡,等.一种碱溶性灰树花菌丝体多糖GFM2A的制备和结构表征[J].高等学校化学学报,2007,28(1):87-91.

