Livin和细胞色素C在舌鳞状细胞癌组织中的表达及其临床意义
黄 汉,李方遒,张 斌,马 竟
(1.辽宁医学院附属第一医院口腔科,辽宁 锦州 121001;2.辽宁医学院附属第一医院手术室,辽宁 锦州 121001)
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)简称舌鳞癌,是最常见的口腔癌,恶性程度高,生长快,浸润性强,由于舌血供丰富,运动频繁,TSCC常发生早期的颈淋巴结转移,且转移率较高[1]。目前TSCC最有效的治疗方法仍然是手术切除,过度的手术切除常常严重影响TSCC患者的口腔功能和术后生活质量。因此,探索更为有效且创伤更小的治疗手段具有重要意义。Livin是细胞凋亡抑制蛋白(inhibitor of apoptosis family of protein,IAP)家族中的新成员,在正常成人组织中不表达或仅少量表达,在一些肿瘤组织中特异性高表达,表明其与肿瘤的发生发展和预后关系密切,可能成为肿瘤治疗的新靶点[2]。细胞色素C(cytochrome C,Cyt-C)是线粒体启动凋亡程序的关键物质,是参与细胞凋亡不可或缺的重要因子[3]。目前研究[4-5]表明:多种凋亡相关基因参与TSCC的发生发展,但国内外对Livin和Cyt-C在TSCC组织中的表达及相关性的研究尚未见报道。本研究采用免疫组织化学方法,检测TSCC和正常舌黏膜组织中Livin和Cyt-C的表达,探讨其临床意义,为TSCC的诊断、预后和治疗提供新思路。
1 材料与方法
1.1 一般资料 选取2002年1月—2010年6月辽宁医学院附属第一医院病理实验室资料完整的存档TSCC石蜡标本48例作为TSCC组;均未经任何放疗和化疗,且术后经病理检查确诊,其中男性30例,女性18例,年龄38~73岁,平均年龄45岁;组织学分型:高分化16例,中分化23例,低分化9例;有淋巴结转移14例,无淋巴结转移34例。10例正常舌黏膜组织作为对照组,均为舌外伤手术切除的正常舌体组织,标本经10%中性甲醛液固定,石蜡包埋。本研究经辽宁医学院附属第一医院伦理道德委员会批准,用于实验的全部样本均取得受试者知情同意。
1.2 主要试剂和仪器 兔抗人Livin多克隆抗体、兔抗人Cyt-C多克隆抗体、链霉素抗生物素蛋白-过氧化物酶(SP)试剂盒、抗原修复液Ⅰ和DAB显色试剂盒均购自武汉博士德生物公司;德国莱卡显微镜、全自动免疫组化染色仪和凝胶成像分析系统。
1.3 免疫组织化学法检测Livin和Cyt-C蛋白的阳性表达 采用免疫组织化学法,严格按照SP两步免疫组织化学检测试剂盒说明书进行操作。
1.4 结果判定标准 HE染色切片由2名有经验的病理科医师读片证实诊断。光镜下每张切片选择5个高倍视野,每高倍视野计数100个瘤细胞,由3名病理医师独立计数。阳性细胞百分比分为4级:≤5%为0分,6%~50%为1分,51%~80%为2分,>80%为3分。根据显色程度判定阳性强度:基本不着色为0分,淡黄色为1分,棕黄色为2分。两者相乘,为最后得分。0~1分为阴性(-),2~3分为弱阳性(+);4~6分为中度阳性()。为便于统计,将0~3分判定为阴性,4~6分判定为阳性。参考Yonemura等[6]关于胃癌组织中的表达标准,癌细胞阳性表达≥60%为阳性(+),<60%为阴性(-)。
1.5 统计学分析 应用SPSS13.0统计软件进行数据分析。Livin和Cyt-C蛋白表达阳性率组间比较采用χ2检验;TSCC组织中Livin和Cyt-C蛋白的表达与临床病理特征的关系分析采用χ2检验;TSCC组织中Livin和Cyt-C蛋白表达的相关性分析采用Spearman等级相关分析。
2 结 果
2.1 TSCC和正常舌黏膜组织中Livin和Cyt-C蛋白的表达 Livin蛋白主要位于细胞浆,偶有细胞核着色,呈棕黄色颗粒。在TSCC组织中Livin阳性表达率为66.67%(32/48),10例正常舌黏膜组织中无Livin蛋白表达,Livin蛋白阳性表达率组间比较差异有统计学意义(P<0.01)。在TSCC组织中Cyt-C阳性表达率为70.83%(34/48),对照组中Cyt-C蛋白阳性表达率为10.00%(1/10),组间比较差异有统计学意义(P<0.01)。见图1(插页六)。
2.2 TSCC组织中Livin和Cyt-C蛋白表达与临床病理特征的关系 Livin蛋白在高分化TSCC组阳性表达率为56.25%(9/16),在中分化TSCC组阳性表达率为65.22%(15/23),在低分化TSCC组阳性率为88.89%(8/9);高、低分化组Livin蛋白阳性表达率比较差异有统计学意义(P<0.05)。伴有颈部淋巴结转移的TSCC中Livin蛋白阳性表达率为92.86%(13/14),在无颈部淋巴结转移的TSCC组织中阳性表达率为55.88%(19/34),二者比较差异有统计学意义(P<0.05);而Livin蛋白阳性表达率与TSCC患者的性别和年龄无关联(P>0.05)。Cyt-C蛋白阳性表达率与TSCC组织学分型有关联(P<0.05),与TSCC患者的性别、年龄和有无淋巴结转移均无关联(P>0.05)。见表1。
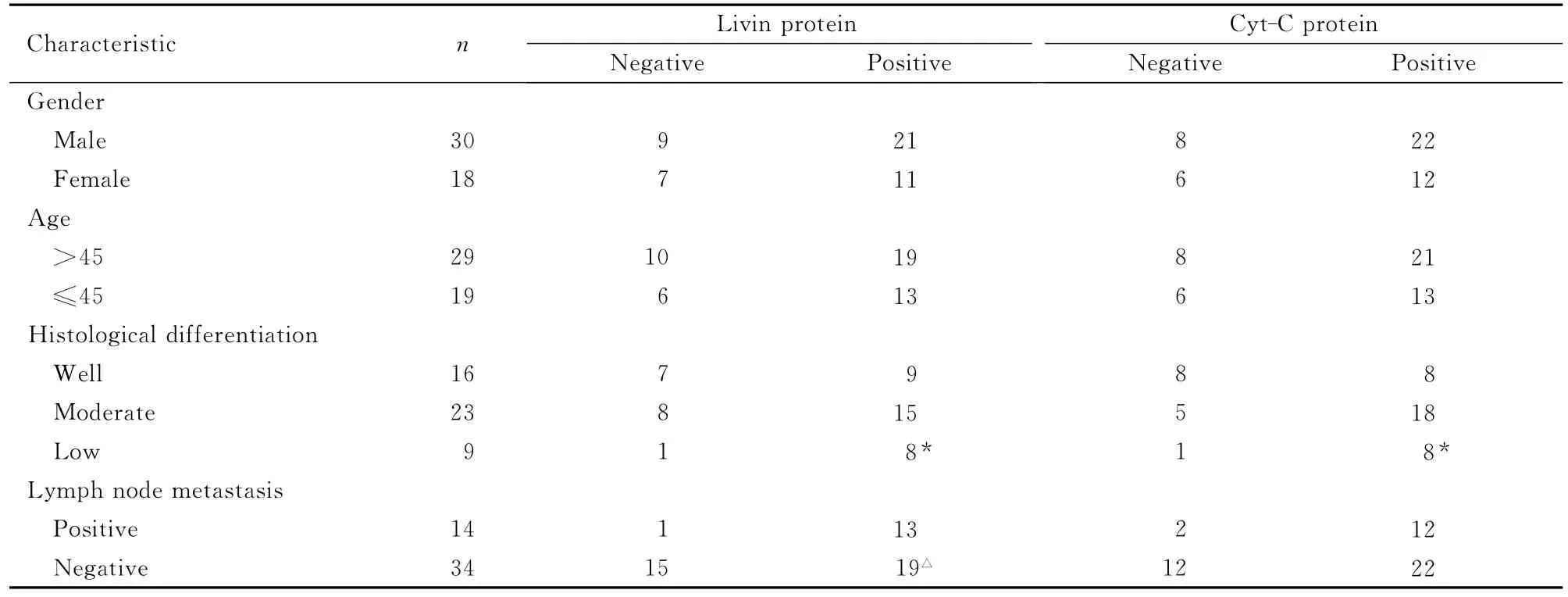
表1 TSCC组织中Livin和Cyt-C蛋白表达与临床病理特征的关系Tab.1 Relationships between expressions of Livin,Cyt-C protein in TSCC tissue and clinicopathological characteristics
2.3 Livin 和 Cyt-C 蛋白表达的相关性Spearman相关分析,Livin蛋白表达和Cyt-C蛋白表达呈正相关关系(r=0.553,P<0.001)。见表2。
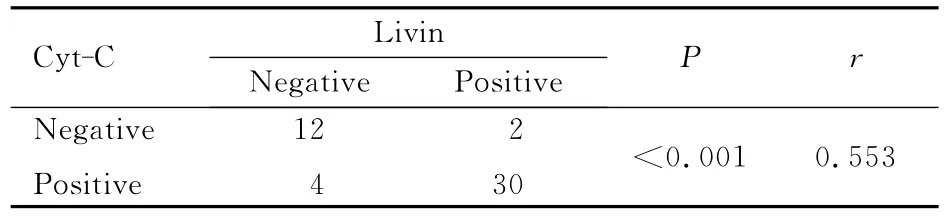
表2 Livin和Cyt-C蛋白表达的相关性Tab.2 Correlation between expressions of Livin and Cyt-C protein
3 讨 论
细胞凋亡是近年来研究的一个热点问题,涉及到细胞内许多复杂的生化过程。细胞凋亡过程中的各种调控因素包括 Cyt-C、caspase、bcl-2、p53、p21和survivin在凋亡过程中均发挥着重大作用[7]。Livin是新近发现的凋亡抑制蛋白家族成员,主要通过抑制caspases蛋白发挥其抗凋亡作用。目前已在多种人类常见恶性肿瘤中检测到Livin过表达[8-9]。Lazar等[10]报 道:在 人 黑 色 素 瘤 中,Livin蛋白表达水平显著增高。隋长德等[11]研究显示:Livin蛋白阳性表达与癌细胞分化程度和淋巴结转移有关联。本研究结果显示:Livin蛋白阳性表达与TSCC患者的性别和年龄无关联;48例TSCC患者中Livin蛋白阳性表达率为66.67%,正常舌黏膜组织中无Livin蛋白表达,提示Livin蛋白表达量上调可能在TSCC细胞恶性增殖中起着重要作用;在不同组织学分型的TSCC标本中,Livin蛋白阳性表达率分别为56.25%、65.22%和88.89%,高、低分化组织学类型组之间比较差异有统计学意义,说明随着TSCC分化程度的降低,Livin蛋白发挥着更大的凋亡抑制作用,Livin蛋白可作为TSCC发生发展过程中的蛋白标志物;伴有颈部淋巴结转移的TSCC组织中Livin蛋白阳性表达率为92.86%,在无颈部淋巴结转移的TSCC组织中阳性表达率为55.88%,说明Livin蛋白高表达与颈部淋巴结转移有密切关联,有望成为TSCC预后的一个重要指标。本实验结果与任宏宴等[12]所报道在TSCC中检测的Livin蛋白表达结果基本一致。
在细胞凋亡过程中,线粒体是调控细胞凋亡的中心,而Cyt-C从线粒体的释放则起着关键性作用。Cyt-C释放到胞质后可激活caspase,引发级联反应,从而导致细胞凋亡;Bcl-2蛋白家族具有Cyt-C释放的功能;凋亡诱导因子AIF保证着凋亡的有序进行;内质网通过应激、招募和活化等提高线粒体对促凋亡因子的敏感性,从而使Cyt-C从线粒体线粒体膜间隙释放,发挥了重要的作用[13]。在凋亡信号刺激下,线粒体释放Cyt-C至胞浆,并与Apaf-1结合,在dATP存在的前提下,Apaf-1和前 caspase-9(procaspase-9) 结 合 并 活 化 为caspase-9,caspase-9 激 活 procaspase-3 为caspase-3,从而导致细胞凋亡[14]。李维山等[15]报道:在结肠腺癌中Cyt-C蛋白表达水平增加,Cyt-C蛋白阳性表达与组织分化程度有关联,Cyt-C表达水平的增加并不能有效阻止肿瘤细胞的发生,但是可能通过其促进肿瘤凋亡作用而阻止肿瘤细胞的生长从而有效抑制肿瘤的发展。本研究结果显示:Cyt-C蛋白在TSCC组织中阳性表达率为70.83%,而在对照组中阳性表达率仅为10%,2组比较差异有统计学意义;在TSCC组织中Cyt-C蛋白阳性表达率与组织学分型有关联,但与TSCC患者的性别、年龄和淋巴结转移无关联。Livin蛋白表达和Cyt-C蛋白表达呈正相关关系。因此推测,Cyt-C表达的增加并没有阻止舌癌的发生,说明Livin在TSCC的发生过程中起着关键的作用,而Cyt-C的表达增加可以通过促凋亡作用,抑制肿瘤细胞的生长;Cyt-C表达的增加可能是Livin表达增加反馈性引起的肿瘤细胞的内在的调节机制,但是Livin通过何种机制诱发Cyt-C表达增加,以及两者之间是否可能有其他未被了解的作用机制,尚有待于进一步研究。
综上所述,本文作者认为:作为凋亡相关蛋白,Livin和Cyt-C蛋白在TSCC的发生和演进过程中发挥着协同作用,有望成为TSCC临床进展、恶性程度和预后的重要参考指标。
[1]Guo XH,Wang JY,Gao Y,et al.Decreased adiponectin level is associated with aggressive phenotype of tongue squamous cell carcinoma[J].Cancer Sci,2013,104(2):206-213.
[2]Kasof GM,Gomes BC.Livin,a novel inhibitor of apoptosis protein family member[J].J Biol Chem,2001,276(5):3238-3246.
[3]Mannick JB,Caston B.Nitrosylation of cytochrome C during apoptosis[J].J Biol Chem,2008,278(20):18265.
[4]Grzybowskaizydorczyk O,Smolewski P.The role of the inhibitor of apoptosis protein(IAP)family in hematological malignancies[J].Postepy Hig Med Dosw,2008,2(14):55-63.
[5]Larsen BD,Rampalli S,Burns LE,et al.Caspase 3/caspase-activated DNase promote cell differentiation by inducing DNA strand breaks[J].Proc Natl Acad Sci USA,2010,107(9):4230-4235.
[6]Yonemura Y,Nojima N,Kaji M,et al.E-cadherin and urokinase-type plasminogen activator tissue status in gastric carcinom [J].Cancer,1995,76(6):941-953.
[7]刘 宇,季宇彬.肿瘤细胞的凋亡及其分子机制研究 [J].哈尔滨商业大学学报:自然科学版,2008,24(5):524-527.
[8]Fedorova AV, Deshayes K, Fairbrother WJ, et al.Characterization of ML-IAP protein stability and physiological roleinvivo[J].Biochem J,2012,447(3):427-436.
[9]Ling Q,Xu X,Wei X,et al.Oxymatrine induces human pancreatic cancer PANC-1cells apoptosis via regulating expression of Bcl-2and IAP families,and releasing of cytochrome c[J].J Exp Clin Cancer Res,2011,30(1):66.
[10]Lazar I,Perlman R,Lotem M,et al.The clinical effect of the inhibitor of apopotosis protein livin in melanoma [J].Oncology,2012,82(4):197-204.
[11]隋长德,苗 波.PTEN及Livin在舌鳞状细胞癌组织中的表达及临床意义 [J].黑龙江医药科学,2009,32(5):26-27.
[12]任宏宴,李善昌,唐大永,等.Livin、Bcl-2在舌癌中的表达及临床意义 [J].口腔颌面外科杂志,2010,20(5):334-337.
[13]Edison N,Zuri D,Maniv I,et al.The IAP-antagonist ARTS initiates caspase activation upstream of cytochrome C and SMAC/Diablo [J].Cell Death Differ,2012,19(2):356-368.
[14]Garrido C,Galluzzi L,Brunet M,et al.Mechanisms of cytochrome c release from mitochondria [J].Cell Death Differ,2006,13(9):1423-1433.
[15]李维山,左曙光,鄢文海,等.细胞色素C和Survivin在结肠腺癌中的表达及临床意义 [J].实用医学杂志,2012,28(2):226-228.

