Thermotoga neapolitana葡萄糖苷酶基因的克隆、表达及其酶学性质
毕云枫,刘薇薇,李彦阳,杨万才,沈明浩
(吉林农业大学食品科学与工程学院质量与安全教研室,吉林 长春 130118)
α-葡萄糖苷酶(α-glucosidase,EC 3.2.1.20)
是一种糖苷水解酶,可从底物的非还原端切去α-葡萄糖[1-2]。除了水解酶活力之外,α-葡萄糖苷酶还显示了转糖基活力,催化产物成各种糖基化化合物[3-5]。α-葡萄糖苷酶广泛分布于自然界,如微生物、植物和动物。α-葡萄糖苷酶可以分为3类:类型Ⅰ,水解蔗糖和芳香基糖苷;类型Ⅱ,水解麦芽糖和异麦芽糖能力强,而对芳香基糖苷键水解能力弱;类型Ⅲ,显示和类型Ⅱ相同的水解能力,但是也能水解多糖如直链淀粉和淀粉[6-7]。许多已知的α-葡萄糖苷酶偏好水解α-1,4-糖苷键的底物如麦芽糖和低聚麦芽糖[1]。但来自于Thermus thermophilusstrainGK24和Bacillussp.SAM1606的α-葡萄糖苷酶则更偏好水解α-1,6-糖苷键的底物如异麦芽糖[1,2,8]。真菌来源的 α-葡萄糖苷酶更容易水解链长度较短的底物[9]。大量其他来源的α-葡萄糖苷酶也催化转糖基作用产生糖基化合物[10]。当前研究[11-13]绝大多数是针对微生物α-葡萄糖苷酶,国内外已经有许多的α-葡萄糖苷酶被克隆表达。而嗜热菌因其耐高温,所产酶易纯化、更适合工业的高温反应条件而倍受人们关注。但极端嗜热来源的α-葡萄糖苷酶较少,并大多是以淀粉和麦芽糖为最适底物。新阿波罗栖热袍菌(Thermotoganeapolitana,T.neapolitans,DSM 4359)是一种极端嗜热的海洋细菌,属于热袍菌目。T.neapolitana能够以复杂的碳水化合物为原料产生氢气[14]。因其培养条件要求厌氧且培养温度极高,苛刻的培养条件使其很难大量培养,且产酶量低。本研究从T.neapolitana中成功克隆耐热葡萄糖苷酶,在大肠杆菌中高效表达。并探讨了重组酶的酶学性质。
1 材料与方法
1.1 菌株与载体T.neapolitanaDSM 4359由Laura Dipasquale教授惠赠,E.coliBL21(DE3)和质粒pET-28a(+)由本实验室保存。
1.2 主要试剂和仪器 Taq DNA Polymerase、限
制性内切酶BamHⅠ和XhoⅠ购自美国TaKaRa公司,细菌基因组DNA提取试剂盒和高纯质粒小量制备试剂盒均购自百泰克公司,柱式DNA胶回收试剂盒、硫酸卡那霉素(Kan)购自上海生工公司,葡萄糖检测试剂盒购自南京建成生物工程研究所,海藻糖、蔗糖和松二糖购自美国Sigma公司,麦芽糖、明串珠菌二糖和龙胆二糖购自TCI公司;其他试剂均为国产分析纯;9600PCR扩增仪为Applied Biosystems公司产品,JYP2-Ⅱ超声波细胞粉碎机为宁波新芝生物科技股份有限公司产品,岛津1800紫外分光光度计为日本岛津公司产品。
1.3 LB培养基的制备 LB培养基的组成:1%胰蛋白胨、1%NaCl、0.5%酵母粉、pH=7.0,于121℃灭菌20min后备用。LB固体培养基的组成:将2%琼脂溶于LB培养基,于121℃灭菌20min。
1.4 基因组DNA的提取T.neapolitanaDSM 4359基因组DNA提取方法按基因组提取试剂盒说明书操作,提取的DNA 1%行琼脂糖凝胶电泳,-20℃保存备用。
1.5 PCR法扩增目的基因 根据NCBI的GenBank中的基因序列(Gene ID:7377508)设计并合成引物,引物中分别引入BamHⅠ和XhoⅠ酶切位点(带下划线部分)。P1引物序列为:5′-CGCGGATCCATGAGGTTGGTCGTCTCTTTTCTTC-3′,内切酶为BamHⅠ;P2引物序列为:,5′-CCGCTCGAGTTATTCTCCAATTTCAACAGAGAAATCC-3′,内 切 酶 为XhoⅠ。以T.neapolitanaDSM 4359基因组DNA为模板,用引物P1和P2扩增目的基因。PCR反应体系如下:10×PCR Buffer 5μL,引物 P1和 P2各1μmol·L-1,dNTPs 0.25mmol·L-1,模 板DNA约1μg,Taq DNA聚合酶2.5U,灭菌双蒸水补足至50μL。反应条件为:94℃预变性3min;94℃变性50s、54℃退火40s、72℃延伸90s,共30个循环;72℃延伸10min,反应完成后PCR产物经1.0%的琼脂糖凝胶电泳检测。
1.6 重组质粒载体的构建 将PCR产物与表达载体pET-28a(+)经BamHⅠ和XhoⅠ双酶切后切胶回收。将酶切后的葡萄糖苷酶基因片段和pET-28a(+)质粒按照一定比例混合,并加入ligation T4DNA ligase,16℃下连接2h后4℃过夜。
1.7 重组α-葡萄糖苷酶在大肠杆菌中的诱导表达
取重组质粒转化至E.coliBL21(DE3)中,涂布于含Kan的LB固体培养基中,37℃培养24h,挑取单菌落于含Kan的LB液体培养基中振荡培养12h,然后以1%的接种量扩大培养,37℃继续培养至对数生长期(600nm波长处的吸光度A600≈0.5),加入200mmol·L-1IPTG 至终浓度为1mmol·L-1,30℃诱导4h。同时诱导空载菌体作为对照。
1.8 非变性丙烯酰胺电泳检测葡萄糖苷酶的表达
将诱导4h的发酵液以10 000r·min-1离心10min收集菌体后,用与原发酵液等体积的结合缓冲液(20mmol·L-1Tris-HCl、200mmol·L-1NaCl,pH 8.0)悬浮菌体,然后进行超声破碎菌体(功率450W,超声处理4s,间歇5s,工作99次),将破碎液在4℃条件下,10 000·min-1离心10min,所得上清液在60℃水浴处理30min,除去杂蛋白于10 000r·min-1离心10min,所得上清液即为酶液。采用非变性丙烯酰胺电泳检测葡萄糖苷酶的表达情况。
1.9 酶活力测定 以海藻糖为底物,溶解于磷酸-柠檬酸缓冲液(pH 5.0),终浓度为2mg·L-1,酶与底物在70℃下保温2h,按照葡萄糖检测试剂盒步骤测定酶活力,使用试剂盒提供葡萄糖制定标准曲线,根据测定的反应产物的A值计算生成的葡萄糖量。每小时催化底物生成1μmoL葡萄糖所对应的酶量定义为1个酶活力单位(U·mL-1)。
2 结 果
2.1 α-葡萄糖苷酶基因的克隆 以T.neapolitanaDSM 4359的基因组DNA为模板,用特异性引物P1和P2扩增葡萄糖苷酶基因,1%琼脂糖凝胶电泳检测结果,在825bp附近有单一明亮的扩增带,与预期大小相符合。PCR产物由上海生工完成测序,该基因的开放读码框由825个核苷酸组成,编码274个氨基酸。见图1。
2.2 α-葡萄糖苷酶表达载体的构建 重组质粒经BamHⅠ和XhoⅠ双酶切并鉴定。重组质粒能被BamHⅠ和XhoⅠ酶切出1条与PCR扩增片段大小一致的片段,同时存在1条片段与pET-28a(+)大小一致。因此,初步证实目的基因已插入pET-28a(+)载体中,葡萄糖苷酶的重组表达质粒构建成功。见图2。

图1 葡萄糖苷酶基因的PCR扩增电泳图Fig.1 Electrophoregram of PCR amplification of glucosidase gene

图2 重组质粒的酶切鉴定电泳图Fig.2 Electrophoregram of recombinant plasmid digested by restriction enzyme
2.3 α-葡萄糖苷酶的诱导表达 重组工程菌经IPTG诱导培养后,进行非变性丙烯酰胺电泳,与带有空载PET28a(+)的E.coliBL21(DE3)比较,重组菌产生一条特异性的蛋白条带,此条带的相对分子质量约为63 000。而空载蛋白中未见此条带。见图3。
2.4 葡萄糖苷酶的最适反应温度 将粗酶液与底物海藻糖在40℃~90℃的温度梯度下反应。以酶活力最高作为100%,计算相对酶活力。重组酶的最适反应温度为75℃,在70℃~85℃范围内相对酶活力较高,均能达到60%活力以上。见图4。
2.5 葡萄糖苷酶的最适反应pH值 在75℃条件下,以海藻糖为底物在pH 3~9这9个不同环境中,用葡萄糖检测试剂盒测定反应。以酶活力最高作为100%,计算相对酶活力。重组酶的最适反应pH值为5.0,在pH 3.0~6.0范围内相对酶活较高。能保持70%以上活力。pH超过6.0时,酶活力迅速降低。见图5。
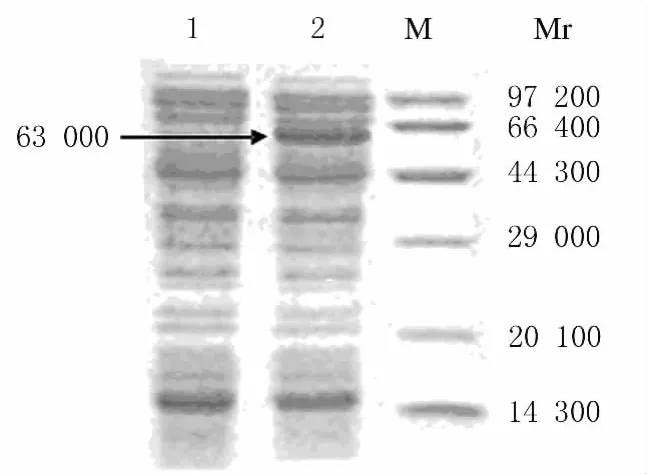
图3 重组表达的葡萄糖苷酶蛋白电泳图Fig.3 Electrophoregram of recombinant expression glucosidase protein
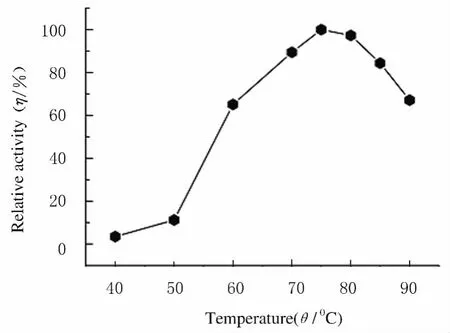
图4 不同温度下T.neapolitana葡萄糖苷酶相对酶活力Fig.4 Relative activity of glucosidase from T.neapolitana under different temperatures
2.6 葡萄糖苷酶的底物特异性T.neapolitana
葡萄糖苷酶水解糖苷键,水解相关二糖的相对活力为:海藻糖(trehalose)100%、龙胆二糖(gentiobiose)34.01%、 松 二 糖(turanose)7.10%、 蔗 糖(sucrose)6.85%、 麦 芽 糖(maltose)0.50% 和 明 串 珠 菌 二 糖(leucrose)0%。

图5 不同pH值下T.neapolitana葡萄糖苷酶相对酶活力Fig.5 Relative activity of glucosidase from T.neapolitana under different pH values
3 讨 论
从T.neapolitana中克隆表达的葡萄糖苷酶具有极高的耐热特性,利用这个特点,可以利用60℃水浴热处理除去大部分杂蛋白,大大提高酶的纯度。底物特异性实验结果可见:T.neapolitana葡萄糖苷酶对海藻糖的催化能力最强,其次为龙胆二糖,其他二糖的活力均很低或无活力。所以T.neapolitana葡萄糖苷酶能特异性地水解海藻糖的α-(1→1)糖苷键和龙胆二糖的α-(1→6)糖苷键,而对其他糖苷键基本无作用。此前仅见Alarico等[15]报道的Thermus.thermophilusHB27中提取的α-葡萄糖苷酶有此性质。T.neapolitana葡萄糖苷酶还对龙胆二糖的α-(1→6)糖苷键有一定的水解能力。因此,此酶的底物特异性较强。T.neapolitana(DSM 4359)中 Gene ID 为7377508的基因,基因序列提交者将其归为潜在的葡聚糖酶,而本研究结果表明:此酶实际具有α-葡萄糖苷酶性质。α-葡萄糖苷酶有水解多糖、化合物合成、转糖基合成低聚糖和疾病治疗等作用,所以当前被广泛应用于食品、医药和化工等行业。因此将葡萄糖苷酶基因转入到宿主菌中进行高效表达,提高酶得率,降低酶的生产成本,用于转苷生产低聚糖、水解生产多糖等方面具有重要的理论和应用价值。当前的市售α-葡萄糖苷酶多为美国、日本和丹麦等国生产,并且多为不耐热的黑曲霉源。21世纪是绿色的世纪,酶制剂的应用空间巨大。我国α-葡萄糖苷酶尤其是耐热α-葡萄糖苷酶的研究前景非常广阔。
本研究成功地构建了超嗜热海洋热袍菌(T.neapolitana(DSM 4359)葡萄糖苷酶基因的表达载体。诱导表达后的蛋白电泳结果出现特异性蛋白质条带,表明此酶在工程菌中高效表达。酶学性质研究表明:其最适反应温度为75℃,最适反应pH为5.0,对α-(1→1)糖苷键有极强的水解能力。此酶的工程菌的构建成功,为今后此酶的进一步应用和理论研究打下良好的基础。
[1]Nashiru O,Koh S,Lee SY,et al.Novelα-glucosidase from extreme thermophileThermuscaldophilusGK24 [J].J Biochem Mol Biol,2001,34(4):347-354.
[2]Noguchi A,Yano M,Ohshima Y,et al.Deciphering the molecular basis of the broad substrate specificity of alphaglucosidase fromBacillussp.SAM1606 [J].J Biochem,2003,134(4):543-550.
[3]Soro RY,Diopoh JK, Willemot RM,et al.Enzymatic synthesis of polyglucosyl-fructosides from sucrose alone by a novel α-glucosidase isolated from the digestive juice ofArchachatinaventricosa(Achatinideae)[J].Enzyme Microb Technol,2007,42(1):44-51.
[4]Zdzieblo A,Synowiecki J.New source of the thermostable α-glucosidase suitable for single step starch processing [J].Food Chem,2002,79(4):485-491.
[5]Yamamoto T,Unno T,Watanabe Y,et al.Purification and characterization of Acremonium implicatum α-glucosidase having regioselectivity for α-1,3-glucosidic linkage [J].Biochim Biophys Acta,2004,1700(2):189-198.
[6]Okuyama M,Tanimoto Y,Ito T,et al.Purification and characterization of the hyper-glycosylated extracellular αglucosidase fromSchizosaccharomycespombe[J].Enzyme Microb Tech,2005,37(5):472-480.
[7]Marín D,Linde D,Fernández Lobato M.Purification and biochemical characterization of an alpha-glucosidase fromXanthophyllomycesdendrorhous[J]. Yeast, 2006,23(2):117-125.
[8]Nakao M,Nakayama T,Kakudo A,et al.Structure and expression of a gene coding for thermostable alpha-glucosidase with a broad substrate specificity fromBacillussp.SAM1606 [J].Eur J Biochem,1994,220(2):293-300.
[9]Kita A,Matsui H,Honma M,et al.Enzymatic properties of threeα-glucosidases fromAspergillusorizae[J].J Appl Glycosci,1996,43(3):325-330.
[10]Kobayash I,Tokuda M,Konda T,et al.Purification and characterization of a new type of alpha-glucosidase from Paecilomyces lilacinus that has transglucosylation activity to produce alpha-1, 3 - and alpha-1, 2-linked oligosaccharides [J]. Biosci Biotechnol Biochem, 2003,67(1):29-35.
[11]Chen DL, Tong X, Chen SW,et al. Heterologous expression and biochemical characterization of alphaglucosidase from Aspergillus niger by Pichia pastroris [J].J Agric Food Chem,2010,58(8):4819-4824.
[12]李书涛,樊 攀,程景伟,等.肠膜明串珠菌α-葡萄糖苷酶基因克隆表达及酶学性质 [J].生物技术进展,2012,2(2):124-129.
[13]Watanabe S,Kakudo A,Ohta M,et al.Molecular cloning and characterization of theα-glucosidaseⅡfromBombyxmoriandSpodopterafrugiperda[J].Insect Biochem Mol Biol,2013,43(4):319-327.
[14]Tramice A, Pagnotta E, Romano I, et al.Transglycosylation reactions using glycosyl hydrolases fromThermotoganeapolitana, a marine hydrogen-producing bacterium [J].J Mol Catalysis B:Enzymatic,2007,47(1/2):21-27.
[15]Alarico S,Costa MS, Empadinhas N. Molecular and physiological role of the trehalose-hydrolyzing alphaglucosidase fromThermusthermophilusHB27 [J].J Bacteriol,2008,190(7):2298-2305.

