快速沉淀-碳热还原法合成亚微米LiFePO4/C
彭忠东,裴振兴,石迪辉,胡国荣
(1.中南大学冶金科学与工程学院,湖南长沙 410083;2.临沂杰能新能源材料有限公司,山东临沂 276023)
快速沉淀-碳热还原法合成亚微米LiFePO4/C
彭忠东1,裴振兴1,石迪辉2,胡国荣1
(1.中南大学冶金科学与工程学院,湖南长沙 410083;2.临沂杰能新能源材料有限公司,山东临沂 276023)
以FeSO4·7H2O、NH4H2PO4和 H2O2为原料,用快速沉淀法制备亚微米无定形 FePO4·2H2O,再将 FePO4·2H2O、Li2CO3和葡萄糖球磨混合,通过碳热还原法合成LiFePO4/C复合材料。通过XRD、SEM和TEM分析及充放电测试考察了反应物浓度和反应温度对FePO4·2H2O的影响。当溶液浓度为0.2 mol/L、反应温度为50℃时,可制备形貌一致、粒度分布均匀且纯度高的亚微米无定形FePO4·2H2O。合成的LiFePO4/C粒度分布均匀,碳包覆膜完整,在2.5~4.1 V充放电,1.0C和2.0C首次放电比容量分别为140.5 mAh/g和134.9 mAh/g,循环100次的容量保持率分别为100.0%和97.8%。
正极材料; 快速沉淀; 磷酸铁(FePO4); 磷酸铁锂(LiFePO4)
针对磷酸铁锂(LiFePO4)电子导电率(<10-9S/cm)低、Li+扩散系数(10-14~10-16cm2/s)低和高倍率放电性能差的改性方法主要有:金属阳离子掺杂提高导电性、表面碳包覆提高电子导电率和减小颗粒粒径等[1]。在LiFePO4的合成方法中,溶胶-凝胶法的制备周期长、原料成本高、难以实现工业化;水热法的高压设备成本高、技术难度大,且产品价格高,不利于大规模应用。目前,工业上多采用高温固相法,通常以草酸亚铁为铁源,工艺较成熟,但颗粒不均匀、粒径分布范围广、难以控制产物的批次稳定性[2]。FePO4中Fe和P两种元素的比例与LiFePO4一致,如果以FePO4代替草酸亚铁作为铁源,可减少原料的种类,提高物料混合效率、简化工艺流程,还有望通过控制FePO4的形貌、粒度和化学成分,合成形貌一致性好、化学纯度高的LiFePO4。高剑等[3]采用控制结晶工艺制备球形掺碳FePO4前驱体,经过热处理合成球形LiFePO4/C,1C放电比容量达144.0 mAh/g,但掺碳共沉淀工艺复杂、反应条件难以稳定控制。与通常的沉淀结晶法相比,快速沉淀法的操控方便、反应速度快且成本低,可控制产物的形貌、粒度,制备亚微米甚至纳米粉体材料。
本文作者用快速沉淀法制备前驱体亚微米 FePO4·2H2O,再用碳热还原法合成LiFePO4/C复合材料,对FePO4·2H2O和LiFePO4/C进行结构和形貌分析,对LiFePO4/C进行电化学性能测试。
1 实验
1.1 FePO4·2H2O的快速沉淀法制备
将0.10 mol FeSO4·7H2O(江苏产,98.0%)和 0.10 mol NH4H2PO4(武汉产,98.0%)分别溶于等体积的去离子水中,然后量取0.06 mol H2O2(上海产,30.0%),在强烈搅拌的条件下将NH4H2PO4、FeSO4和H2O2溶液快速加入到烧杯中,控制水浴温度、反应1 h。将得到的乳白色沉淀过滤、用去离子水洗涤5次,于110℃下鼓风干燥12 h,得到浅黄色粉末。

表1 实验条件列表Table 1 The list of experimental conditions
1.2 LiFePO4/C的碳热还原法合成
按物质的量比1∶1称取自制FePO4·2H2O和Li2CO3(四川产,99.5%),每0.1 mol LiFePO4加入2.5 g葡萄糖(江苏产,99.0%)作为碳源和还原剂,以乙醇(天津产,AR)为介质,在QM型行星式球磨机(江苏产)上以200 r/min的转速球磨(球料比10∶1)2 h,将得到的浆料在80℃下烘干后,于氮气气氛中升温到650℃并保温8 h,随炉冷却到室温。
1.3 材料的分析
用Minflex型X射线衍射仪(日本产)进行晶体结构分析,CuKα,管压40 kV、管流300 mA,步宽为0.02 °,扫描速度为2(°)/min;用JSM-5600LV型扫描电子显微镜(日本产)和Tecnai G12型透射电子显微镜(TEM,美国产)进行微观形貌观察;用HW2000型红外碳硫分析仪(江苏产)对LiFePO4进行碳含量分析;用比色法测定FePO4·2H2O中磷的含量,用重铬酸钾滴定法测定FePO4·2H2O中的铁含量[4],并计算铁和磷的物质的量比(铁磷比);用MS2000激光粒度分析仪(英国产)分析LiFePO4的粒度分布。
1.4 电池的组装与电化学性能测试
按质量比8∶1∶1将活性物质、导电剂乙炔黑(河南产,AR)和粘结剂聚偏氟乙烯(日本产,AR)在N-甲基吡咯烷酮(日本产,AR)中混匀,制成浆料,涂覆在20 μm厚的铝箔(上海产,99.7%,)上,在120℃下真空(0.08 MPa)干燥4 h,再冲压成Ф=11 mm圆形正极片(约含2 mg活性物质)。以金属锂片(江苏产,AR)为负极,1 mol/L LiPF6/EC+DMC+EMC(体积比 1∶1∶1,江苏产,电池级)为电解液,Celgard 2400膜(美国产)为隔膜,在充满氩气的手套箱中组装CR2025型扣式电池。在室温下,用BTI-10测试仪(湖北产)对电池进行电化学性能测试,电压为2.5~4.1 V。
2 结果与讨论
2.1 FePO4·2H2O 的制备
2.1.1 溶液浓度对FePO4·2H2O的影响
制备无定形FePO4·2H2O的化学反应见式(1):

FePO4·2H2O 的室温溶度积常数Ksp为 9.91 × 10-16,在快速沉淀反应过程中,Fe2+瞬间被氧化成 Fe3+,FeSO4和NH4H2PO4的浓度乘积大于FePO4·2H2O的Ksp,此时溶液处于FePO4·2H2O的过饱和区。瞬间形成的大量晶核来不及长大,因此可制得颗粒细小的粉体材料,获得亚微米甚至纳米级的 FePO4·2H2O 沉淀[5]。
图1为不同浓度下制备的FePO4·2H2O的XRD图。

图1 不同溶液浓度制备的FePO4·2H2O的XRD图Fig.1 XRD patterns of FePO4·2H2O prepared at different solution concentrations
从图1可知,各样品的XRD图均无明显的衍射峰,说明不同溶液浓度制备的FePO4·2H2O均为无定形沉淀。
图2为不同溶液浓度制备的FePO4·2H2O的SEM图。

图2 不同溶液浓度制备的FePO4·2H2O的SEM图Fig.2 SEM photographs of FePO4·2H2O prepared at different solution concentrations
从图2可知,溶液浓度越高,制备的沉淀越细小,但团聚也越严重,低浓度时制备的沉淀形貌一致性较好,均为类球形且团聚不严重。浓度越高,反应溶液过饱和度越大,制备的沉淀越细小,但一次粒子小、表面能高,导致团聚严重。浓度为0.1~0.2 mol/L时,可制备形貌一致、粒度分布均匀的亚微米FePO4·2H2O沉淀。
反应过程中有H+产生,导致pH值的变化,会影响反应过程且对产物化学成分的影响很大,而反应物浓度直接决定溶液中H+的浓度,因此可通过改变反应物浓度来控制反应溶液的pH值,以影响产物化学成分。不同溶液浓度制备的FePO4·2H2O的铁磷比见表2。
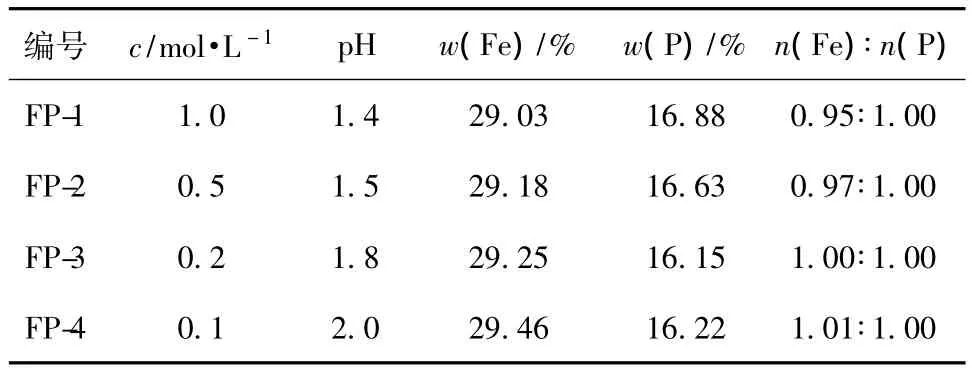
表2 不同溶液浓度制备的FePO4·2H2O的铁磷比Table 2 The molar ratio of Fe and P for FePO4·2H2O prepared at different solution concentrations
从表2可知,溶液浓度较高、pH值较低时,产物的铁磷比小于1,实验现象为:产物的颜色偏黄,可能有多聚磷酸盐产生。王志兴等[6]认为,当 pH值较低时,有 H3Fe(PO4)2·2.5H2O和FeH2P3O10·1.5H2O产生。溶液中还存在式(2)所示的副反应,在反应过程中,会产生少量Fe(OH)3,尤其是当pH >1.8时。当反应物浓度减小后,反应过程中的pH值会增大,即H+浓度减小,会使产物中Fe(OH)3的含量增加,沉淀的颜色变黄,铁磷比增大。
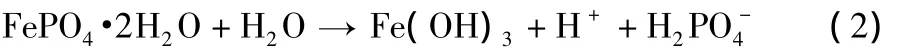
当反应物浓度为0.2 mol/L时,反应过程的pH值为1.8,产物铁磷比为1.00,最接近理论值,可制备纯度更高的LiFePO4,因此选取溶液浓度为0.2 mol/L。
2.1.2 温度对FePO4·2H2O的影响
图3是不同温度下制备的FePO4·2H2O的SEM图。

图3 不同温度下制备的FePO4·2H2O的SEM图Fig.3 SEM photographs of FePO4·2H2O prepared at different temperatures
随着反应温度的升高,单位时间内生成的晶核增加,瞬间生成的大量晶核来不及长大,因此制备的沉淀越细小。从图3可知,在90℃下制备的FePO4·2H2O的一次颗粒粒径小于100 nm,已达到纳米级别;但由于团聚严重,颗粒表面能较大,在烧结过程中会团聚凝结成大颗粒,不利于制备纳米LiFePO4。在30℃和50℃下制备的亚微米FePO4·2H2O为类球形沉淀,形貌一致性好且团聚不严重。
在30℃和50℃下制备的FePO4·2H2O为接近白色的浅黄色,随着反应温度升高,制备的FePO4·2H2O的颜色由浅黄色变为黄色,在90℃下制备的沉淀为棕黄色。随着反应温度升高,Fe2+更易于被氧化成Fe3+,且较高温度下Fe3+的水解反应更严重,铁磷比大于1.00,如表3所示。
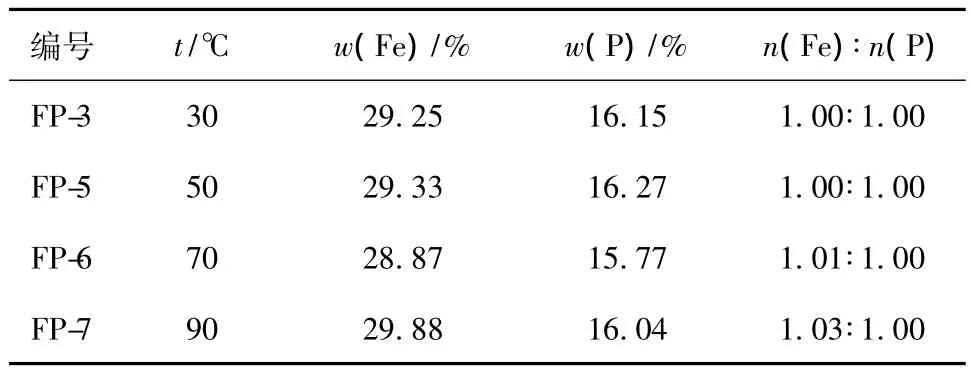
表3 不同温度下制备的FePO4·2H2O的铁磷比Table 3 The molar ratio of Fe and P for FePO4·2H2O prepared at different temperatures
综上所述,在30℃和50℃下制备的FePO4·2H2O,铁磷比最接近1.00,一次颗粒粒径为200~300 nm,团聚不明显,有利于制备形貌一致、粒度均匀、纯度较高的LiFePO4。在50℃时,反应物质比在30℃时的化学活性更高、反应速度更快,有利于大规模应用,因此选择反应温度为50℃。制备FePO4·2H2O的优化条件为:溶液浓度0.2 mol/L、反应温度为50℃。
2.2 LiFePO4/C的合成
以优化条件下制备的FePO4·2H2O为前驱体,通过碳热还原法合成LiFePO4/C复合材料,进行相关分析。
2.2.1 LiFePO4/C的物相及形貌
图4为LiFePO4/C复合材料的XRD图。
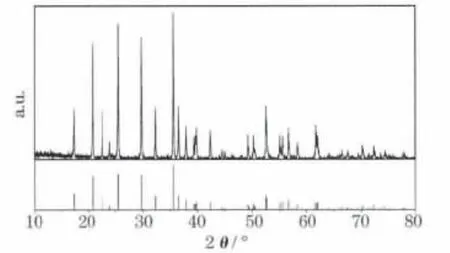
图4 LiFePO4/C复合材料的XRD图Fig.4 XRD pattern of LiFePO4/C composite
从图4可知,样品的衍射峰与LiFePO4的标准谱(JCPDS:81-1173)一致,为正交晶系橄榄石结构,属Pnma空间群,特征峰明显,背底较平整,无其他杂质峰,为纯相LiFePO4。经计算,样品的晶胞参数为:a=1.033 0 nm,b=0.600 7 nm,c=0.469 2 nm,与 LiFePO4的晶胞参数(a=1.033 2 nm,b=0.601 0 nm,c=0.469 2 nm)[7]基本吻合。
图5为LiFePO4/C复合材料的SEM图。

图5 LiFePO4/C复合材料的SEM图Fig.5 SEM photographs of LiFePO4/C composite
从图5可知,样品的粒度分布与前驱体FePO4·2H2O一致,一次颗粒分布于200~400 nm,粒度分布均匀一致、没有严重的团聚。LiFePO4较小的颗粒粒径有利于缩短Li+和电子的传输距离,提高材料导电性,改善材料的电化学性能。颗粒之间的间隙构成了蓬松多孔的亚微观结构,有利于电解液的渗透扩散,可提高材料的比容量和倍率放电性能。
LiFePO4/C复合材料的粒度分布见图6。

图6 LiFePO4/C复合材料的粒度分布曲线Fig.6 Particle size distribution curve of LiFePO4/C composite
从图 6 可知,材料的D10=0.367 μm、D50=0.830 μm、D90=4.029 μm。D50大于SEM图中观察到的一次颗粒粒径,是LiFePO4/C材料中一次颗粒团聚成二次颗粒所致。粒度分布实验结果表明:LiFePO4/C复合材料的粒度分布集中,与SEM图中均匀的粒径分布一致。
2.2.2 LiFePO4/C的碳含量与碳包覆碳硫分析仪测得,LiFePO4/C中的碳含量为2.1%。图7为LiFePO4/C复合材料的TEM图。

图7 LiFePO4/C复合材料的TEM图Fig.7 TEM photographs of LiFePO4/C composite
从图7可知,颗粒表面都有较完整的碳膜包覆,碳膜的厚度为1~2 nm,颗粒之间也有絮状碳膜连接,相邻的两个颗粒之间有较厚的碳膜相连,构成了较完整的电子导电网络。在碳热还原反应中,三价铁的还原与碳的包覆同时进行,可在较低的碳含量下获得完整的碳包覆导电网络。这既可降低碳源的使用量,又可获得较高的振实密度和较低的比表面积,提高LiFePO4/C复合材料的加工性能。
2.2.3 LiFePO4/C复合材料的电化学性能
LiFePO4/C复合材料的电化学性能测试结果见图8。
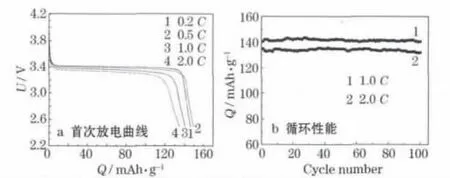
图8 LiFePO4/C复合材料的电化学性能Fig.8 Electrochemical performance of LiFePO4/C composite
从图8可知,LiFePO4/C在0.2C、0.5C、1.0C和2.0C时的首次放电比容量分别为146.6 mAh/g、149.6 mAh/g、140.5 mAh/g和134.9 mAh/g,电压平台良好。0.2C首次放电比容量低于0.5C时,是因为首次充放电时,电解液未完全渗透进入电极。LiFePO4/C复合材料第100次1.0C、2.0C循环的比容量分别为140.5 mAh/g、132.0 mAh/g,容量保持率分别为97.8%、100.0%。
3 结论
以FeSO4·7H2O和 NH4H2PO4为原料,H2O2为氧化剂,通过快速沉淀法制备FePO4·2H2O。当反应物为0.2 mol/L、反应温度为50℃时,可制备形貌一致性好、粒度分布均匀、铁磷比为1.00的无定形亚微米FePO4·2H2O。以亚微米无定形FePO4·2H2O为前驱体、葡萄糖为碳源,通过碳热还原法可制得粒径分布均匀、结晶性好且碳包覆完整的亚微米LiFePO4/C复合材料。以1.0C和2.0C循环,样品的首次放电比容量分别为140.5 mAh/g和134.9 mAh/g,第100次循环的容量保持率分别为100.0%和97.8%。
[1]Wang J J,Sun X L.Understanding and recent development of carbon coating on LiFePO4cathode materials for lithium-ion batteries[J].Energy & Environmental Science,2012,5(1):5 163 -5 185.
[2]DING Dong(丁冬),WU Guo-liang(吴国良),PANG Jing(庞静),et al.正极材料LiFePO4研究与产业化的进展[J].Battery Bimonthly(电池),2010,40(5):282 -284.
[3]GAO Jian(高剑),YING Jie-rong(应皆荣),JIANG Chang-yin(姜长印),et al.球形纳米晶LiFePO4和Li4Ti5O12的制备及电池研究[J].Journal of Inorganic Materials(无机材料学报),2009,24(1):139-142.
[4]WANG Xiao-yan(王晓艳),WANG Xing(王星),WANG Yu-feng(王玉锋).LiFePO4化学成分测定[J].Dianyuan Jishu(电源技术),2006,30(9):764 -767.
[5]Scaccia S,Carewska M,Wisniewski P,et al.Morphological investigation of sub-micron FePO4and LiFePO4particles for rechargeable lithium batteries[J].Mater Res Bull,2003,38(7):1 155 -1 163.
[6]WANG Zhi-xing(王志兴),WU Ling(伍凌),LI Xin-hai(李新海),et al.LiFePO4的前驱体制备与性能[J].Journal of Functional Materials(功能材料),2008,39(4):614 -617.
[7]LI Shao-min(李绍敏),LIU Heng(刘恒),CHEN Liang(陈亮),et al.液相沉淀-多元醇还原法合成LiFePO4/C正极材料的电化学性能[J].The Chinese Journal of Nonferrous Metals(中国有色金属学报),2012,22(5):1 311-1 318.
Submicro LiFePO4/C prepared by fast precipitation-carbothermal reduction method
PENG Zhong-dong1,PEI Zhen-xing1,SHI Di-hui2,HU Guo-rong1
(1.School of Metallurgical Science and Engineering,Central South University,Changsha,Hunan410083,China;2.Linyi Gelon Battery Material Co.,Ltd.,Linyi,Shandong276023,China)
Submicro amorphous FePO4·2H2O was prepared by fast precipitation method using FeSO4·7H2O,NH4H2PO4and H2O2as raw materials,LiFePO4/C composite was synthesized by carbothermal reduction method with the homogeneous mixture of FePO4·2H2O,Li2CO3and glucose.The effects of reagent concentration and reaction temperature to FePO4·2H2O were investigated by XRD,SEM and TEM analyses and charge-discharge test.Submicro amorphous FePO4·2H2O synthesized with solution concentration of 0.2 mol/L and reaction temperature at 50 ℃ had the same morphology,uniform particle size distribution and high purity.LiFePO4/C composite as prepared had uniform particle size distribution,complete carbon coating,when charged-discharged in 2.5 ~4.1 V,its 1.0Cand 2.0Cinitial specific discharge capacity was 140.5 mAh/g and 134.9 mAh/g,respectively,the capacity retention rate in the 100th cycle was 100.0%and 97.8%,respectively.
cathode material;fast precipitation;iron phosphate(FePO4);lithium iron phosphate(LiFePO4)
TM912.9
A
1001-1579(2013)05-0257-04
彭忠东(1969-),男,湖南人,中南大学冶金科学与工程学院副教授,研究方向:应用电化学;
裴振兴(1986-),男,山东人,中南大学冶金科学与工程学院硕士生,研究方向:锂离子电池材料,本文联系人;
石迪辉(1980-),男,湖南人,临沂杰能新能源材料有限公司总工程师,研究方向:锂离子电池材料;
胡国荣(1963-),男,湖南人,中南大学冶金科学与工程学院教授,研究方向:应用电化学。
2012-02-02

