应用化学传感器和GC-MS研究加热温度与大豆油挥发物质的关系
孙 静 黄沁怡 李 芳 刘凌涛 韩 芳 苏秀榕
(宁波大学海洋学院,宁波 315211)
食用油是人类生活的必需品,不仅为人体提供热量、必需脂肪酸以及脂溶性的维生素,还是食品加工的重要原料[1],其中油炸食品由于其快速方便并具有其他食品难以比拟的香气而受到广大消费者的喜爱。常见的食用油多为植物性油脂,包括大豆油、花生油、葵花籽油、橄榄油、菜籽油、玉米胚芽油、芝麻油和调和油等。食用油在高温条件下烹调,很容易发生氧化、聚合、裂解和水解等反应,生成醛类、醇类、酮类、烃类等化合物,这些物质中的一些物质会危害人类健康[2-3]。
目前,检测高温煎炸后的食用油多采用传统的化学方法,包括过氧化值、酸价、羰基值、碘值等的测定,这些方法突出的缺点是必须在实验室内有专业人员操作,检测复杂、耗时[4]。因此,有必要根据高温食用油发生的变化开发一些快速的检测方法。其中化学传感器是一种新颖的分析、识别和检测复杂气味和大多数挥发性成分的仪器,其工作原理类似人的鼻子,故又称之为“电子鼻”[5]。它是通过传感器与气味的物质反应后,由一系列物理、化学变化产生电信号,经电子线路放大及A/D转换成数字信号输入计算机中,进行数据处理和模式识别[6]。
食用油在不同加热温度下风味有着很大的差别,不管是炒菜的菜香味还是油炸食品的风味在很大程度上都受到加工过程中食用油风味的影响,有必要探讨不同的加热温度与食用油风味变化之间的关系,建立高温食用油的快速检测方法。国内外对食用油在贮藏期间品质的变化以及掺假问题的研究较多[7-8],而利用化学传感器和GC -MS技术对食用油在不同加热温度下挥发性物质的变化未见报道。
1 材料与方法
1.1 材料与仪器
金龙鱼食用大豆油:上海嘉里食品工业有限公司生产,生产日期2011年10月3日;便携式化学传感器PEN 3:德国AIRSENSE公司;65μm聚二甲基硅氧烷萃取头:美国Supelco公司;7890GC-M 7 MS安捷伦科技有限公司:北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 化学传感器检测
精确称取大豆油0.5 g于10 mL样品瓶中,压盖密封。将样品分别置于 80、100、120、140、150、160、180、200、220恒温箱中加热30 min,以未加热处理大豆油为对照,分别作5组平行。利用PEN 3便携式化学传感器系统进行检测,信号采集时间为100 s。
1.2.2 顶空固相微萃取
选取未加热、150、180、220℃的大豆油,将SPME针头插入待检样品中,50℃水浴吸附30 min,250℃热解吸2 min,用于7890GC-M7 MS分析。
1.2.3 GC -MS 检测
色谱条件:DB-5MS毛细管色谱柱(30 m×0.25 mm ×0.25 μm);载气:He,恒流1 mL/min;不分流模式进样;进样口温度与接口温度均为220℃;程序升温:起始柱温50℃保持5 min,以5℃/min升至160℃,保留5 min,再以10℃/min升至250℃,保持2 min。
质谱条件:离子源:电子轰击源(EI);电子能量:70 eV;离子源温度:220℃;扫描质量范围:45-300 u。通过气质联用仪配置的NIST谱库进行计算机检索并参考有关文献定性确定化合物,采用面积归一化法确定各组分的相对含量。
1.2.4 数据分析
运用化学传感器配套的WinMuster软件对数据进行主成分分析(PCA)及线性判别分析(LDA)。PCA将所提取的传感器多指标信息进行数据转换和降维,并对降维后的特征向量进行线性分类,最后在PCA分析的散点图上显示主要的两维散点图。PCA1和PCA2上包含了在PCA转换中得到的第一主成分和第二成分的贡献率。贡献率越大,说明主要成分可以较好的反映原来多指标的信息。一般情况下,总贡献率超过 70% ~85%的方法即可使用[9-10]。LDA是研究样品所属类型的一种统计方法,更加注重样品在空间中的分布状态及彼此间的距离分析,将样品信号数据通过运算法则投影到某一方向,使得组与组之间的投影尽可能分开[11]。
2 结果与讨论
2.1 温度与大豆油挥发性物质的关系
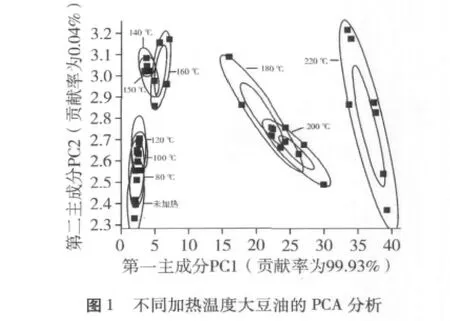
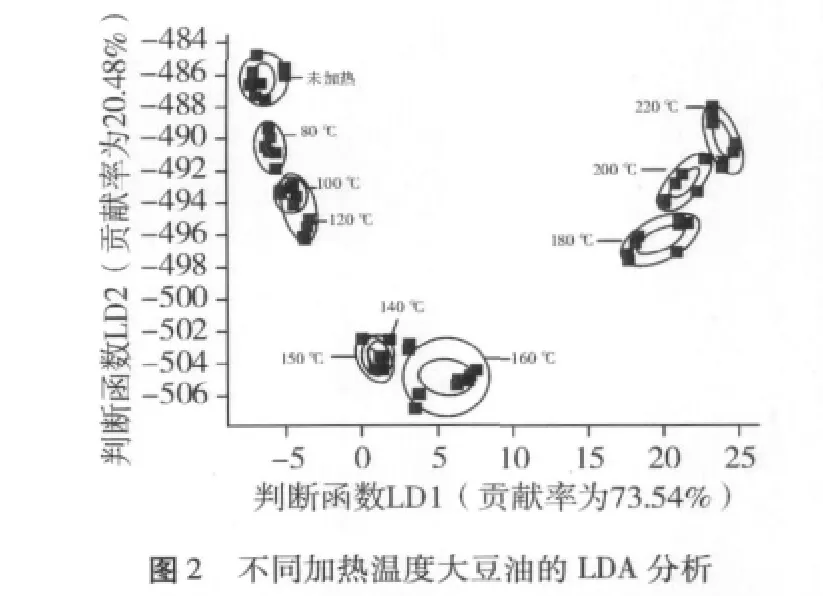
图1、图2分别为大豆油在加热不同的温度后利用化学传感器检测的PCA和LDA图。检测数据经PCA和LDA两种统计方法分析,总的贡献率均达到90%以上,尤其是PCA中,总贡献率为99.97%,说明两种方法提取的信息能够很好的反应原始数据的大部分信息。从图1、图2可知,随着温度的升高,大豆油的气味随之发生变化,而且这种变化呈现一定的规律,温度越高这种变化越加明显,不同加热温度的豆油呈现一定的聚类特性。采用PCA方法分析,未加热豆油、加热80℃豆油、加热100℃豆油和加热120℃豆油位于同一区域,加热140、150和160℃的豆油位于同一区域,180℃和200℃加热的豆油占据一个区域,220℃加热的豆油独自位于一个区域。说明传感器对不同加热温度的大豆油响应差别较大,表明通过PCA方法可以将各温度的大豆油较好的区分开。采用LDA方法进行分析,各温度的大豆油同样可以很好的区分。未加热、150、180、220℃加热处理的大豆油分别位于不同的区域,说明这些加热温度的大豆油之间在挥发性物质上存在明显的差异。因此,运用顶空固相微萃取气质联用技术对未加热、150、180和220℃加热处理的大豆油挥发性物质做进一步分析,以期探究大豆油随着加热温度的升高,油脂挥发性物质的产生与变化,选择合适的炒菜和煎炸温度,从而避免大豆油产生的劣变气味和有害物质。
2.2 大豆油挥发性物质的GC-MS分析结果
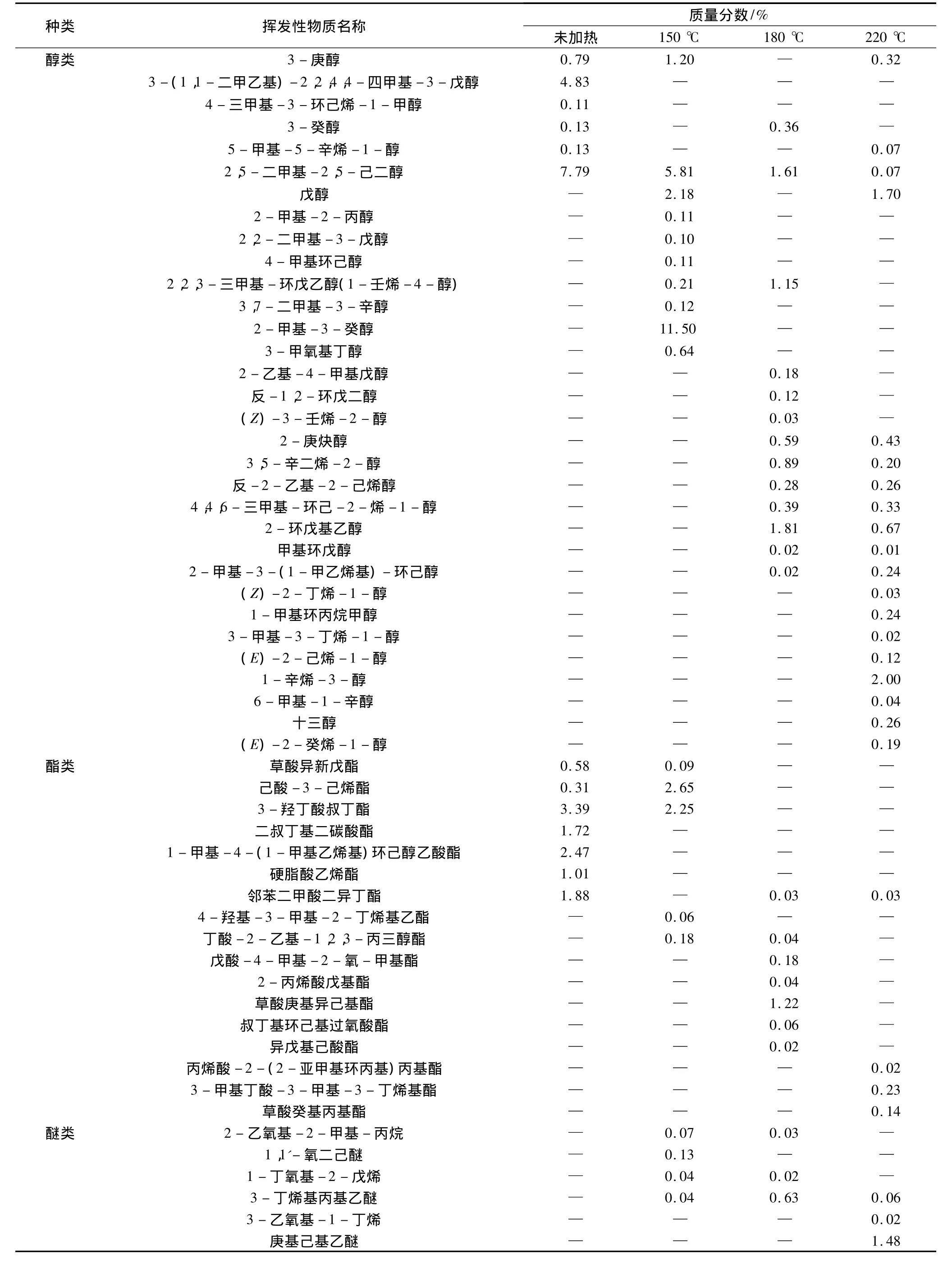
未加热、150℃、180℃和220℃加热处理的大豆油样品经GC-MS分析,使用谱库检索分别鉴定出27、60、100、115种挥发性物质。从挥发性物质的类别来看,包括烃类、醛类、酮类、醚类、酯类、酸类、杂环化合物、氢过氧化物等。从表1中可以看出,随着加热温度的升高,大豆油挥发性化合物的种类明显增加,主要原因是温度加速了油脂的氧化分解,温度越高,油脂氧化分解速度越快。
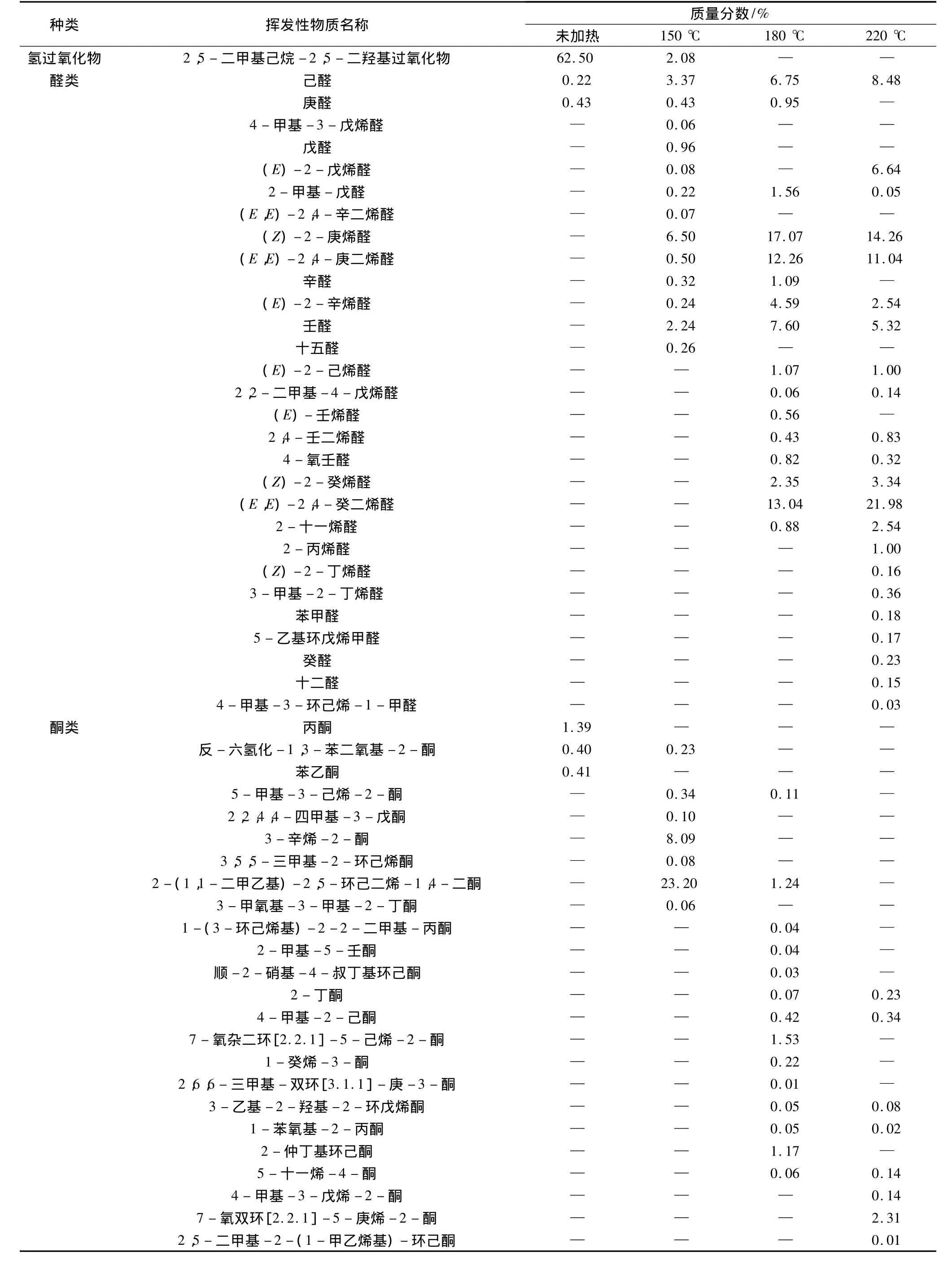
表1 不同加热温度大豆油的挥发性物质
续表
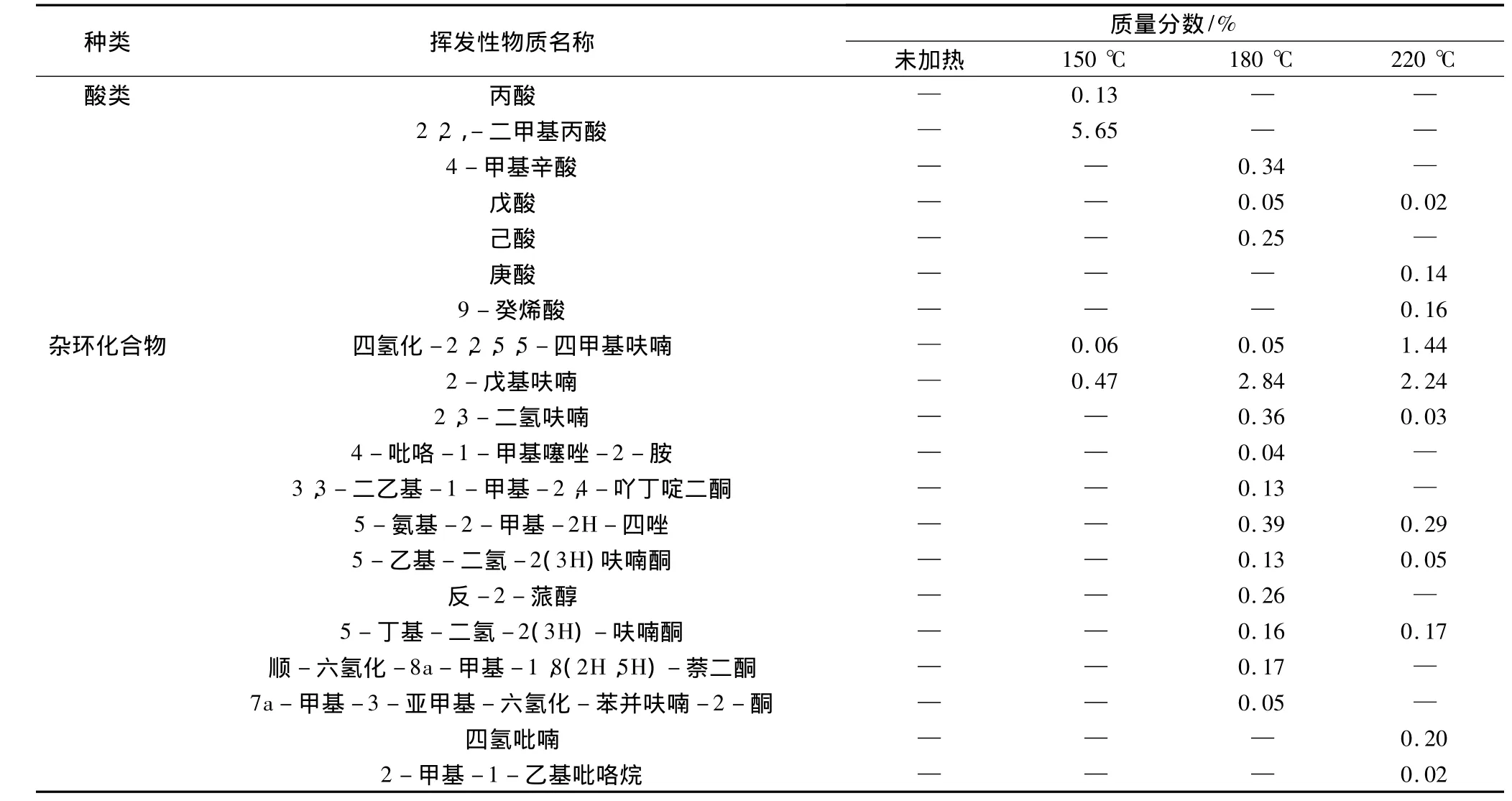
续表
大豆油加热后挥发性物质的相对含量见图3。在作为对照组的未加热大豆油样品中,挥发性物质中氢过氧化物的质量分数最高,达到62.5%。一般来说,氢过氧化物几乎没有任何风味。它是不饱和脂肪酸通过自动氧化、光敏氧化以及酶促氧化3种途径转变而来的,是不饱和脂肪酸的一级氧化产物[12]。氢过氧化物再进一步分解,就会形成复杂挥发性物质的混合物,包括小分子量的醛类、酮类、醇类以及短链的烃等,这些物质的形成将会对大豆油的风味产生很大的影响[13]。由此,可以推断出未加热的大豆油在储藏过程中发生了一定程度的自动氧化。在150℃的大豆油中,氢过氧化物的质量分数明显减少,降至2.08%。180℃和220℃大豆油中,没有检测出氢过氧化物。说明温度的升高,加速氢过氧化物的分解。
加热150℃的大豆油中酮类(32.09%)、醇类(21.99%)较其他样品的相对含量高。其中3-辛烯-2-酮(8.09%)具有泥土香、酮香、甜香、花香、果味香[12],是允许使用的食品香料。醇类包括戊醇、2-甲基-2-丙醇、2,2-二甲基 -3-戊醇、4-甲基环己醇、2,5-二甲基-2,5-己二醇、甲基环戊醇和1-甲基环丙烷甲醇等小分子量的醇,具有一定的醇香。可以推断出这可能是炒菜时产生油香味的原因。
随着温度的升高,杂环类化合物的相对质量分数从零增加到4.57%。尤其是2-戊基呋喃,是一种典型的亚油酸氧化的产物,具有豆香、果香、泥土、青香及类似蔬菜的香韵[12]。杂环类化合物大都具有很强的焦香味以及极低的香气阈值,这些香味物质往往引诱人们食用油炸食品。
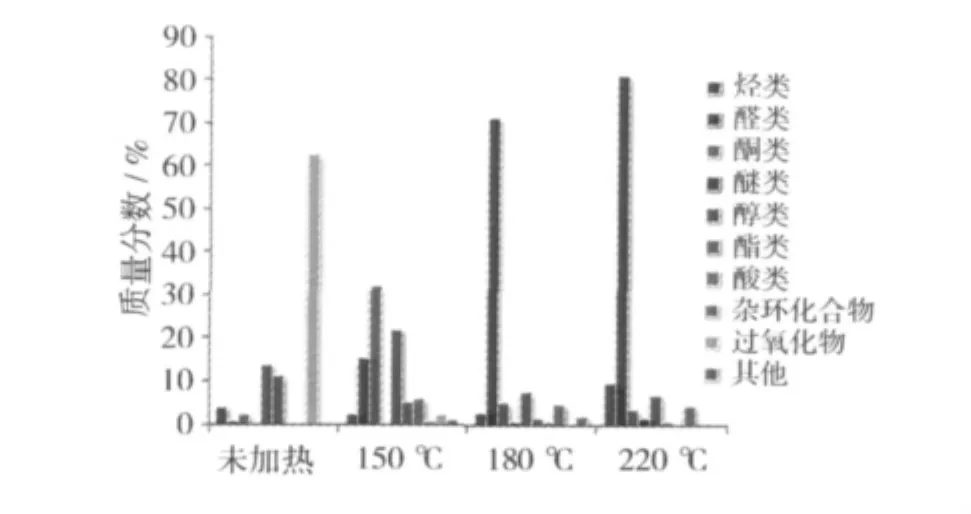
图3 不同温度大豆油挥发物的质量分数
从图3中可以看出,加热180℃和220℃大豆油的挥发性物质中醛类的含量明显高于其他样品,质量分数分别为71.09%、80.75%。醛类中己醛、2-庚烯醛、壬醛是油酸和亚油酸等脂肪酸氧化产生的典型挥发性成分[14]。未加热豆油中仅检测出己醛与庚醛两种饱和醛类,其中己醛由未加热大豆油中的0.22%到加热220℃大豆油中的8.48%,己醛的这种变化趋势同Jeleń等[15]的研究结果。加热220℃的大豆油中检测出较多的烯醛类物质,如2-丙烯醛(1.00%)、(Z)-4 -庚烯醛(14.26%)、(E,E)-2,4-庚二烯醛(11.04%)、(E,E)-2,4-癸二烯醛(21.98%)等是油烟的主要成分,这些物质的产生会造成低空环境污染,严重影响人类健康[16]。这也为建议人们减少食用油炸食品提供了有力的证据。
3 结论
3.1 化学传感器可以快速地检测到不同温度大豆油风味的变化,建立合适的模型后可以用于油脂品质以及“回锅油”等高温油脂的快速鉴定。化学传感器具有快速、灵敏等特性可以弥补传统评价油脂氧化方法的不足,具有良好的应用前景。
3.2 通过GC-MS对不同温度大豆油的挥发物进行分析得出:从超市购买的大豆油发生了一定程度的自动氧化,建议超市以及家用食用油在避光阴凉处贮藏;150℃大豆油中酮类(32.09%)和醇类(21.99%)是主要的挥发性物质,如3-辛烯-2-酮、戊醇、2-甲基 -2-丙醇、2,2-二甲基 -3-戊醇、4-甲基环己醇等,表现为炒菜时散发的油香味;180℃和220℃大豆油中挥发性物质主要为醛类以及杂环化合物,它们产生焦香味、烤香味的同时也带来了大量的油烟,严重危害着人类的健康。
[1]王若兰,徐卫星,李守星,等.食用油不同储藏技术的效果研究[J].农业机械,2012(1):55-58
[2]周雅琳,周令国,李智,等.影响煎炸油中极性化合物生成因素的研究[J].中国粮油学报,2010,25(3):50-53
[3]Blumenthal M M.A new look at the chemistry and physics o f deep fat frying[J].Food technology,1991,45(2):68 -72
[4]苏蕊,梁大鹏,李明,等.食用油品质的检测技术进展[J].岩矿测试,2012,31(1):57 -63
[5]潘磊庆,唐琳,詹歌,等.化学传感器对芝麻油掺假的检测[J].食品科学,2010,31(20):318 -321
[6]聂雪梅,刘仲明,张水华,等.电子鼻及其在食品领域的应用[J].传感器技术,2004,23(10):1 -3
[7]Chae L L,Hong E J,Son H J,et al.Effects of roasting condition and storage time on changes in volatile compounds in rapeseed oils[J].Korean Journal of Food Science and Technology,2011,43(3):291 -302
[8]Hong E J,Son H J,Choi JY,et al.Authentication of rapeseed oil using an electronic nose based on mass spectrometry[J].Korean Journal of Food Science and Technology,2011,43(1):105-109
[9]海铮,王俊.基于化学传感器山茶油芝麻油掺假的检测研究[J].中国粮油学报,2006,21(3):192 -197
[10]徐亚丹,王俊,赵国军.基于电子鼻的对掺假的“伊利”牛奶的检测[J].中国食品学报,2006,6(5):111 -118
[11]李琴,朱科学,周慧明.利用电子鼻分析熬制时间对3种食用菌汤风味的影响[J].食品科学,2010,31(16):151-155
[12]Mette H,Mikael A P,Gaamangwe N M,et al.Headspace volatile composition and oxidative storage stability of pressed marama bean(Tylosema esculentum)oil[J].Food Chemistry,2012,132:1749 -1758
[13]Choe E,Min D B.Mechanisms and factors for edible oil oxidation[J].Comprehensive Reviews in Food Science and Food Safety,2006(5):169 -186
[14]Lee J H,Min D B.Effects of photooxidation and chlorophyll photosensitization on the formation of volatile compounds in lard model systems[J].Food Science Biotechnology,2009,18(2):413-8
[15]Jeleń H H,Mildner- Szkudlarz S,Jasińska I,et al.A headspace–SPME–MS method for monitoring rapeseed oil autoxidation[J].Jounral America Oil Chemistry Society,2007,84:509 -517
[16]毕彤,陆向文,谢兵,等.烹饪过程中油烟雾有机物组分的 GC/MS测定[J].质谱学报,1996,17(3):63 -67.

