组合微生物发酵提高豆粕品质的方法与优化工艺研究
李文立 孙振钧 任慧英
(青岛农业大学动物科技学院1,青岛 266109)
(中国农业大学资源与环境学院2,北京 100193)
豆粕是以大豆子实为原料采用浸提法提取脂肪后,经适当热处理与干燥制得的产品。由于其适口性好,蛋白质质量分数高达43%以上,氨基酸组成比较合理,消化利用率高,是饲料工业中重要的蛋白质饲料资源,广泛应用于畜禽及水产动物的配合饲料中。然而,由于豆粕中含有胰蛋白酶抑制剂(Trypsin Inhibitors,简称TI)、大豆凝集素、抗原蛋白、脲酶等多种抗营养因子,尤其是TI含量高,在动物消化道中可抑制胰蛋白酶的活性,降低饲料蛋白质消化率,引起动物胰腺肥大,影响动物的生长发育,降低了其饲用价值[1-3]。
豆粕中抗营养因子的去除方法主要包括物理、化学和生物学方法。物理处理主要采用高温膨化,尽管去除效果较好,但能源消耗较大,成本较高;化学处理主要采用适当的化学试剂处理豆粕,也有一定效果,但容易导致化学物质残留,且工艺比较复杂,易污染环境,其中的氨基酸、矿物质和维生素等营养成分易被破坏,导致豆粕营养价值降低;生物学处理方法主要采用生物育种和各种生物学技术处理豆粕,目前在国内外研究较多[4-8]。
微生物发酵豆粕作为生物学处理方法之一,已被证明是一种有效的降低和去除抗营养因子的方法[9-10]。在豆粕发酵过程中,微生物不仅能产生多种具有生物学活性的酶类,有效钝化其中的胰蛋白酶抑制剂等抗营养因子,而且豆粕中的蛋白质还可以被微生物产生的蛋白酶分解为小肽,易于被动物消化吸收,从而提高了利用率和营养价值,改善了适口性。目前,用于豆粕发酵的微生物菌种主要有酵母菌、芽孢杆菌、米曲霉、乳酸菌等,有的采用单菌发酵,有的采用多菌种混合发酵。由于影响豆粕发酵的因素很多,而国内有关豆粕发酵的适宜菌种选择及发酵工艺参数的研究刚刚起步,尤其是在菌种选择、发酵的工艺参数及对豆粕营养价值影响的研究结果差异较大[11-13]。为了进一步了解微生物发酵对豆粕品质的影响,本文采用枯草芽孢杆菌、酵母菌和乳酸菌作为发酵菌株,主要以豆粕中最主要的抗营养因子—胰蛋白酶抑制剂为指标,研究了接种量、料水比、发酵时间、发酵温度等对发酵豆粕的影响,旨在确定豆粕适宜的发酵参数以及发酵对豆粕品质的影响,为生产实践中豆粕的发酵及应用提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种和豆粕
枯草芽孢杆菌、酵母菌和乳酸菌,青岛农业大学微生物实验室保存。豆粕为市售,国产,含水量12.5%,粗蛋白质量分数42.85%。
1.1.2 主要仪器设备
超净工作台:苏州佳宝净化工程设备有限公司;SPH-200D型恒温摇床:上海世平实验设备有限公司;LHS-250SC型恒温培养箱:北京中科浩宇科技发展有限公司;YAMATO sp300型高压灭菌锅:日本大和科学株式会社;DU-800型紫外-可见分光光度计:美国Beckman公司;AR2140型电子分析天平:美国Ohaus公司;DD-5型离心机:长沙湘麓离心机仪器有限公司;pHS-3C型数字酸度计:成都世纪方舟科技有限公司;UDK142型全自动凯氏定氮仪:意大利VELP公司;835-50型氨基酸分析仪:日本日立公司。
1.1.3 种子培养基
枯草芽孢杆菌培养基采用牛肉膏培养基(牛肉膏3.0 g,蛋白胨10.0 g,氯化钠 5.0 g,琼脂 15.0 g,葡萄糖15.0 g,蒸馏水1 000 mL);酵母菌培养基采用马铃薯葡萄糖培养基(马铃薯20.0 g,葡萄糖2.0 g,琼脂2.0 g,蒸馏水 100 mL,自然 pH);乳酸菌培养基为MRS 培养基(蛋白胨 10.0 g,牛肉膏 10.0 g,酵母膏5.0 g,葡萄糖 20.0 g,柠檬酸氢二铵 2.0 g,吐温 -80 1.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,琼脂18.0 g,蒸馏水1 000 mL)
1.2 发酵方法
1.2.1 种子培养方法
菌种活化后接种于种子培养基中,培养24 h后测定菌体密度。
1.2.2 发酵豆粕的生产工艺
豆粕→预处理(粉碎,过40目筛)→加水,配制发酵基础培养基→灭菌→接种→发酵→干燥→粉碎。其中,接种的枯草芽孢杆菌、酵母菌和乳酸菌均为在种子培养基中培养24 h后的培养液。
1.2.3 不同条件对发酵的影响
在基础发酵培养基上,研究不同发酵条件对豆粕发酵的影响。
1.2.3.1 接种量对豆粕发酵的影响。采用枯草杆菌、酵母菌和乳酸菌混合发酵,通过正交试验筛选3种菌株的适宜接种量。根据马文强等[8]和姚晓红等[14]研究资料确定接种量。试验因素和水平见表1。度分别设定为20、25、30、35、40℃。根据适宜的接种量和料水比,测定发酵72 h后的胰蛋白酶抑制剂含量[14],确定适宜的发酵温度。
1.2.3.4 发酵时间对豆粕发酵的影响。发酵时间设定为 24、48、60、72、84、96 h。根据适宜的接种量、料水比和发酵起始温度,确定适宜的发酵时间。
1.2.3.5 初始pH对豆粕发酵的影响。用缓冲液将培养基的初始 pH 分别调为 4.0、5.0、6.0、7.0、8.0、9.0及pH自然(自来水),72 h后测定豆粕中胰蛋白酶抑制剂的含量。
1.2.4 综合发酵试验
根据上述发酵条件的优化结果,进行综合发酵试验,通过测定豆粕胰蛋白酶抑制剂活性及营养成分含量,验证发酵对豆粕品质的影响。
1.3 豆粕成分分析测定
1.3.1 胰蛋白酶抑制剂活性测定
采用改进的PAPNA法[15]。准确称取3 g豆粕样品于三角瓶中,加入50 mL Tris缓冲液,振荡3 h后,2 700 r/min离心10 min,取上清液按20~30倍稀释。取上述稀释好的样品液1 mL于试管中,加入2.5 mL BAPNA溶液,将试管置于37℃水浴锅中预热10 min,加入1 mL牛胰蛋白酶溶液,准确计时,反应10 min后加入0.5 mL 30%醋酸终止反应。410 nm比色。按同样方法同时测定空白溶液,只是先加入30%醋酸然后加入牛胰蛋白酶溶液。每个样品设3个重复,结果取平均值。
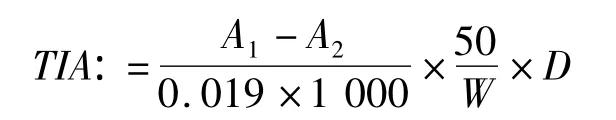
式中:TIA为胰蛋白酶抑制因子活性/mg/g;A1为样品溶液410 nm的吸光值;A2为空白溶液410 nm的吸光值;W为样品质量/g;0.019为1μg牛胰蛋白酶410 nm吸光值;D为稀释倍数。
1.3.2 常规营养成分的测定
粗蛋白质含量的测定采用凯氏定氮法GB/T 6432—1994;粗脂肪测定采用索氏抽提法 GB/T 6433—1994;氨基酸态氮含量的测定参考陈美春等的方法,采用双指示剂甲醛滴定法[16]。所有测定样品均设3个重复,结果取平均值。
1.3.3 氨基酸含量的测定
豆粕中氨基酸含量的测定参考《饲料中氨基酸的测定,GB/T 18246—2000》,采用氨基酸自动分析仪测定。其中,含硫氨基酸的测定采用氧化酸解法,色氨酸的测定采用碱解法[17]。所有测定样品均设3个重复,结果取平均值。
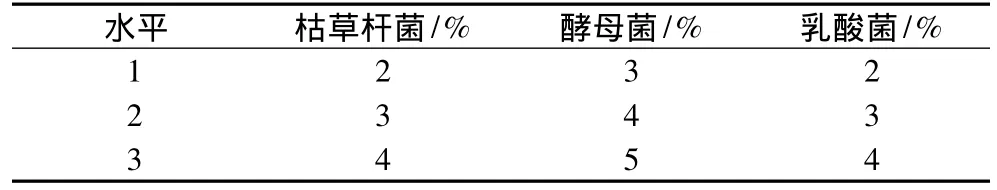
表1 菌株接种量正交试验设计
1.2.3.2 料水比对豆粕发酵的影响。不考虑豆粕本身的含水量,料水比设定为 1∶0.5、1∶0.6、1∶0.7、1∶0.8、1∶0.9、1∶1.0、1∶1.1、1∶1.2。根据筛选的适宜接种量,测定发酵初始温度为30℃,发酵72 h后豆粕中胰蛋白酶抑制剂含量[14],确定适宜的料水比。
1.2.3.3 温度对豆粕发酵的影响。发酵初期的温
2 结果与讨论
2.1 接种量对发酵豆粕中胰蛋白酶抑制剂含量的影响
接种量直接影响发酵效果,适宜的接种量是保证发酵豆粕品质的基础。本试验研究结果(表2)表明,3种菌株发酵豆粕,对胰蛋白酶抑制剂的灭活效果,按影响力大小的次序为枯草芽孢杆菌﹥酵母菌﹥乳酸菌,最佳接种量为枯草芽孢杆菌4%,酵母菌5%,乳酸菌2%。该结果与付弘赟等[18]和姚晓飞等[19]的研究结果一致,证明枯草芽孢杆菌、酵母菌等可通过产生各种蛋白酶而钝化其中的胰蛋白酶抑制剂,同时,枯草芽孢杆菌的钝化效果最好。
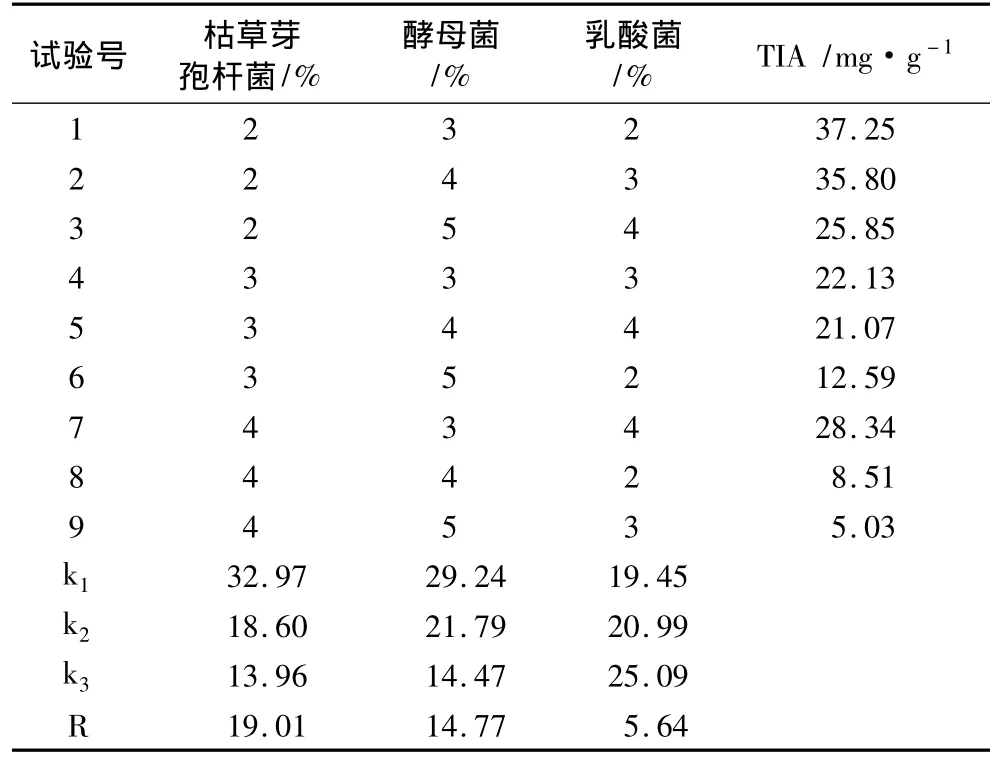
表2 接种量对发酵豆粕胰蛋白酶抑制剂(TI)含量的影响
2.2 料水比对发酵豆粕中胰蛋白酶抑制剂含量的影响
基质含水量不仅影响微生物的生长,还影响发酵系统中氧气的供应、气体交换等活动,关系到发酵的成败[20]。不同含水量对发酵豆粕中胰蛋白酶抑制剂含量的影响结果见图1。结果表明,当豆粕与水的比例在1∶0.9~1∶1.2 时,豆粕中胰蛋白酶抑制剂的含量最低,发酵效果较好。根据试验结果,并考虑到后期烘干成本,可选择1∶0.9作为发酵适宜的料水比。
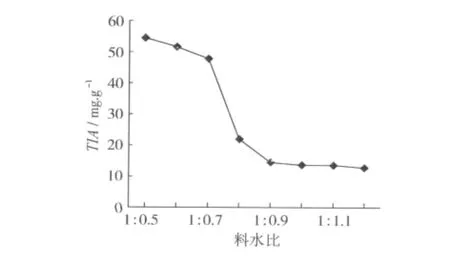
图1 料水比对发酵豆粕胰蛋白酶抑制剂含量的影响
2.3 起始温度对发酵豆粕中胰蛋白酶抑制剂含量的影响
温度直接影响微生物的生长,发酵的起始温度过低或过高均不利于微生物的生长繁殖,从而影响发酵效果。由图2可见,3种菌株发酵的起始温度在30℃时,豆粕中胰蛋白酶抑制剂的含量最低,因而适宜的发酵起始温度为30℃。
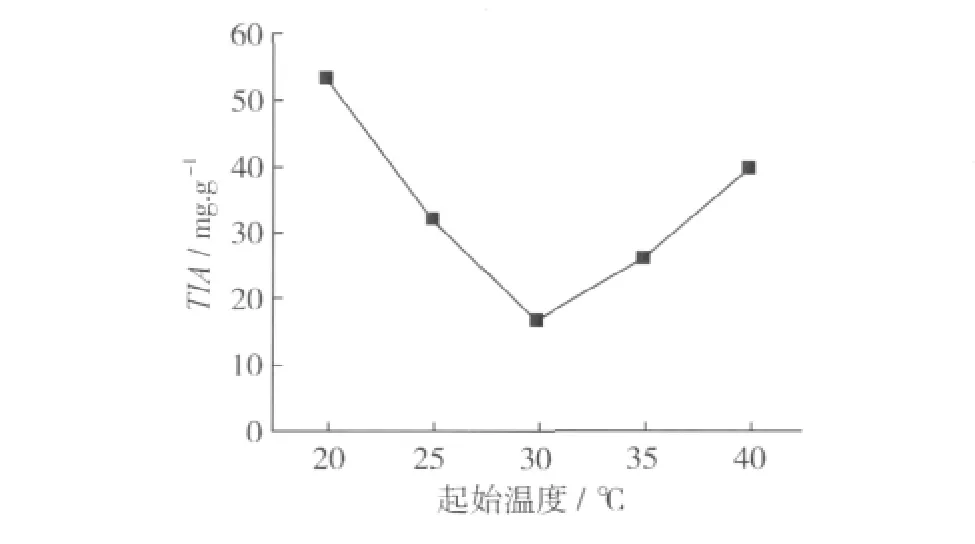
图2 发酵起始温度对豆粕中胰蛋白酶抑制剂含量的影响
2.4 发酵时间对豆粕中胰蛋白酶抑制剂含量的影响
发酵时间对豆粕中胰蛋白酶抑制剂含量的影响见图3。可见,随着发酵时间的延长,豆粕中胰蛋白酶抑制剂的含量显著降低,发酵时间72 h、84 h和96 h豆粕中胰蛋白酶抑制剂的含量最低。综合考虑生产效率和发酵成本,本试验的适宜发酵时间为72 h。
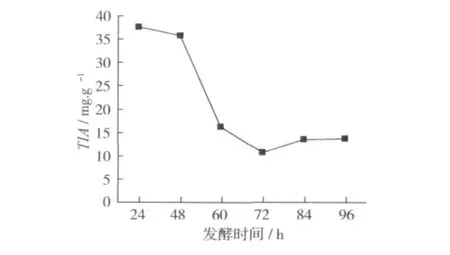
图3 不同发酵时间对豆粕这胰蛋白酶抑制剂含量的影响
2.5 初始pH对发酵豆粕中胰蛋白酶抑制剂含量的影响
初始pH对发酵豆粕中胰蛋白酶抑制剂含量的影响见图4。可以看出,当培养基的初始pH为7.0或者pH为自然(自来水)时,豆粕中胰蛋白酶抑制剂的含量最低,培养基的pH过高或过低都会影响微生物的正常发酵,导致豆粕中胰蛋白酶抑制剂的含量偏高。因此,培养基适宜的初始pH为7.0或者pH为自然(自来水)。考虑到操作的简便性,实际发酵时培养基的初始pH为自然(自来水)时比较适宜。
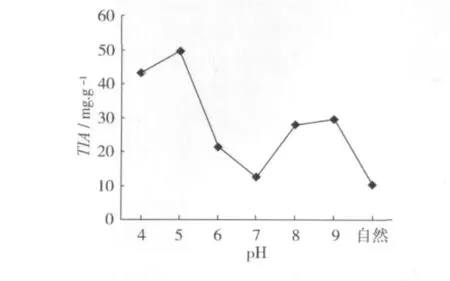
图4 初始pH对豆粕胰蛋白酶抑制剂抑制剂含量的影响
2.6 混合发酵对豆粕组成成分的影响
适宜发酵条件下,豆粕发酵前后抗营养因子和营养成分含量的变化见表3,氨基酸含量见表4。结果表明,发酵豆粕的粗蛋白质和粗脂肪含量显著提高,粗蛋白质含量比发酵前提高12.12%,粗脂肪含量提高11.68%,这与马文强等[8]的研究比较一致,可能是发酵过程中,豆粕中的碳源被发酵损耗致养分间的相对比例发生变化,同时豆粕中的胰蛋白酶抑制剂等抗营养因子被微生物降解去除,使粗蛋白质含量相对增加。氨基酸态氮是衡量发酵产品发酵程度的重要指标,发酵豆粕的氨基酸态氮含量是发酵前的10.87倍,说明发酵过程中微生物产生的蛋白酶将蛋白质水解为氨基酸、小分子肽类,导致氨基酸态氮含量大量增加。此外,在适宜条件下发酵的豆粕,胰蛋白酶抑制剂得到了有效去除,改善了豆粕的整体品质。
由表4可见,发酵前后豆粕氨基酸含量发生了显著变化,无论是必需氨基酸还是非必需氨基酸含量,发酵豆粕都明显高于非发酵豆粕。8种必需氨基酸总量发酵后比发酵前提高12.69%,其中对于畜禽比较重要的赖氨酸和蛋氨酸的含量,发酵后比发酵前分别提高12.31%和23.81%,而10种非必需氨基酸的总量发酵后比发酵前提高6.81%。这也与蔡国林等[21]和魏炳栋等[22]的研究结果一致。这可能是由于发酵过程中,微生物分泌的蛋白酶将豆粕的蛋白质分解成大量的游离氨基酸、肽和氨,加之微生物自身分泌的一些酶类,致使发酵产物中各种氨基酸含量显著增加。同时由于氨基酸含量的增加,也在一定程度上改善了发酵豆粕的适口性。
3 结论
3.1 综合以上试验结果,本试验条件下,采用多种菌株发酵豆粕,理想的发酵条件为:接种量枯草芽孢杆菌4%、酵母菌5%、乳酸菌2%,料水比1∶0.9,发酵的起始温度为30℃,发酵时间为72 h,培养基的初始pH为自然(自来水)。
3.2 豆粕发酵后可有效去除胰蛋白酶抑制剂。
3.3 豆粕发酵后蛋白质含量提高12.12%,而氨基酸态氮含量发酵后是发酵前的10.87倍。发酵豆粕中必需氨基酸和非必需氨基酸含量均显著提高,改善了豆粕品质。
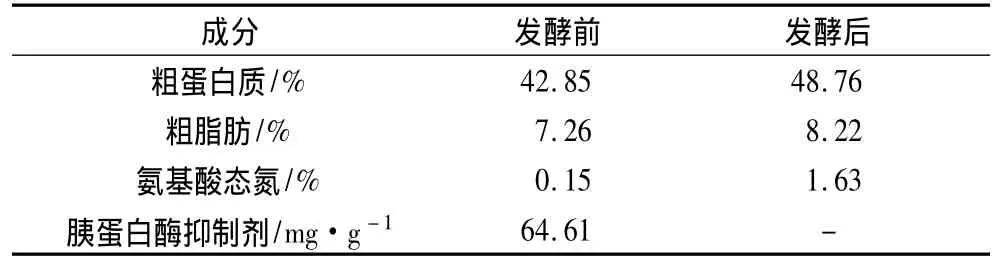
表3 豆粕发酵前后各种成分的比较
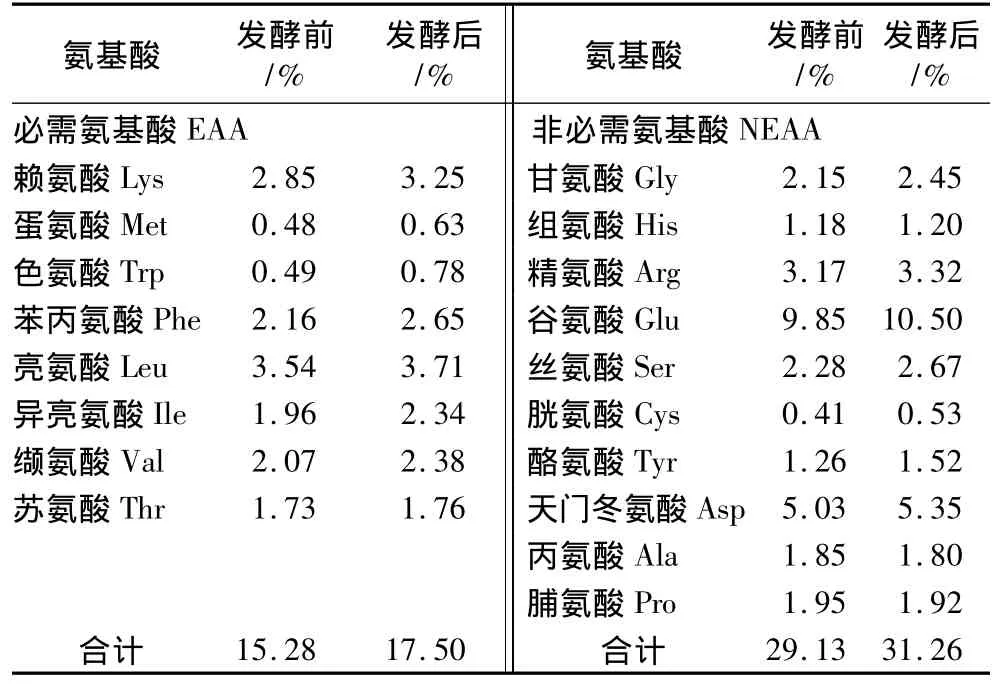
表4 豆粕发酵前后氨基酸含量的变化(干物质基础)
[1]王春林,陈喜斌,于炎湖,等.大豆中抗营养因子及其处理方法[J].饲料工业,2000,21(9):12 -14
[2]Huisman J.Antinutritional effects of legume seeds in piglets,rats and chickens[D].Waveningen State:Waveningen University,1990
[3]Barth C A,Lurnling B,Schmitz M,et al.Soybean trypsin inhibitors reduce absorption of exogenous and increase loss of endogenous protein in immature pigs[J].Journal of Nutrition,1993,123(12):2195 -2200
[4]Sessa D J,Haney J K,Nelsen T C.Inactivation of soybean trypsin inhibitors with ascorbic acid plus copper[J].Journal of agricultural and food chemistry,1990,38(7):1469 -1474
[5]Anderson R L.Effects of steaming on soybean proteins and trypsin inhibitors[J].Journal ofthe American Oil Chemists'Society,1992,69(12):1170 -1176
[6]肖玲,龚月生.热处理对豆粕品质的影响[J].粮食与饲料工业,2000(4):23-25
[7]曹钰,蔡国林,陆健.提高豆粕营养价值的研究进展[J].饲料与畜牧,2007(6):13-15
[8]马文强,冯杰,刘欣.微生物发酵豆粕营养特性研究[J].中国粮油学报,2008,23(1):121 -124
[9]李树宏,邝哲师,杨金波,等.发酵豆粕概述[J].饲料博览,2007(23):12-15
[10]Hong K J,Lee C H,Kim S W.Aspergillus oryae GB -107 fermentation improves nutritional quality of food soybean and feed soybean meals[J].Journal of Medical Food,2004,7(4):430-436
[11]朱曦,田慧云.混合发酵去除豆粕中抗营养因子最佳发酵条件的研究[J].养殖与饲料,2007(1):44-46
[12]惠明,孟可,田青,等.复合菌株固态发酵豆粕的研究[J].河南工业大学学报:自然科学版,2009,30(4):61-64
[13]吴胜华,李吕木,张邦辉,等.酵母菌单菌固态发酵豆粕的研究[J].中国粮油学报,2009,24(7):41 -44
[14]姚晓红,吴逸飞,汤江武,等.微生物混合发酵去除豆粕中胰蛋白酶抑制剂的研究[J].中国饲料,2005,(24):16-18
[15]李素芬,霍贵成,杨丽洁,等.黑龙江省主要大豆品种中胰蛋白酶抑制因子含量研究[J].中国饲料,2001(5):8-11
[16]陈美春,康明武,杨勇.酱油中氨基酸态氮测定方法的探讨[J].四川食品与发酵,2008,44(2):54-56
[17]张丽英.饲料分析及饲料质量检测技术[M].第3版.北京:中国农业大学出版社,2007
[18]付弘贇,李吕木,蔡海莹,等.菌种和发酵条件对发酵豆粕中抗营养因子的影响[J].畜牧与兽医,2009,41(6):32-35
[19]姚晓飞,叶璐,赵世敏.枯草芽孢杆菌的选育及其发酵豆粕的工艺条件研究[J].安徽农业科学,2010,38(16):8476-8478
[20]Kanekar P,Joshi N,Sarnaik S,et al.Effect of fermentation by lactic acid bacteria from soybean seeds on trypsin inhibitor(TI)activity[J].Food Microbiology,1992,9(3):245 -249
[21]蔡国林,杨旭,曹钰,等.微生物发酵对豆粕营养价值的影响[J].中国油脂,2008,33(10):21 -24
[22]魏炳栋,陈群,刘海燕,等.乳酸菌固态发酵对豆粕蛋白质含量、体外消化率及游离氨基酸含量的影响[J].饲料博览,2010(3):3-5.

