重组表达人载脂蛋白(a)羧基末端kringle结构域抑制新生血管
申 乐,陈保生,薛 红
(1.中国医学科学院北京协和医学院北京协和医院麻醉科,北京100730;2.中国医学科学院基础医学研究所北京协和医学院基础医学院医学分子生物学国家重点实验室生物化学与分子生物学系,北京100730)
载脂蛋白(a)[Apolipoprotein(a),Apo(a)]是脂蛋白(a)[lipoprotein(a),Lp(a)]重要组成部分,其结构中存在多个高度重复的kringleⅣ结构域与1个kringleⅤ结构域,分别与纤溶酶原的kringle 4结构域与kringle 5结构域同源[1]。很多kringle结构域蛋白质都具有抑制新生血管的能力,如纤溶酶原[2]、尿激酶型纤溶酶原激活物(u-PA)[3]、肝细胞生长因子/分散因子(HGF/SF)等[4]。对 Apo(a)的研究发现,重组表达kringleⅤ结构域与重组表达kringleⅣ9型-10型-kringleⅤ结构域均能抑制新生血管[5]。利用酿酒酵母重组表达的kringleⅤ结构域,可以通过抑制新生血管实现对肿瘤生长和转移的影响[6]。本研究选用毕赤酵母重组表达Apo(a)羧基末端kringleⅤ结构域(RHAKA)与kringleⅣ10型-kringleⅤ结构域(RHAKB),并验证其对新生血管的影响。
1 材料与方法
1.1 实验材料
酵母菌株:毕赤酵母X-33,甲醇利用型Mut+(Invitrogen公司)。细胞系:HUVEC:人脐静脉内皮细胞(human umbilical vein endothelial cells)Cascade;HCT 116:人结肠癌细胞,(中国医学科学院基础医学研究所细胞中心提供)。鸡胚:5日龄,三黄鸡金星102品种;中国农业科学院畜牧研究所养鸡场孵化室。毕赤酵母X-33分别使用甘油复合物缓冲培养基(BMGY,Invitrogen公司)与甲醇复合物缓冲培养基(BMMY,Invitrogen公司)进行毕赤酵母的早期扩增与后期甲醇诱导重组蛋白质表达。HUVEC体外培养选用Medium 200 PRF培养基(Cascade),37℃,5%CO2的加湿培养箱。HCT 116体外培养选用高糖DMEM(HyClone)含10%新生牛血清(PAA)培养基,37℃,5%CO2的加湿培养箱。
重组质粒构建:pPICZαA(Invitrogen公司)、Pyrobest DNA聚合酶(TaKaRa)、EcoRⅠ限制性内切酶(MBI)、XbaⅠ限制性内切酶(TaKaRa)。其他主要试剂盒:His·Bind Kits(Novagen)、BCATM蛋白质定量试剂盒(Pierce公司)、反相-高效液相色谱(RPHPLC)Waters 600E System Controller(Waters)、μBondapakTMC18 3.9 mm 300 mm层析柱(Waters)、巯基定量分析试剂盒(Molecular Probes)、CellTiter 96® AQueous One Solution细胞增殖实验试剂盒(Promega公司)。
1.2 重组质粒构建与转染
以人Apo(a)基因cDNA(NM_005577)为模板利用Pyrobest DNA聚合酶进行聚合酶链反应(PCR)。分别设计用于扩增RHAKA与RHAKB的引物(表1),上游引物加入EcoRⅠ酶切位点,下游引物加入XbaⅠ酶切位点。PCR产物经纯化后及EcoRⅠ与XbaⅠ的双酶切后,克隆入pPICZαA以构建毕赤酵母重组表达质粒。重组质粒经DNA测序确认后,被线性化并转染到毕赤酵母X-33(Invitrogen公司)。
1.3 重组蛋白质的表达、纯化与鉴定
毕赤酵母X-33经过扩增与甲醇诱导后分泌表达重组蛋白质。利用硫酸铵沉淀法浓缩收集毕赤酵母培养基中的RHAKs。沉淀物溶于少量1×结合缓冲液,并用1×结合缓冲液透析多次以去除残余的硫酸铵。进而利用His·Bind Resin柱通过His·Tag亲和层析纯化重组蛋白质。纯化后的蛋白质利用BCA® 蛋白质定量试剂盒进行定量分析。
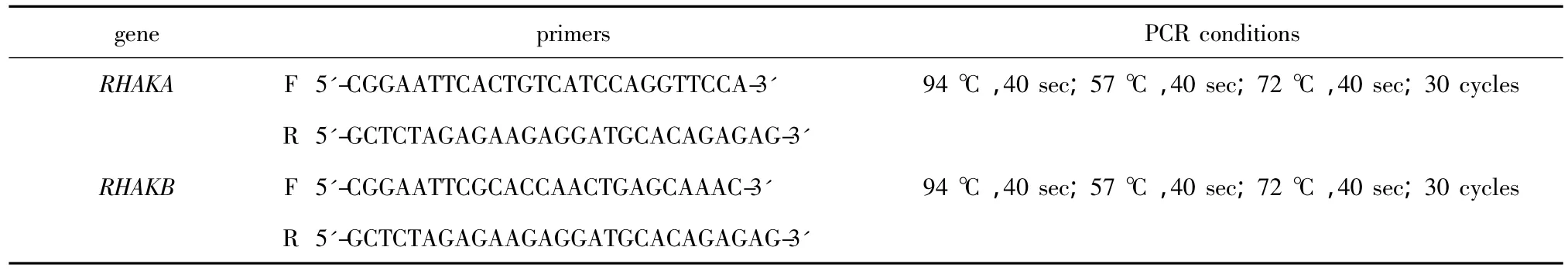
表1 RHAKs扩增引物与PCR条件Table 1 PCR primers and conditions of RHAKs
重组蛋白质样品溶于0.1%三氟乙酸,利用水-乙腈梯度在45 min内进行RP-HPLC,监测215 nm处的紫外吸光度变化。分别利用还原型与非还原型SDS-PAGE[是否含有二巯基苏糖醇(DTT)]比较二硫键形成情况对蛋白质电泳的影响。利用巯基定量分析试剂盒检测分析RHAKs中是否存在游离巯基。利用NetNGlyc 1.0数据库与NetOGlyc 3.1数据库预测分析RHAKs中的糖基化位点。利用过碘酸-Schiff试剂(PAS)染色明确RHAKs的糖基化。
1.4 细胞增殖抑制实验
利用CellTiter 96® AQueous One Solution细胞增殖实验试剂盒检测HUVEC与HCT 116的增殖情况。将约5 000个内皮细胞或肿瘤细胞接种至96孔板的每个孔中,加入含有不同浓度RHAKs的细胞培养基,继续培养60 h后每孔加入20 μL CellTiter 96®AQueous One Solution试剂,孵育1~4 h后分别读取490 nm与655 nm下的吸光度值。计算各孔的Adual(Adual=A490-A655),进而计算并比较各实验孔与对照孔的比值之间的差异。
1.5 鸡胚绒毛尿囊膜(CAM)实验
制备0.1、1和10 μg 3种剂量的RHAKs甲基纤维素药片。鸡胚孵育第6天将药膜放置在CAM中央,继续孵育48 h。如果某个可见有大血管穿过的区域出现了一个直径大于或等于3 mm的无血管区,则该区域即被视为阳性结果。通过出现阳性反应的CAM例数不同来反映RHAKs对新生血管的影响。
1.6 统计学分析
2 结果
2.1 RHAKs的表达与纯化
RHAKA与RHAKB分别包含123个氨基酸残基与223个氨基酸残基,其中都包含一个c-myc表位与一个His·Tag。用His·Tag亲和层析后,RPHPLC证实 RHAKs的纯度达 90%以上(图1)。RHAKs分泌表达后,其分泌信号肽因子被剪切,其中RHAKB氨基末端的6个氨基酸残基依次为:谷氨酸、苯丙氨酸、丙氨酸、脯氨酸、苏氨酸与谷氨酸,这与其氨基末端测序结果一致。相同的培养条件与诱导表达时间下,RHAKA产量约为15 mg/L,RHAKB产量约为5 mg/L。
2.2 RHAKs的翻译后修饰
SDS-PAGE结果提示RHAKs未形成多聚体结构,而非还原型RHAKs较还原型具有更快的电泳迁移率(图2)。RHAKA与RHAKB中不存在游离巯基,因此RHAKs的半胱氨酸均参与形成了分子内二硫键。
经过预测分析RHAKs中包含多个O-糖基化位点与N-糖基化位点(图3A)。RHAKA与RHAKB均可被PAS试剂染色为淡紫红色,由于RHAKB的糖基化位点多于RHAKA,故而其PAS试剂染色较深(图3B)。
2.3 RHAKs对内皮细胞及肿瘤细胞体外增殖的影响
RHAKA与RHAKB均可抑制HUVECs的增殖,但对HCT 116的增殖却无影响。RHAKs对HUVEC增殖的抑制效应基本呈现剂量依赖关系,在一些较高浓度作用下会出现显著的抑制效应,但RHAKA与RHAKB二者的抑制效应之间没有显著差异(图4)。
2.4 RHAKs抑制CAM的新生血管
RHAKA与RHAKB对CAM的血管生长具有明显的抑制作用。随着RHAKs的剂量增加,对CAM新生血管的抑制也越明显。RHAKs各剂量组均与对照组存在显著性差异(P<0.05)。相同浓度下,RHAKA与RHAKB对CAM新生血管的抑制效应无显著性差异(图5)。
3 讨论

图3 RHAKs的糖基化位点预测与PAS染色Fig 3 Glycosylation sites prediction and PAS staining of RHAKs
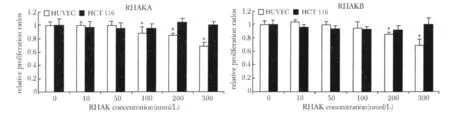
图4 RHAKs对体外培养内皮细胞与肿瘤细胞增殖的影响Fig 4 Influence of RHAKs on in vitro endothelial and carcinoma cell proliferation

图5 RHAKs抑制CAM的新生血管Fig 5 RHAKs inhibited CAM angiogenesis
利用毕赤酵母分泌表达RHAKs可以近乎天然的形式高效大量地制备重组蛋白质。本研究前期利用E.coli重组表达kringle结构域,均以包涵体的形式表达。通过分析蛋白质结构及翻译后修饰特点发现,人Apo(a)中糖基数量约占其总分子质量的28%,因此,糖基化的RHAKs分子质量应约为其氨基酸残基分子质量的1.39倍。选择毕赤酵母作为表达宿主,其优势也主要在于可以分泌表达重组蛋白质并完成其翻译后的糖基化修饰。估算糖基化RHAKA的分子质量约为19 ku,糖基化RHAKB的分子质量约为35 ku,这也与其在还原型SDS-PAGE中的电泳迁移率吻合(图2)。
血管生长是一个由多个步骤组成的连续变化的过程[7]。多数关于新生血管的调控研究都是针对内皮细胞的增殖与迁移展开的。研究证实,纤溶酶原中的kringle 1-4具有明显的抑制新生血管的能力[2],而其 kringle 5 抑制新生血管的能力更强[8]。人Apo(a)的kringleⅣ10型结构域与kringleⅤ结构域分别与纤溶酶原的kringle 4和kringle 5具有89%与91%同源性,因此也表现出了类似的抑制新生血管的能力。
本研究并未发现RHAKB较RHAKA具有更强的抑制新生血管的能力,说明kringleⅤ结构域是Apo(a)中发挥抑制新生血管的关键因素。RHAKs对肿瘤细胞的体外增殖没有直接的抑制效应,因此其对体内肿瘤生长及转移的抑制效果主要是通过抑制新生血管而间接发挥作用。
综上所述,本研究证实毕赤酵母是一种高效表达重组kringle结构域蛋白质的合适宿主。重组表达人Apo(a)羧基末端kringleⅣ10型、kringleⅤ结构域可以显著抑制新生血管,其中kringleⅤ型结构域更为关键。
[1]McLean JW,Tomlinson JE,Kuang WJ,et al.cDNA sequence of human apolipoprotein(a)is homologous to plasminogen[J].Nature,1987,330:132-137.
[2]Lin YL,Tsai MJ,Lo MJ,et al.Evaluation of the antiangiogenic effect of Kringle 1-5 in a rat glioma model[J].Neurosurgery,2012,70:479-489.
[3]Kim BM,Lee DH,Choi HJ,et al.The recombinant kringle domain of urokinase plasminogen activator inhibits VEGF165-induced angiogenesis of HUVECs by suppressing VEGFR2 dimerization and subsequent signal transduction[J].IUBMB Life,2012,64:259-265.
[4]Lu Q,Zhang L,Shen X,et al.A novel and effective human hepatocyte growth factor kringle 1 domain inhibits ocular neovascularization [J].Exp Eye Res,2012,105:15-20.
[5]Yu HK,Ahn JH,Lee HJ,et al.Expression of human apolipoprotein(a)kringles in colon cancer cells suppresses angiogenesis-dependent tumor growth and peritoneal dissemination[J].J Gene Med,2005,7:39-49.
[6]Lee HJ,Yu HK,Papadopoulos JN,et al.Targeted antivascular therapy with the apolipoprotein(a)kringleⅤ,rhLK8,inhibits the growth and metastasis of human prostate cancer in an orthotopic nude mouse model[J].Neoplasia,2012,14:335-343.
[7]Ferrara N,Kerbel RS.Angiogenesis as a therapeutic target[J].Nature,2005,438:967 -974.
[8] Cai WB,Zhang Y,Cheng R,et al.Dual Inhibition of Plasminogen Kringle 5 on Angiogenesis and Chemotaxis Suppresses Tumor Metastasis by Targeting HIF-1α Pathway[J].PLoS One,2012,7:e53152.doi:10.1371/journal.pone.0053152.

