Kir4.1和AQP4基因多态性与颞叶癫痫遗传易感性的关系
牛凤鹤,林 华,李景云,朱席琳,伍晓盼,刘 英*
(1.中国医学科学院基础医学研究所北京协和医学院基础学院医学分子生物学国家重点实验室,北京100005;2.首都医科大学宣武医院神经内科,北京100053)
癫痫是一种最常见的中枢神经系统疾病,由脑部神经元的异常放电引起。颞叶癫痫(temporal lobe epilepsy,TLE)是成人局灶性癫痫中最常见的一种,其发生和发展受到遗传和环境因素共同作用的影响[1]。钾离子通道参与调节细胞膜静息电位及动作电位的复极化过程,决定动作电位的发放频率和幅度,阻断或下调钾通道可增加神经元的兴奋性。星形胶质细胞的内向钾离子通道(inwardly rectifying potassium ion,Kir)在维持神经元内环境K+稳态中具有重要的作用,正常生理情况下,Kir通道在细胞外K+浓度升高时开放,K+内流,缓冲细胞外过度的钾负荷,当此平衡失调时,细胞外局部K+浓度大幅升高,K+的缓冲作用受损,引起癫痫的发作。Kir4.1为Kir的一员,在星形胶质细胞中高表达,参与调节钾离子的平衡[2]。药物难治性TLE患者的数据显示,Kir的表达、定位和功能都发生一定程度的变化,尤其是 Kir4.1[3-4]。在化学诱导癫痫模型中,AQP4敲除鼠发生抽搐的频率和程度要明显低于野生型对照鼠[5]。这些都表明AQP4和Kir4.1与TLE的发生、发展密切相关。目前在中国人群中尚未有这两个基因多态性与TLE易感性的研究。本研究旨在探讨Kir4.1和AQP4多态性在中国汉族人群中与TLE遗传易感性的关系。
1 材料与方法
1.1 研究对象
本研究由两组受试者组成,TLE患者(病例组)和非癫痫对照受试者(对照组)。TLE患者为2004年5月—2012年8月于首都医科大学宣武医院神经内科就诊的患者,非癫痫对照受试者为2009年12月—2011年9月于北京协和医院健康体检人群。TLE受试者的诊断标准根据1989年国际抗癫痫联盟提出的癫痫综合征的分类。本研究已获得受试者的知情同意和中国医学科学院基础医学研究所北京协和医学院基础学院伦理审查委员会的审查同意。
1.2 研究方法
1.2.1 样本收集与DNA的提取:采集病例组和对照组受试者的外周静脉血5 mL于已装入乙二胺四乙酸(EDTA)抗凝管内-80℃保存。采用北京英瑞科技有限公司血液基因组DNA提取试剂盒提取基因组DNA。
1.2.2 SNPs的选择与分型:从UCSC(http://genome.ucsc.edu/)数据库获得 Kir4.1 基因、AQP4 基因所在染色体位置及基因结构信息并下载基因5'UTR上游2 000 bp至3'UTR下游1 000 bp的基因序列。随机选择24个TLE受试者和24个非癫痫对照受试者,对基因潜在的功能区域(包括启动子区,5'非翻译区,3'编码序列,3'非翻译区,外显子与内含子的交界区)进行测序,共检测到位于Kir4.1基因上的16个和位于AQP4基因上的12个SNPs位点,对其进行基因连锁分析并选择劣势等位基因频率大于20%的SNP位点(rs3795339位点除外),筛选的SNPs位点信息见表1。合成引物和探针(上海生工生物工程有限公司)进行TaqMan分型。
1.3 统计学分析
应用χ2拟合度分析来检测SNPs位点是否符合HWE。应用χ2检验比较病例组和对照组等位基因和基因型的频率。应用在线软件SHEsis分析连锁不平衡和单倍型情况[6]。使用EPI6.0软件计算统计学效力。
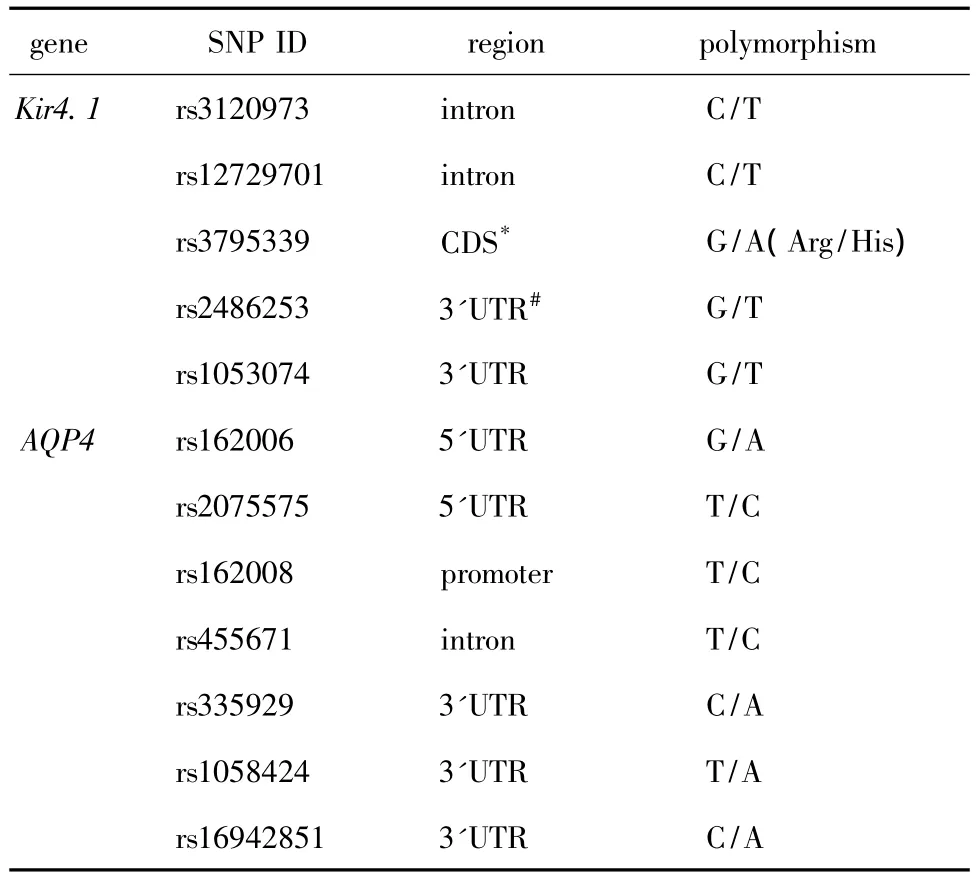
表1 候选基因SNPs位点相关信息Table 1 Information on single nucleotide polymorphisms analyzed in this study
2 结果
2.1 TLE病例组与非癫痫对照组的人口学资料
所有受试者均为中国汉族,病例组和对照组在年龄和性别上匹配。病例组中,伴海马硬化113例,无海马硬化325例;41例伴热性惊厥,397例无热性惊厥(表2)。
2.2 Kir4.1和AQP4基因多态性与TLE易感性的关系
病例组和对照组中SNP多态性位点的基因型和等位基因的频率分布情况见表3,基因频率分布均符合HWE,多态性位点与TLE的发生风险不存在相关性。

表2 TLE患者与非癫痫对照组人口学资料Table 2 Demographic and clinical variables in TLE patients and non-epileptic controls
2.3 Kir4.1和AQP4单倍型以及分层分析SNPs与TLE易感性的关系
单倍型与TLE之间不存在相关性。结合临床表型分层分析,TLE伴海马硬化组与TLE非海马硬化组和非癫痫对照组均无差异。TLE伴热性惊厥组与TLE非热性惊厥组和非癫痫对照组均无相关性。
3 讨论
颞叶癫痫又称药物难治性癫痫,目前所有抗癫痫药物主要集中作用于离子通道上[7]。已证实的星形胶质细胞在癫痫脑组织中所发挥的功能提示星形胶质细胞可能能够作为一个新的治疗靶点[8]。
本研究选择Kir4.1和AQP4这两个在星形胶质细胞中高表达的基因为候选基因,并未发现病例组和对照组的差异。而在欧洲和挪威人群中Kir4.1基因多态性与TLE易感性研究的报道指出,错义变异(R271C,rs1130183)与癫痫发作的易感性相关[9-10]。这种差异的存在可能由以下因素所致。第一,不同人群之间存在遗传异质性,本研究中中国汉族人群中两个常见的多态性位点rs3120973和rs3795339在欧洲人群中未有发现,而在欧洲人群中发现与易感性相关的位点rs1130183在中国汉族人群未有发现。rs3795339位点与rs1130183两个位点是毗邻的,两者分别将271位精氨酸变为组氨酸和半胱氨酸。此外,R271C多态性的功能学研究并未发现在通道结构和功能上的变化[11]。第二,TLE是一种复杂的多基因疾病,受到众多易感基因和复杂环境因素的影响,基因-基因交互作用或不同的基因产物之间的干扰可以弥补单一基因座变异所导致的不足。总体来说,这些因素都可能会导致不同的结果。
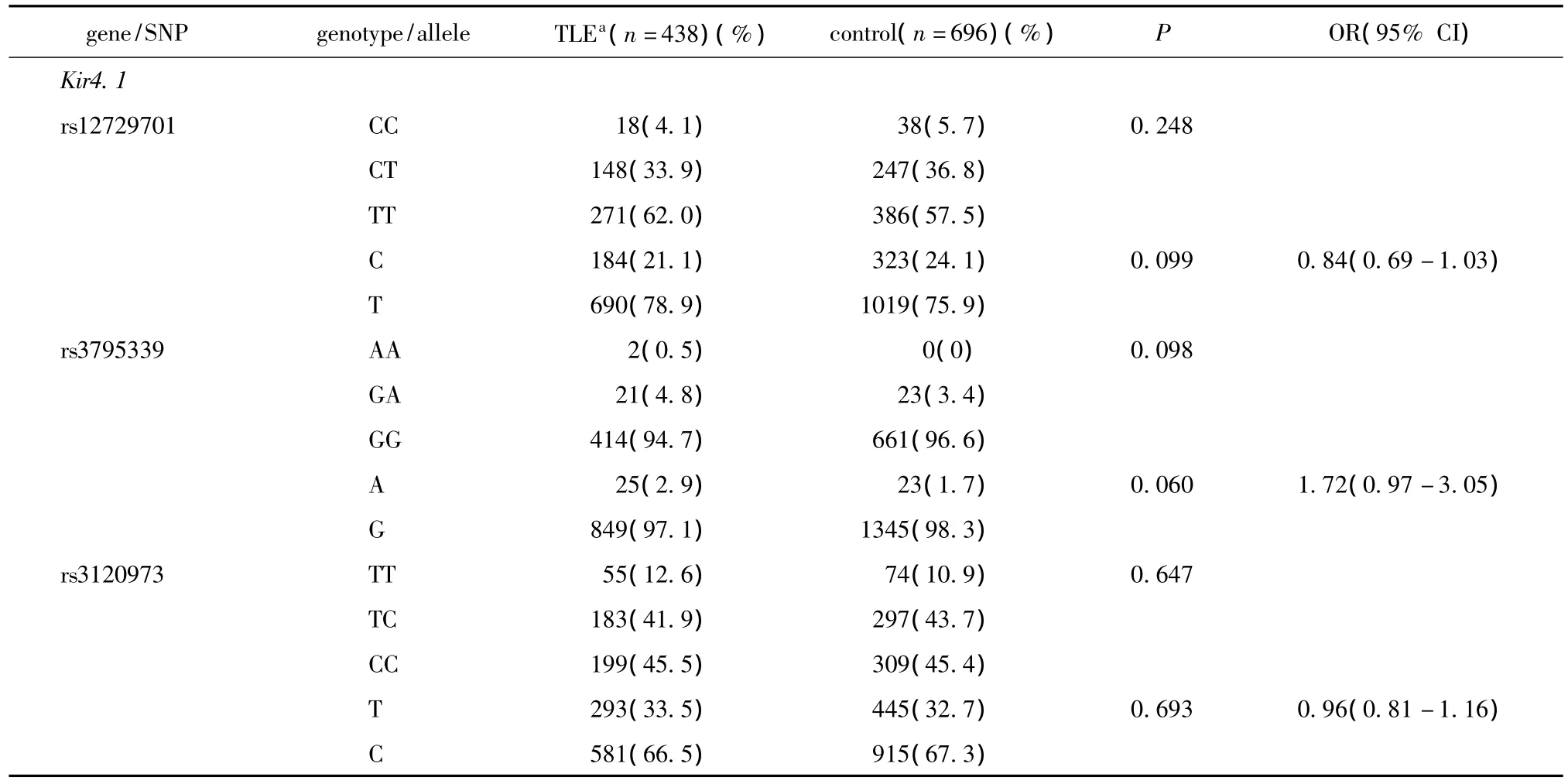
表3 Kir4.1和AQP4基因多态性在病例组对照组中的分布比较Table 3 Comparison of genotype distribution and allelic frequencies of SNPs in Kir4.1 and AQP4 between TLE patients and non-epileptic controls
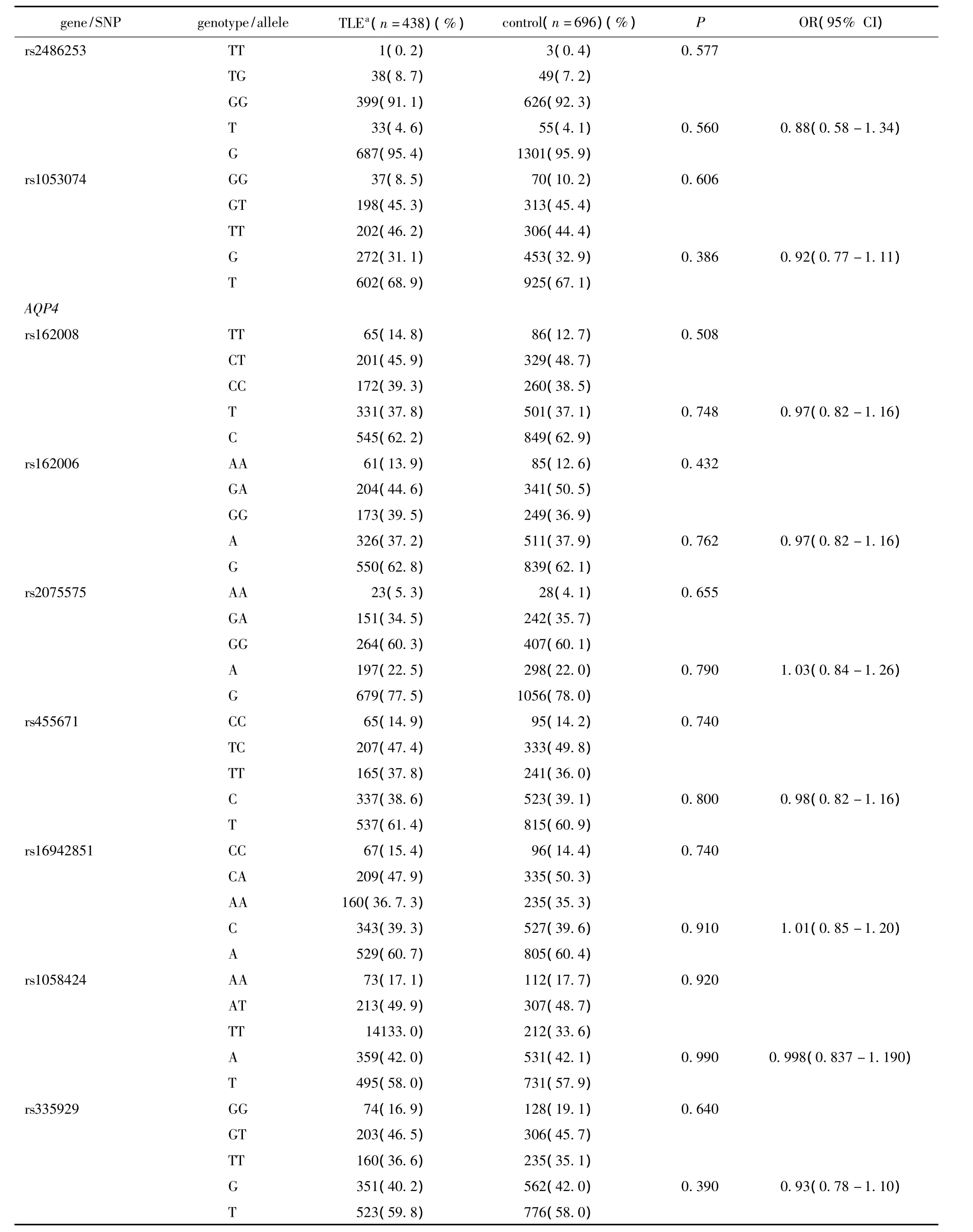
续表3
本研究仍然存在一定的局限性,一方面,尽管制定了严格的入组标准并有专业医师的诊断,但限于目前的临床现状仍有一定的不足。对于TLE的发展应对患者接触到的有害环境因素如脑外伤、脑炎等进行综合评估,然而,由于患者的记忆偏差等限制,完整的资料信息无法获得,在以后的研究中这些条件都必须加以克服。另一方面,本研究中所选择的SNP位点均位于潜在的功能区域,但可能也存在一些SNPs位点被遗漏。
本研究表明,Kir4.1和AQP4基因多态性与颞叶癫痫在中国汉族人群中并无相关性。但是,这两个基因产物与其他蛋白之间通过相互作用来影响癫痫发生的可能性不能被排除,仍需要进一步的研究。
[1]Engel JR.,Wiebe S,French J,et al.Practice parameter:temporal lobe and localized neocortical resections for epilepsy:report of the Quality Standards Subcommittee of the American Academy of Neurology,in association with the A-merican Epilepsy Society and the American Association of Neurological Surgeons[J].Neurology,2003,60:538 -547.
[2]Takumi T,Ishii T,Horio Y,et al.A novel ATP-dependent inward rectifier potassium channel expressed predominantly in glial cells[J].J Biol Chem,1995,270:16339 -16346.
[3]Steinhauser C,Seifert G,Bedner P.Astrocyte dysfunction in temporal lobe epilepsy:K+channels and gap junction coupling[J].Glia,2012,60:1192 -1202.
[4]Haj-yasein NN,Jensen V,Vindedal GF,et al.Evidence that compromised K+spatial buffering contributes to the epileptogenic effect of mutations in the human Kir4.1 gene(KCNJ10)[J].Glia,2011,59:1635 -1642.
[5]Binder DK,Nagelhus EA,Ottersen OP.Aquaporin-4 and epilepsy[J].Glia,2012,60:1203 -1214.
[6]Shi YY,He L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].Cell Res,2005,15:97 -98.
[7]Rogawski MA,Loscher W.The neurobiology of antiepileptic drugs[J].Nat Rev Neurosci,2004,5:553 -564.
[8]Losi G,Cammarota M,Carmignoto G.The role of astroglia in the epileptic brain[J].Front Pharmacol,2012,3:132.doi:103389/fphar.2012.00132.
[9]Buono RJ,Lohoff FW,Sander T,et al.Association between variation in the human KCNJ10 potassium ion channel gene and seizure susceptibility [J].Epilepsy Res,2004,58:175-183.
[10]Heuser K,Nagelhus EA,Tauboll E,et al.Variants of the genes encoding AQP4 and Kir4.1 are associated with subgroups of patients with temporal lobe epilepsy[J].Epilepsy Res,2010,88:55 -64.
[11]Shang L,Lucchese CJ,Haider S,et al.Functional characterisation of missense variations in the Kir4.1 potassium channel(KCNJ10)associated with seizure susceptibility[J].Brain Res Mol Brain Res,2005,139:178 -183.

