藏北高寒草甸植物群落对土壤线虫群落功能结构的影响
薛会英,胡 锋,罗大庆
(1.南京农业大学资源与环境科学学院,南京210095;2.西藏大学农牧学院,林芝860000)
土壤线虫是土壤动物中的优势类群,在草地生态系统中往往被看作是主要的消费者,与草地生产力密切相关[1]。土壤线虫有多种食性,其功能(营养)结构是土壤物质循环和能量流动的重要决定因素之一,同时也能够提供土壤腐屑食物网机能方面的信息[2],因此,关于土壤线虫群落功能结构的研究受到重视[3-12]。
藏北地区地处青藏高原腹地,气候干寒,是全球气候变化的敏感地带,其草地面积约34.2×104km2[13],是藏北地区面积最大、最重要的生态系统,其间广泛分布的高寒草甸类草地具有典型的区域代表性。
本文研究了藏北高寒草甸不同植物群落下不同植物群落下土壤线虫群落的营养类群组成、c-p类群及功能结构特征,以及营养类群、c-p类群与土壤性质之间的关系,目的是了解高寒环境下植被对土壤线虫群落营养结构的影响,有助于进一步理解植物如何通过影响土壤生物来调控土壤生态系统过程,同时也可为高寒草甸生态系统管理提供一定的借鉴作用。
1 样地概况
藏北高寒草原呈高原水平地带性分布(海拔4300—5200 m),高原大陆性气候特征极为明显,暖季短且温凉,冷季长且寒冷,年平均气温-2.8—1.6℃,全年无绝对无霜期,最冷月(1月)、最热月(7月)平均气温分别为-10—-12℃和7—12℃,≥0℃年积温800—1100℃;年降水量100—300 mm,年蒸发量1500—2300 mm,干燥度6.7—20[14]。
研究样区设在那曲地区那曲县德吉乡达嘎村,地理位置31°31'38″—31°32'02N,92°04'03″—92°04'16″E,海拔4534—4567 m。此区域年平均气温-0.9℃。年降水量400 mm以上,年蒸发量1810.6 mm,年相对湿度51%,8级以上大风日可达92 d。牧草生长期170 d以上。土壤类型为高山草甸土,季节性冻土。地被植物主要优势种及亚优势种有藏北嵩草(Kobresia littledalei)、高山嵩草(K.pygmaea)、二裂委陵菜(Potentilla bifurca)、矮火绒草(Leontopodium nanum)、乳白香青(Anaphallis lactea)、垫状蚤缀(Arenaria polytrcnoides)、钉柱委陵菜(P.saundersiana)、垂穗披碱草(Elymus nutans)、草地早熟禾(Poa pratensis)和紫羊茅(Festuca rubra)等。
按照植被主要建群种的不同,在研究区域选取有代表性的3种植物群落作为样区,分别是委陵菜(Potentilla)为主要建群种的高寒草甸样地(委陵菜群落样地)、高山嵩草(Kobresia pygmaea)为主要建群种的高寒草甸样地(高山嵩草群落样地)及藏北嵩草(Kobresia littledalei)为主要建群种的高寒草甸样地(藏北嵩草群落样地),详情见表1。以高山嵩草为主要建群种的高寒草甸是西藏高寒草甸类草地中分布最广,面积最大,最是具有代表性的一类草地类型,草层高度一般3—5cm,盖度达80%以上。由于过牧、鼠害及气候变化等原因,高山嵩草高寒草甸植被退化为以委陵菜为优势种的高寒草甸。藏北嵩草为寒中生多年生草本植物,草甸草层高度20—30cm,盖度可达90%以上。
3个样地处于同一地理单元,地理、气候及地形条件相对一致,为研究植被与土壤线虫之间的关系提供了较好的平台。
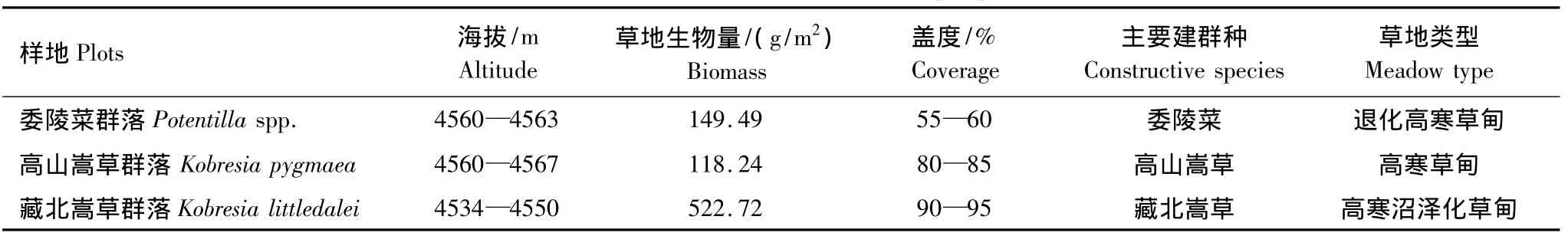
表1 实验样地基本情况Table 1 Basic conditions of the sample plots
2 研究方法
2.1 样品采集与处理
2011年5 月(春季,草地返青期)、8月(夏季,草类盛长期)、2011年11月(秋冬季,枯草期),对研究样地按照随机布点方式进行采样,每个样地布设4个采样点;在每个样点去除地被物后,沿土壤剖面采集0—5,5—10,10—15,15—20,20—25,25—30cm土层原状土样,装入聚乙烯袋中贴上标签后带回实验室。
土壤化学性质测定:pH,电位法;土壤含水量,烘干法;电导率,电导率仪法[15]。
草地生物量的测定方法:在每个样区选取3个面积为1m×1m有代表性的样方,采用目测法观察植物群落总盖度;在每个样方里随机选取3个0.25m×0.25m的小样方,齐地面剪下所有的植株地上部分,然后放入纸袋中封好,称取鲜重,带回实验室后在85℃烘箱内烘干至恒重,计算生物量(精确到0.01g)。测定时间选择在2011年8月初,植物旺盛生长期。
2.2 土壤线虫的分离与鉴定
每个土壤样品称取30.0 g,用浅盘法室温分离48 h[16];用0.045mm的两个套筛收集线虫,用自来水将留在网筛上的线虫冲洗入烧杯,按体积比1∶1加入10%甲醛溶液固定。解剖镜下计数,线虫个体数量转换成条/100g干土。制片。依据《DE NEMATODEN VAN NEDERLAND》[17]、《Dorylaimida—Free-living,Predaceous and Plant-parasitic Nematodes》[18]、《中国土壤动物检索图鉴》[19]、《植物线虫分类学》[20]和《中国淡水和土壤线虫的研究》[21],利用体视显微镜按科、属对线虫进行分类;各类群数量优势度的划分:个体数占总捕获量10%以上者为优势类群(+++),个体数占总捕获量1%—10%为常见类群(++),个体数占总捕获量1%以下为稀有类群(+)[22-24]。
土壤线虫群落结构分析采用以下指标:
(1)成熟度指数(Maturity Index,MI,不包括植物寄生类线虫)[4]MI=∑c(i)×pi
(2)植物寄生线虫指数(Plant Parasite Index,PPI)[4]PPI=∑c(i)×pi
(3)PPI/MI[4]
式中,c(i)为非植物寄生性(植物寄生性)土壤线虫第i类群colonizer-persister值;n为非植物寄生性(植物寄生性)土壤线虫类群数;Pi为土壤线虫群落非植物寄生性(植物寄生性)土壤线虫第i类群的个体数占群落总个体数的比例。
(4)F/B[25]F/B=Fu/Ba
(5)线虫通路比值(Nematode Chanel Ratio,NCR)[26]NCR=Ba/(Ba+Fu)式中,Ba和Fu分别代表食细菌类线虫和食真菌类线虫的数量。
用SPSS13.0软件进行ANOVA分析和线性相关分析,用Excel进行绘图。
3 结果与分析
3.1 土壤线虫群落组成
于草地返青期、盛长期、枯草期3个时期共分离得到土壤线虫33038条,个体密度平均847条/100g干土,分属于2纲6目51科93属(其中有4个属仅鉴定到科),基本情况见表2及图1。

表2 西藏北部高寒草甸不同植物群落下土壤线虫群落组成及营养类群c-p值Table 2 Compositions of nematode communities composition and c-p values of trophic groups in the three alpine meadows different in plant community in North Tibet

续表

续表
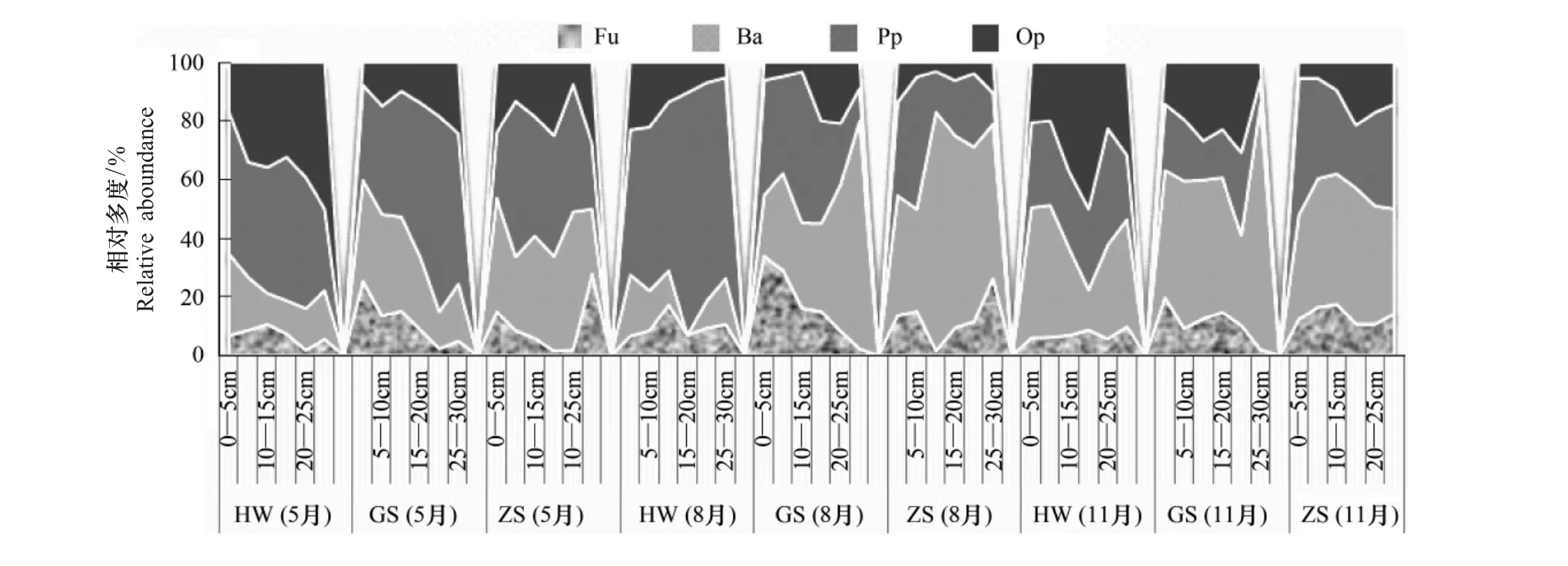
图1 高寒草甸不同植物群落下土壤线虫营养类群相对多度在土壤中的垂直分布和季节变化Fig.1 Vertical distrbution and seasonal change of relative aboundance of soil nematode trophic groups in the three alpine meadows different in plant community
委陵菜群落3个时期共分离得到土壤线虫74属7800条,个体密度平均536条/100g干土,其中,植食性线虫数量最多,占个体总数的41.91%;其次是杂食/捕食性线虫和食细菌性线虫,分别占个体总数的25.29%和25.25%;食真菌性线虫最少,仅占到了7.54%。Tylenchorhynchus和Helicotylenchus为优势属,Paratylenchus等21个属为常见属,Clarkus等51属为稀有属。
高山嵩草群落3个时期共分离得到土壤线虫72属18006条,个体密度平均1269条/100g干土,其中,食细菌性线虫数量最多,占个体总数的36.17%;植食性线虫次之,占到了32.60%;食真菌性线虫数量占个体总数的17.84%;而杂食/捕食性线虫仅占13.39%。Tylencholaimus和Tylenchorhynchus为优势属,Cephalobus等20个属为常见属,Rhabdolaimus等50属为稀有属。
藏北嵩草群落3个时期共分离得到土壤线虫65属7232条,个体密度平均735条/100g干土,其中,食细菌性线虫数量最多,占个体总数的42.82%;植食性线虫次之,占到了32.32%;杂食/捕食性线虫占13.35%;食真菌性线虫仅占11.51%。Cervidellus、Filenchus为优势属,Acrobeloides等18个属为常见属,Teratocephalus等48属为稀有属。
不同植物群落下的土壤线虫数量:委陵菜群落<藏北嵩草群落<高山蒿草群落,群落间差异显著(P<0.05)。植食性线虫和杂食/捕食性线虫的相对多度在不同植物群落间差异明显(P<0.05)。
土壤线虫群落的个体数量、密度、种类组成及营养类群组成,在不同植物群落下均存在一定差异,表明藏北高寒草甸土壤线虫群落受到植被的影响。
3.3 土壤线虫群落功能结构
3.3.1 土壤线虫群落的c-p类群结构
图2—图4表明,不同植物群落、不同生长时期的土壤线虫主要分布在0—15cm土层,尤以0—5cm层为最多。在获得的所有线虫中,cp1—cp5类群个体数量分别占线虫总数的1.2%,58.2%,15.0%,16.3%及9.7%。不同时期不同植物群落,线虫各c-p类群的分布情况随土壤深度增加而变化的趋势不同。
cp1的个体数量很少,仅在委陵菜群落返青期的10—30cm土层、枯草期的20—30cm土层,及高山嵩草群落盛长期的20—30cm土层、枯草期5—15cm、25—30cm土层中有出现;藏北嵩草群落在返青期的5—10cm土层及盛长期的0—5cm土层偶有出现。个体数量以高山嵩草群落最多,委陵菜群落次之,藏北嵩草群落最少。
在各植物群落的不同生长时期,cp2类群的个体数量均最高,其总体变化趋势是从地表往下随土壤深度增加个体数量减少。高山嵩草群落的cp2类群线虫个体数量最多,委陵菜群落次之,藏北嵩草群落最少。
委陵菜群落的cp3类群的个体数量最多,藏北嵩草群落次之,高山嵩草群落最少;委陵菜群落的cp3类群线虫在返青期和盛长期主要出现在5—10cm土层,在枯草期则出现下移,主要出现在20cm以下;在高山嵩草群落的返青期和盛长期主要出现在20—25cm土层,在枯草期则主要出现在0—10cm土层;藏北嵩草群落于返青期主要出现在5—20cm,盛长期主要出现在15—25cm土层,而枯草期则主要出现在10—15cm土层。
几乎在所有的调查时期和植物群落土样中cp4类群均有出现;总体变化趋势与cp2相似,也是从地表往下随土壤深度增加个体数量减少;此类群线虫个体数量以高山嵩草群落为最多,委陵菜群落次之,藏北嵩草群落最少。
cp5类群线虫的个体数量在委陵菜群落土样中最多,高山嵩草群落次之,藏北嵩草群落最少;委陵菜群落在返青期和枯草期的cp5类群均主要出现在10—20cm土层,而在盛长期则主要出现在5—10cm土层;高山嵩草群落的cp5类群在返青期主要出现在20—30cm土层,枯草期则主要出现在10—25cm土层;藏北嵩草群落的cp5类群总体来说是从地表往下随土壤深度增加个体数量减少,25—30cm土层未出现此类群线虫。
不同植物群落下,土壤线虫各c-p类群的数量、组成及垂直分布趋势发生一定分异,表明藏北高寒草甸土壤线虫群落的c-p类群组成受到了植被的影响。
3.3.2 不同植物群落下土壤线虫功能结构特征

图2 返青期高寒草甸3种植物群落下土壤线虫c-p类群的垂直分布Fig.2 Vertical distrbution of c-p groups in different plant communities of alpine meadows in reviving period

图3 盛长期高寒草甸3种植物群落下土壤线虫c-p类群的分布情况Fig.3 Vertical distrbution of c-p groups in different plant communities of alpine meadows in flourishing period
线虫功能结构特征指数见表3。总体来看,3种植物群落在不同生长季的MI均值大小排序:委陵菜群落>高山嵩草群落>藏北嵩草群落,方差分析结果显示,委陵菜群落的MI均值明显高于其它两种植物群落(P<0.01),高山嵩草群落和藏北嵩草群落间则表现出显著性差异(P<0.05);3种植物群落的不同土层间,MI值均未表现出明显差异(P>0.05)。
PPI的3个生长季均值大小顺序为:委陵菜群落>高山嵩草群落>藏北嵩草群落,与MI值的顺序一致,方差分析结果显示,委陵菜群落的PPI值显著大于其它两种植被类型(P<0.05),与藏北嵩草群落更是达到了极显著差异水平(P<0.01),高山嵩草群落与藏北嵩草群落间差异明显(P<0.05);对同种植物群落下不同土层间的PPI值进行比较,3种植物群落均无明显差异(P>0.05)
PPI/MI的不同时期均值大小顺序为:藏北嵩草群落>高山嵩草群落>委陵菜群落,方差分析结果显示,不同植物群落间及同种植物群落的不同土层间无显著性差异(P>0.05)。

图4 枯草期高寒草甸3种植物群落下土壤线虫c-p类群的分布情况Fig.4 Vertical distrbution of c-p groups in different plant communities of alpine meadows in Withering period
在采集的所有样本中,NCR值介于0.37—0.98,3个时期的均值大小顺序为:藏北嵩草群落>高山嵩草群落>委陵菜群落,与MI、PPI的顺序相反。总体来说,尽管3种植被类型的NCR值随土壤深度加大而变化的趋势不同,但基本都大于0.5,仅有委陵菜群落15—20cm土层小于0.5。

表3 高寒草甸不同植物群落下土壤线虫群落的营养结构特征指数Table 3 Indexes of soil nematode community nutrition structure in different plant communities of alpine meadows
3.3.3 土壤线虫营养类群及c-p类群与土壤性质的关系
对线虫个体数量与环境因子之间进行相关分析,结果表明:土壤线虫数量在盛长期与土壤含水量极显著正相关(r=0.349**),与pH极显著负相关(r=-0.528**),线虫数量生长时期均值与土壤pH、电导率显著相关(r=-0.485*,r=0.472*)。由于不同营养类群及各c-p类群对环境因子的响应不同,仅对线虫总数量进行分析难免存在局限性,因此,将3个生长时期不同营养类群及c-p类群线虫个体数量与土壤性质之间进行相关分析,结果如表4所示,以进一步探讨线虫与环境因子之间的关系。
返青期:4个营养类群及cp1—cp5类群与电导率之间均无显著相关性;植食性线虫个体数量与pH极显著负相关(P=0.001),pH与食细菌性线虫个体数量显著负相关(P=0.015),与食真菌性线虫个体数量极显著负相关(P=0.003);4个营养类群及cp1—cp4类群与含水量之间均无显著相关性,cp5类群个体数量与土壤含水量显著负相关(P=0.011);cp4类群个体数量与pH显著负相关(P=0.023),cp2类群与pH极显著负相关(P=0.001)。
盛长期:食真菌性线虫个体数量与土壤pH呈极显著负相关(P=0.006),土壤pH与食细菌性线虫和杂食/捕食性线虫的个体数量无显著相关性,与植食性线虫显著负相关(P=0.012);食真菌性线虫个体数量与电导率极显著相关(P=0.008),其它3个类群与电导率无显著相关;4个营养类群及cp1—cp5类群与含水量之间均无显著相关性。cp1—cp4类群与土壤电导率间均无显著相关性;cp5与pH间极显著负相关(P=0.005)。
枯草期:4个营养类群及cp1—cp5类群与电导率之间均无显著相关性;食真菌性线虫个体数量与土壤pH间显著负相关(P=0.047),其它3个类群及cp1—cp5类群与pH间无显著相关性;杂食/捕食性线虫个体数量与土壤含水量显著负相关(P=0.015),其它3个类群与土壤含水量之间无显著相关性。cp5类群个体数量与土壤含水量极显著负相关(P=0.003)。
对3个生长时期的均值进行相关分析,结果显示:土壤线虫数量与土壤含水量之间无显著相关性,土壤线虫数量与土壤pH、电导率显著相关(r=-0.485*,r=0.472*)。土壤线虫数量在盛长期与土壤含水量极显著正相关(r=0.349**),与pH极显著负相关(r=-0.528**)。
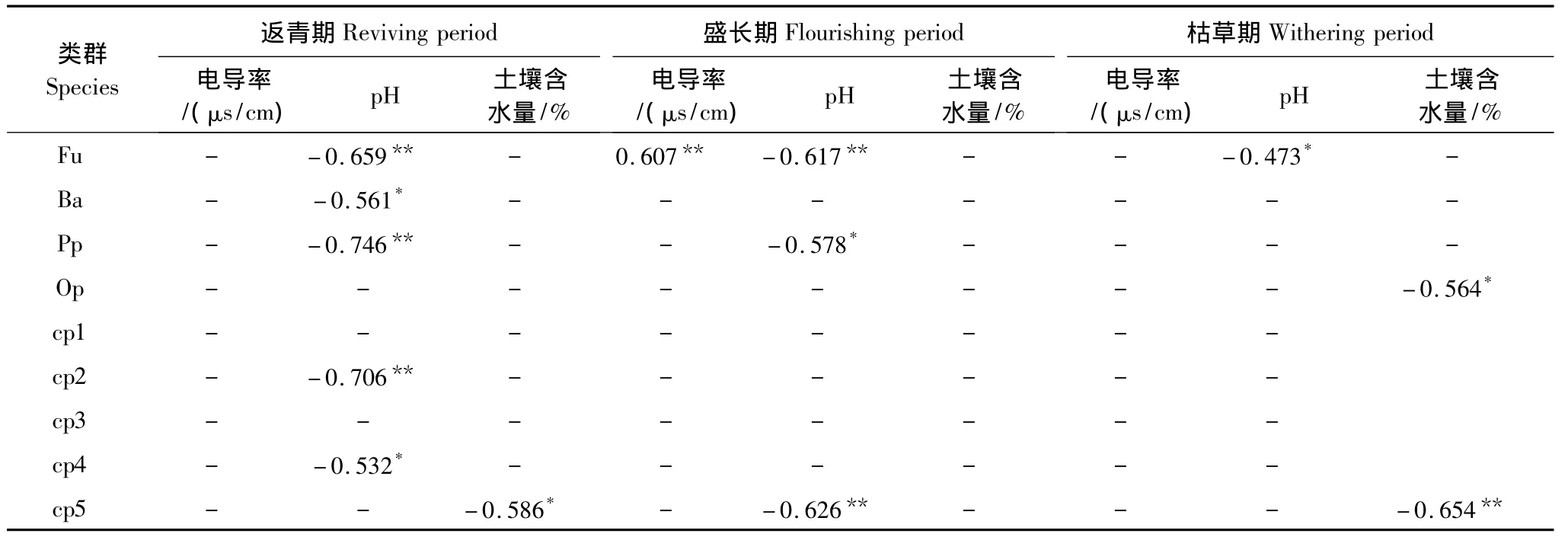
表4 土壤性质与土壤线虫营养类群及c-p类群个体数量间的关系Table 4 Correlation coefficients between nematode number of soil nematodes nutrition groups and c-p groups and major soil properties
4 讨论
研究区域地处青藏高原冻土带,其草地植被的植物区系、形态、生理生化都具有典型的高原特点。冻土能敏感地反映气候变化,季节性冻土则因周期性的冻融交替,显著地影响着土壤生物的种群和群落特征。
本研究鉴定到的藏北高寒草甸土壤线虫类群属数高于青海省海北高寒草甸草原2纲6目47属的报道结果[27],也高于内蒙古中东部大针茅草原50属的报道结果[28]。土壤线虫数量23—4109条/100g干土,低于欧洲草地土壤线虫的数量(1630—7400条/100g干土)[29],但仍处于多数报道的范围。3种植物群落下,土壤线虫类群属数的排序为:委陵菜群落>高山嵩草群落>藏北嵩草群落。
在不同植物群落下,土壤线虫的营养类群结构出现分异:委陵菜群落为植食性线虫>杂食/捕食性线虫>食细菌性线虫>食真菌性线虫;高山嵩草群落则为食细菌性线虫>植食性线虫>食真菌性线虫>杂食/捕食性线虫;藏北嵩草群落为食细菌性线虫>植食性线虫>杂食/捕食性线虫>食真菌性线虫。总体来说,植食性线虫和食细菌性线虫是调查区域的主要营养类群,分别占到了线虫个体总数的35.59%和34.20%,杂食/捕食性线虫和食真菌性线虫的比例较低,分别占线虫个体总数的17.64%和12.58%。土壤线虫营养结构的分异表明:植物群落对土壤线虫营养类群的结构产生了影响。
一般认为,委陵菜群落是高山嵩草为主要建群种的高寒草甸发生严重退化后的形式,可以推测,高山嵩草型高寒草甸发生退化会导致植食性线虫多度升高,比正常高寒草甸更易受到植食性生物的侵害[30]。尽管如此,跟前人的研究结果进行对比,本调查区域高寒草甸的植食性线虫比例还是偏低的,例如,在内蒙古大针茅草原土壤中,植食性线虫所占的比例高达69%—81%[28];罗马尼亚草原的植食性线虫所占比例为46%—69%[31];在玉米农田土壤中,植食性线虫比例为60%[32]。
杂食/捕食性线虫是决定土壤食物网复杂性的关键生物类群[33],委陵菜群落的杂食/捕食性线虫在营养类群中的比例远高于属于非退化形式的高山嵩草植被类型,这说明草甸退化增加了土壤食物网的复杂性。
3种植物群落间的食细菌性线虫相对多度差异不显著。Yeates对13个新西兰草原土壤线虫群落进行调查时发现,食细菌性线虫相对多度高达19.8%—49.9%[34],本调查区域3种植物群落高寒草甸的食细菌性线虫相对多度为25.25%—42.82%,与Yeates的调查结果相一致。食细菌线虫相对多度高可能反映了土壤中细菌数量及土壤有机质的增加[35]。
食真菌性线虫与食细菌性线虫的比值(F/B)为0.05—0.76,平均0.37,处于Ruess所报道的草原土壤线虫群落中二者比值0.1—1.0的变化范围内[36]。3种植物群落间F/B值无明显差异,均值均小于0.5,说明不同植物群落下,土壤中食细菌性线虫数量在大多数样本里均多于食真菌性线虫,土壤有机质分解系统中主要依靠细菌分解途径,这和本研究的NCR结果相一致。
以高山嵩草群落作为参照,委陵菜植物群落的cp3、cp5类群个体数量和相对多度在3个生长时期均高于高山嵩草群落,cp1、cp2及cp4类群则在3个时期均低于高山嵩草群落;藏北嵩草群落cp3类群的个体数量及相对多度均高于高山嵩草群落,而其它c-p类群则低于高山嵩草群落。cp3—cp5类群为定居者,也就是k-策略者,它们生活周期长,增殖能力低,对干扰敏感,在生境中稳定而持续地生活的时间较长,当土壤被扰动时,有可能导致数量的下降及缺失,而作为土壤线虫典型机会主义者的cp1类群和机会主义者cp2类群,生命周期短,增殖能力强,耐受干扰、富营养化和厌氧条件,在有利条件下数量会迅速增加[5]。因此,根据调查结果得出结论:高山嵩草群落土壤中的线虫食物资源在3种植被类型种最丰富,这可能是导致cp1、cp2类群数量多的主要原因之一;委陵菜群落的cp5类群在三者中最高,可能是因为该草地类型受到的放牧、鼠害等干扰最少;藏北嵩草群落由于沼泽化,其生境和委陵菜群落以及高山嵩草群落差异较大,尽管其植被覆盖度很高,地上生物量、土壤含水量、电导率均明显高于其它两种高寒草甸,但线虫数量却低于另外两种植物群落的可能原因是:归还到土壤中的有机残体纤维质含量较高,在湿冷条件下分解速度慢,线虫食物资源的减少限制了cp1、cp2类群的增殖。cp1—cp5类群在3种植物群落下的变化情况说明线虫群落的稳定状况受到了植物群落的影响。
3种植物群落不同生长时期的MI、PPI均值大小顺序一致。委陵菜群落的MI、PPI均值显著大于其它两种植被类型,3种植物群落间的MI值差异显著。MI、PPI及PPI/MI值常被用来反映生态系统的稳定性及受干扰的影响程度,Bongers曾指出,MI指数越高,生态系统成熟度越高,反之则生态系统受到干扰发生退化[4],PPI值则与扰动的频率呈正相关[37],PPI/MI值在受扰动的情况下会升高[38]。按照以上结论,委陵菜群落PPI值最高,受扰动的影响程度大于其余两种植被类型,这点基本符合实际情况。委陵菜群落属严重退化草地,植被稀疏,土壤受阳光辐射、大风等所导致的土壤湿度、温度的变化幅度,冻融交替的频率,以及地表风蚀等影响均高于其它两种植物群落。但是,委陵菜群落的MI、PPI/MI值却指示出:委陵菜群落的稳定性较高,受到的干扰在3种植物群落中最少,这个结果和前述委陵菜植物群落的cp5类群在三者中最高受扰动最少的结论一致。造成不同的指数所得到的结论相左的可能的原因是:cp5类群对来自于放牧、鼠害等的干扰更敏感,而对生境中一定程度内的土壤湿、温度变化以及冻融交替的频率可能具有一定的适应性;MI、PPI、PPI/MI 3个指数指示高寒草甸所受干扰的灵敏度不同,MI值指示土壤重金属污染产生的干扰会更有效[39]。具体原因还需进一步研究确证。
通过相关性分析,土壤线虫个体数量在盛长期与土壤含水量极显著相关,但在进一步对不同营养类群及各c-p类群与土壤含水量进行相关性分析时则发现:4个营养类群及cp1—cp5与土壤含水量之间均无明显相关性,显示了线虫与环境因子之间的复杂关系。关于线虫数量与土壤含水量之间的密切关系是如何建立起来的,这还需进一步研究。
不同营养类群与环境因子之间的相关性分析结果表明:杂食/捕食性线虫在枯草期明显受到土壤含水量的影响;食真菌性线虫与土壤pH之间的关系密切,在盛长期则明显受到土壤电导率的影响;食细菌性线虫仅在返青期与pH有相关性。
cp1—cp5类群与环境因子间的相关性分析结果表明,土壤含水量对返青期和枯草期的cp5类群影响较大,而土壤pH则对返青期的cp2及cp4类群,以及盛长期的cp5类群产生明显影响,这一结果说明,各c-p类群在不同时期对环境因子的响应不同,cp5类群对环境因子的变化在5个c-p类群中最为敏感。未发现土壤电导率与各c-p类群数量间有显著相关性。
由于植被所影响的土壤湿度、温度、养分、冻融过程等因素均直接或间接地影响和限制着土壤线虫的分布和群落结构,植物群落深刻地影响着土壤线虫群落的组成及分布特征,并由此反映着土壤生态系统的动态过程和演变,从这一点来看,研究土壤线虫群落与植被之间的关系有着重要意义。
[1]Cook R,Yeates G W.Nematode pests of grassland and forage crops.In:Evans K,eds.Plant Parasitic Nematodes in Temperate Agriculture.Wallingford:CAB International.1993:305-350.
[2]Moore JC,de Ruiter P C.Temporal and spatial hetero-geneity of trophic interactions within belowground food webs.Agriculture,Ecosystems and Environment,199,34:371-397.
[3]Yeates G W,Bonges T,de Goede R G M,Freckman D W,Georgieva SS.Feeding habits in soil nematode families and genera——Anoutline for soil ecologists.Journal of Nematology,1993,25:315-331.
[4]Bongers T.The maturity index:An ecological measure of environmental disturbance based on nematode species composition.Oecologia,1990,83:14-19.
[5]Bongers T,Bongers M.Functional diversity of nematodes.Applied Soil Ecology,1998,10:239-251.
[6]Ferris H,Bongers T,de Goede R GM.Aframework for soil food web diagnostics:Extension of the nematode faunal analysis concept.Applied Soil Ecology,2001,18:13-29.
[7]Yeates G W.Nematodes as soil indicators:Functional and biodiversity as pects.Biol Fert Soils,2003,37(4):199-210.
[8]Parmalee R W,Alston D G.Nematode trophic structure in con-ventional and no-tillage agroecosystems.Journal of Nematology,1986,18:403-407.
[9]Wardle D A.Impacts of disturbance on detritus food webs in agroecosystems of contrasting tillage and weed management practice.Advances in Ecological Research,1995a,26:105-185.
[10]Fu SL,Coleman D C,Hendrix PF,Crossley Jr D A.Responses of trophic groups of soil nematodes to residue application under conventional tillage and no-till regimes.Soil Biology and Biochemistry,2000,32:1731-1741.
[11]Rahman L,Chan K Y,Heenan D P.Impact of tillage,stubble management and crop rotation on nematode populations in a long-term field experiment.Soil&Tillage Research,2007,95:110-119.
[12]Hua JF,Liang Y,Liang W J.Effects of vegetation coverage on spatial distribution of soil nematode trophic groups.Chinese Journal of Applied Ecology,2006,17(2):295-299.
[13]Wei X H,Yang P,Xie Z K,Wang Y J.Distribution and utilization of Kobresia pygmaea type pastures in Naqu Prefecture of Tibet.Acta Agreatia Sinica,2003,11(1):67-74
[14]Liu X S,Ma Y C,Laba,Yu Z S.Climatic regionalization of the animal husbandry of Naqu Region.Beijing:Meteorological Press,2003.
[15]Lu R K.Analytical methods for soil and agrochemistry.Beijing:China Agricultural Science and Technology Press,1999.
[16]Mao X F,Li H X,Chen X Y,H F.Extraction efficiency of soil nematodes by different methods.Chinese Journal of Ecology,2004,23(3):149-151.
[17]Bongers T.De Nematoden Van Nederland.Stichting Uitgeverij Koninklijke Nederlandse Natuurhistorische Vereniging,1988.
[18]Mohammad Shamim Jairajpuri,Wasim Ahmad.Dorylaimida-Freeliving,Predaceous and Plant-parasitic Nematodes.New Delhi:Printed in India at Pauls Press,1992.
[19]Yin W Y.Pictorial Keys to Soil Animals of China.Beijing:Science Press,1998.
[20]Xie H.Taxonomy of plant nematodes,2nd ed.Beijing:Higher Education Press,2005.
[21]Wu J H.Studies of freshwater and soil nematodes of China.Wuhan:Institute of Hydrobiology,Chinese Academy Sciences,1999.
[22]Liang W J,Zhang W M,Li WG,Duan Y X.Effect of chemical fertilizer on nematode community composition and diversity in the black soil region.Biodiversity Science,2001,9(3):237-240.
[23]Wu D H,Yin W Y,Yan R Q.Effects of vegetation recovery practices on the characteristics of soil nematode communities on seriously degraded glasslands in Songnen Plain.Chinese Journal of Applied Ecology,2007,18(12):2783-2790
[24]Wu D H,Yin W Y,Bu Z Y.Changes among soil nematode community character istics in relation to different vegetation restoration practices in the moderate degraded grasslands of Songnen.Acta Ecological Sinica,2008,28(1):1-12.
[25]Freckman D W,Ettema C H.Assessing nematode communities in agroecosystems of varying human intervention.Agriculture,Ecosystems and Envionment,1993,45:239-261.
[26]Bongers T,Bongers M.Functional diversity of nematodes.Applied Soil Ecology,1998,10(3):239-251.
[27]Yin WY.Soil Animals of China.Bejing:Sience Press,2000,57-63.
[28]Ruan W B,Wu J B,Zhang X,Li J,Xu H,Zhao N X,Chen L,Duan Y X,Chen L J,Gao Y B.Soil nematode diversity in Stipa grandis community in the mid-east of Inner Mongolia.Chinese Journal of Applied and Environmental Biology,2007,13(3):333-337.
[29]Ekschimit K,Bakonyi G,Bongers M,Bongers T,Boström S,Dogan H,Harrison A,Kallimanis A,Nagy P,O'Donnell A G,Sohlenius B,Stamou G P,Wolters V.Effects of the nematofauna on microbial energy and matter transformation rates in European grassland soils.Plant and soil,1999,212(1):45-61.
[30]Bergeson G B,Ferris JM.Influence of tillage methods on pratylenchus spp.in 2 soil types.Plant Disease,1986,70:326-328.
[31]Popovici I,Ciobanu M.Diversity and distribution of nematode communities in grassland from Romania in relation to vegetation and soil characteristics.Applied Soil Ecology,2000,12:27-36.
[32]Zhou JH,Tao J,Chen X Y,Hu F,Li H X.Soil nematode density inside and outside a pesticide factory in Anhui.Biodiversity Science,2008,16(6):613-617.
[33]Polis G A,Strong D R.Food web complexity and community dynamics.American Naturalist,1996,147:813-846.
[34]Yeates G W.Variation in soil nematode diversity under pasture with soil and year.Soil Biology&Biochemistry,1984,16:95-102.
[35]Grffths B S,Ritz K,Wheatley R E.Nematodes as indicators of enhanced microbiological activity in a Scottish organic farming.Soil Use&Management,1994,10:20-24.
[36]Ruess L.Nematode soil faunal analysis of decomposition pathways in different ecosystems.Nematology,2003,5:179-181.
[37]Liu Y J.Characteristics of soil nematode community structure in greenhouse.Harbin:Heilongjiang university press,2010.
[38]Bongers T,van der Meulen H,Korthals G.Inverse relationship between the nematode maturity index and plant parasite index under enriched nutrient conditions.Applied Soil Ecology,1997,6:195-199.
[39]Bongers T,Ferris H.Nematode community structure as a bioindicator in environmental monitoring.Trends in Ecology&Evolution,1999,14:224-228.
参考文献:
[12] 华建峰,梁勇,梁文举.植被覆盖对土壤线虫营养类群空间分布的影响.应用生态学报,2006,17(2):295-299.
[13] 魏兴琥,杨萍,谢忠奎,王亚军.西藏那曲地区高山嵩草草地的分布与利用.草地学报,2003,11(1):67-74.
[14] 刘雪松,马玉才,拉巴,余忠水.那曲地区牧业气候区划.北京:气象出版社,2003.
[15] 鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,1999.
[16] 毛小芳,李辉信,陈小云,胡锋.土壤线虫三种分离方法效率比较.生态学杂志,2004,23(3):149-151.
[19] 尹文英.中国土壤动物检索图鉴.北京:科学出版社,1998.
[20] 谢辉.植物线虫分类学(第二版).北京:高等教育出版社,2005.
[21] 吴纪华.中国淡水和土壤线虫的研究[D].武汉:中国科学院水生生物研究所,1999.
[22] 梁文举,张万民,李维光,段玉玺.施用化肥对黑土地区线虫群落组成及多样性产生的影响.生物多样性,2001,9(3):237-240.
[23] 吴东辉,尹文英,阎日青.植被恢复方式对松嫩草原重度退化草地土壤线虫群落特征的影响.应用生态学报,2007,18(12):2783-2790.
[24] 吴东辉,尹文英,卜照义.松嫩草原中度退化草地不同植被恢复方式下土壤线虫的群落特征.生态学报,2008,28(1):1-12.
[27] 尹文英.中国土壤动物.北京:科学出版社,2000,57-63.
[28] 阮维斌,吴建波,张欣,李晶,许华,赵念席,陈磊,段玉玺,陈立洁,高玉葆.内蒙古中东部大针茅群落土壤线虫多样性研究.应用与环境生物学报,2007,13(3):333-337.
[32] 周际海,陶军,陈小云,胡锋,李辉信.安徽农药厂厂区及周边农田土壤线虫数量特征.生物多样性,2008,16(6):613-617.
[37] 刘艳军.温室土壤线虫群落结构特征.哈尔滨:黑龙江大学出版社,2010.

