不同生态区域沙地建群种油蒿的钙组分特征
薛苹苹,高玉葆,何兴东
(南开大学生命科学学院,天津300071)
植物体内的钙离子及化合态钙在植物生理生化代谢中有重要的作用、并进而影响植物的行为[1-3]。钙离子在维持膜完整性及稳定性[2,4]、调节渗透平衡[5-7]、作为第二信使调节新陈代谢[8-9]、增强离子选择吸收和运输能力[10]、减少活性氧的生成[11-13]以及改善光合作用[14]等方面具有重要意义,草酸钙在调节钙离子浓度[15-16]以及植防御保护和重金属的解毒[17-19]等方面发挥着重要作用,磷酸钙在促进和抑制代谢方面[20]有独特功能,而果胶酸钙维持细胞壁强度方面[2-3]不可或缺。如上所述,钙离子与化合态钙的生理生化及生态功能不尽相同,因而,很有必要从钙组分的角度探讨植物的抗逆性。
植物钙组分包括水溶性钙、醋酸溶性钙和盐酸溶性钙。水溶性钙是指游离钙离子和一些易溶或微溶于水的钙盐,醋酸溶性钙主要包括碳酸钙、磷酸钙和果胶酸钙等,而盐酸溶性钙仅为草酸钙[3]。前期对干旱生境腾格里沙漠25种植物钙组分研究表明,多年生草本植物具有较多的水溶性钙,而灌木和半灌木具有较多的盐酸溶性钙;随进展演替,植物体内醋酸溶性钙逐渐减少而盐酸溶性钙逐渐增加[21]。随后对天津盐渍化生境54种植物钙组分研究表明,从乔木、灌木、藤本到草本,植物体内盐酸溶性钙含量逐渐减少而水溶性钙含量逐渐增多,且草本植物体内的水溶性钙含量显著高于乔木和灌木[22]。这说明对干旱生境和盐渍化生境较敏感的植物具有较多的钙离子,而相对不敏感的植物具有较多的草酸钙。显然,物种不同、生长型不同,植物体内钙组分特征不同。
然而,同一物种不同居群因生境而异其钙组分特征会不会也有所差异,这是一个需要验证的问题。为此,本文选择我国北方沙地重要建群种油蒿(Artemisia ordosica)为研究对象,从植株构件水平和种群水平,按生境、年龄比较了油蒿的钙组分特征,为深入了解植物的抗逆性适应机制及表型可塑性的形成机制提供依据。
1 实验材料与方法
1.1 供试材料及取样
2010年8月15 —20日,先后在内蒙古杭锦旗(库布齐沙漠)、乌审旗(毛乌素沙地)、阿拉善左旗(腾格里沙漠)以及宁夏盐池县(毛乌素沙地)和陕西榆林市榆阳区(毛乌素沙地)这5个旗(县、区)采集油蒿植物样品。研究区气候因子见表1。
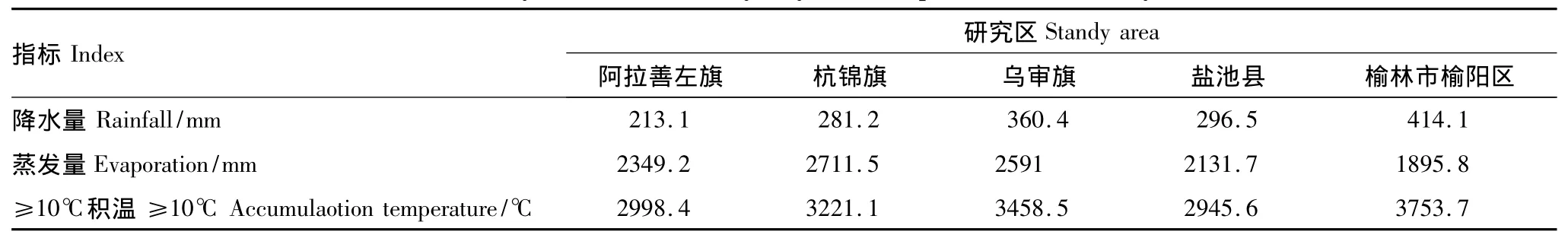
表1 研究区年均降水量与年均蒸发量Table 1 Yearly mean rainfall and yearly mean evaporation for the study area
其中杭锦旗设2个采样点,N 39.8515°、E 108.7135°(油蒿半固定沙地)和N 39.7642°、E 108.7639°(油蒿固定沙地);乌审旗设1个采样点,N 39.6287°、E 108.7595°(油蒿流动沙地、半固定沙地和固定沙地);榆林市榆阳区设1个采样点,N 38.2876°、E 109.6308°(油蒿半固定沙地和固定沙地);盐池县设1个采样点,N 37.8303°、E 107.4094°(油蒿半固定沙地和固定沙地);阿拉善左旗设1个采样点,N 38.7822°、E 105.4396°(油蒿半固定沙地和固定沙地)。本文依据朱震达[23]和赵兴樑[24]的定义划分固定沙地、半固定沙地和流动沙地。
在每个采样点每种沙地类型中,根据油蒿灌丛生长状况,划分衰老、成年旺盛和幼龄3个生长阶段,每个生长阶段随机选取5个灌丛,每个油蒿灌丛分别采集叶、1年生枝、多年生枝、细根(<2mm)和主根(>2 mm),共采集825份油蒿植物样品,分别装入编号的纸袋中,及时通风,带回实验室,室温自然保存。
1.2 植物钙组分测定
1.2.1 样品研磨
将尽量剪碎的植物样品装入2.0 mL离心管中,按照研磨仪MM301的操作说明,将两颗钢珠事先装入此离心管中,为了达到较好的研磨效果,样品量不要超过2.0 mL离心管容积的1/2。如有必要,可将装好样品和钢珠的离心管使用液氮冰冻,随后迅速装载到MM301研磨仪上,频率设置为1/30 s,研磨时间为15 min,研磨结束后,检查样品是否呈粉末状,否则,重复以上步骤直至样品完全成为粉末状。与此同时,取植物样品烘干,测定组织含水量,用于计算样品干重。
1.2.2 样品称量
取上述研磨好的样品,用万分之一(四位)分析天平进行称量,为减小不同处理样品之间的误差,尽量称取样品质量接近0.0350 g,并详细、准确记录样品编号及称量数据,连续称取3份,每一份对应着装入事先编号的7 mL离心管中。重复以上称量工作,即,每个样品处理为两次重复,共6份样品。
1.2.3 处理液的制备
用连续组分法[3,25]测定钙组分,分别做水处理、醋酸处理和盐酸处理。水处理溶液即蒸馏水;醋酸溶液的配制是将12 mL冰乙酸用蒸馏水稀释至200 mL,得到浓度为1.045 mol/L的稀醋酸溶液;盐酸溶液的配制是将83.5 mL的盐酸用蒸馏水稀释至1000 mL,得到浓度为1 mol/L的稀盐酸溶液。
1.2.4 测定方法
往已装有样品的7 mL离心管中加入对应的处理液,即蒸馏水、稀醋酸溶液和稀盐酸溶液5 mL,充分混匀,12000 r/m下离心10 min;取上清液0.5 mL转移至新的7 mL离心管中,并做好相对应的编号标记;然后,再分别向装有上清液的离心管中加入4.5 mL蒸馏水,使得最终体积为5 mL;将处理好的样品用电感耦合等离子体发射光谱仪(ICP-AES)进行钙离子浓度测定。
1.2.5 结果计算
根据仪器测定原理,使用计算公式为:Ca(g/kg)=α×5×10×0.001/m,式中α为ICP仪器测定值,5为测定样品溶液的体积,10为配制样品溶液的稀释倍数,m为称取样品的质量。
1.3 数据分析
观测数据按照器官、不同生态区域以及按照生境和生长阶段分别统计,用SPSS 16.0软件进行单因素方差分析(one-way ANOVA),并用最小显著差异法(LSD)比较不同数据组间的差异(α=0.05)。同时,以不同生长阶段油蒿不同器官钙组分数据为基准数据,用SPSS 16.0软件中降维软件包的因子分析计算得分值,分析生态环境对油蒿不同居群钙组分的影响力。
2 结果
2.1 油蒿不同器官与居群间钙组分的变化
统计结果表明(图1),在油蒿的不同器官中,叶中水溶性钙显著高于枝和根;叶中醋酸溶性钙也显著高于枝和根,但根中醋酸溶性钙较枝略多;叶中盐酸溶性钙与根无显著差异,但二者均显著高于枝。总的来看,年降水量相对较高的榆林市榆阳区较年降水量相对较低的阿拉善左旗(表1),油蒿叶和当年生枝中水溶性钙含量相对较高(图1);反过来,年降水量相对较低的阿拉善左旗较年降水量相对较高的榆林市榆阳区,油蒿细根和主根中盐酸溶性钙含量相对较高(图1);而年降水量相对中等的乌审旗和杭锦旗油蒿各构件中的醋酸溶性钙既高于条件较好的榆林市榆阳区又高于条件较差的阿拉善左旗(图1)。
就不同生态区域油蒿而言(图2),年降水量相对中等和较高的榆林市榆阳区、乌审旗、盐池县和杭锦旗油蒿体内水溶性钙均显著高于年降水量较低的阿拉善左旗,年降水量相对中等的乌审旗油蒿体内醋酸溶性钙均显著高于条件较好的榆林市榆阳区和条件较差的阿拉善左旗,但年降水量相对较低的阿拉善左旗以及年降水量相对中等的杭锦旗油蒿体内盐酸溶性钙均显著地高于年降水量相对较高的榆林市榆阳区、乌审旗和盐池县。

图1 油蒿不同器官中钙组分的变化Fig.1 Calcium components in different organs of Artemisia ordosica plant
2.2 不同生长阶段及不同生境钙组分的变化
就油蒿不同生长阶段而言(图3),除成龄旺盛生长阶段醋酸溶性钙显著低于老龄阶段和幼龄阶段外,水溶性钙和盐酸溶性钙3个生长阶段没有显著差异。
但是,按照生境类型统计(图4),流动沙地油蒿体内水溶性钙和盐酸溶性钙均显著低于半固定沙地和固定沙地而醋酸溶性钙显著高于半固定沙地和固定沙地。
2.3 钙组分影响力分析
鉴于以上分析,油蒿器官、不同生态区域以及不同生境钙组分都有显著差异,而不同生长阶段差异不明显,因此,以不同生长阶段油蒿器官钙组分数据为基准数据,分析生态环境对油蒿不同居群钙组分的影响力(表2)。
影响力分析结果表明,半固定沙地油蒿水溶性钙杭锦旗影响力最大,而榆林市榆阳区影响力最小,醋酸溶性钙杭锦旗影响力最大而阿拉善左旗影响力最小,盐酸溶性钙杭锦旗影响力最大而盐池县影响力最小;固定沙地油蒿水溶性钙乌审旗影响力最大而杭锦旗影响力最小,醋酸溶性钙杭锦旗影响力最大而盐池县影响力最小,盐酸溶性钙杭锦旗影响力最大而乌审旗影响力最小。不同生态区域油蒿油蒿钙组分的现实统计结果也基本如此(图5)。

图2 不同生态区域油蒿体内钙组分变化Fig.2 Calcium components of Artemisia ordosica plant for different ecological regions

图3 不同生长阶段油蒿钙组分变化Fig.3 Calcium components of Artemisia ordosica in the different growing stages

图4 不同生境油蒿钙组分变化Fig.4 Calcium components of Artemisia ordosica plant in the different habitats
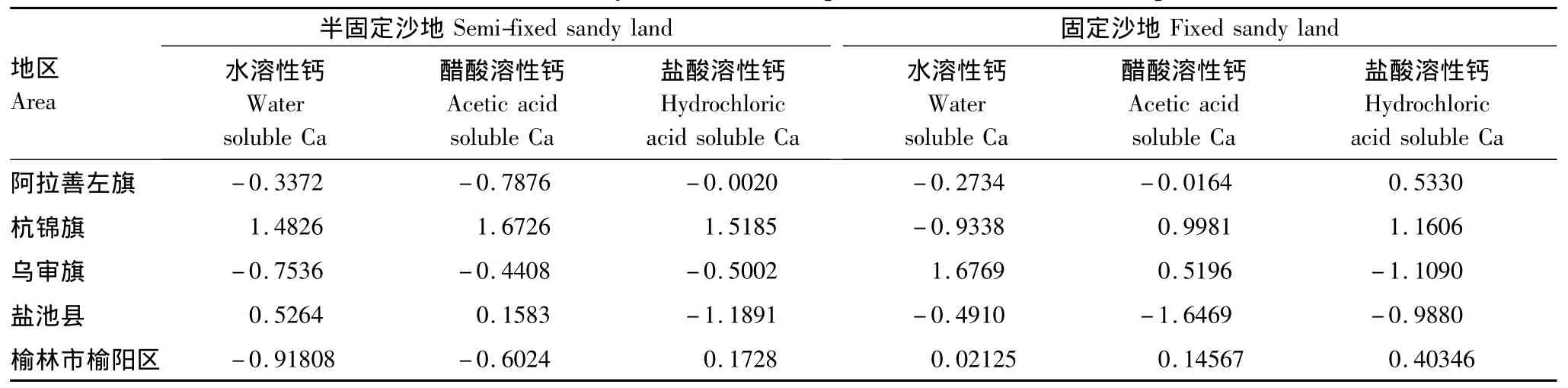
表2 油蒿钙组分影响力分析Table 2 Influence analysis of calcium components for Artemisia ordosica plant

图5 不同生态区域不同生境油蒿钙组分变化Fig.5 Calcium components of Artemisia ordosica plant in the different ecological regions and different habitats
3 讨论
植物各器官的生物学功能不同,钙离子和化合态钙的生理生态功能也有所不同[2,8,15],因而理论上植物各器官中的钙组分也应当存在差异。本研究表明,油蒿各器官钙组分之间的确存在显著差异,叶中水溶性钙和醋酸溶性钙均显著高于枝和根中,叶中与根中盐酸溶性钙均显著高于枝中。承前所述,水溶性钙是指游离钙离子和一些易溶或微溶于水的钙盐,醋酸溶性钙主要包括一些生理活性钙盐,而盐酸溶性钙仅为草酸钙[3]。也就是说,叶中钙离子、果胶酸钙、苹果酸钙、磷酸钙、碳酸钙和草酸钙含量均较多,这与叶是光合产物的形成场所有关[26]。
本研究表明,不同生态区域油蒿钙组分的差异较大,年降水量相对较高的榆林榆阳地区,油蒿体内水溶性钙含量较多;而年降水量相对较低的阿拉善左旗,油蒿体内盐酸溶性钙含量较高。这一结果与前期对干旱生境25种植物[22]和盐渍化生境54种植物[23]钙组分特征的研究结果有所不同,前期结果是对逆境较敏感的植物具有较多的钙离子、对逆境相对不敏感的植物具有较多的草酸钙,而本研究的结果是逆境程度轻水溶性钙含量多(较多的钙离子)、逆境程度重盐酸溶性钙含量多(较多的草酸钙)。结合油蒿构件水平钙组分特征进一步分析得知,年降水量相对较高的地区,含量相对较高的水溶性钙主要存在于油蒿的叶片;而年降水量相对较低的阿拉善左旗,含量相对较高的盐酸溶性钙主要存在于油蒿的叶和根中。
与预期不同的是,从油蒿的生长阶段来看,幼龄、成龄旺盛与老龄3个生长阶段钙组分基本没有显著差异。但是,生境对钙组分有明显影响,流动沙地和半固定沙地油蒿体内水溶性钙和盐酸溶性钙均显著低于固定沙地。这一结果与上述油蒿种群水平钙组分的特征是一致的,这是因为固定沙地相对于流动沙地和半固定沙地,土壤水分条件变差,加之生境中其他生态条件的变化,导致固定沙地的油蒿具有较多的盐酸溶性钙,即油蒿体内含有相对较多的草酸钙。然而,按照油蒿种群水平钙组分特征的结果,半固定沙丘较固定沙丘油蒿水溶性钙应该相应地增多,但统计结果是半固定沙地油蒿体内水溶性钙显著低于固定沙地,这一现象下面进行分析。
一个地区植物的钙组分特征是生态环境综合影响的结果。在本研究中,鉴于油蒿不同器官、不同生态区域以及不同生境钙组分都有显著差异,而不同生长阶段差异不明显,于是以不同生长阶段油蒿构件水平钙组分数据为基准数据进行因子分析。结果表明,半固定沙地油蒿水溶性钙杭锦旗影响力最大,盐酸溶性钙杭锦旗影响力也是最大;固定沙地油蒿水溶性钙杭锦旗影响力最小,盐酸溶性钙杭锦旗影响力最大。那么,在5个居群中,杭锦旗油蒿钙组分影响力为何这样特殊?仔细分析气候因子,发现杭锦旗的年均蒸发量在5个采样区是最大的。与最干燥的阿拉善左旗相比,尽管杭锦旗的降水量(281.2 mm)比阿拉善(213.1 mm)高且干燥度(1.83)比阿拉善(2.25)低,但由于杭锦旗≥10℃积温(3221.1℃)比阿拉善(2998.4℃)高6.91%,因而杭锦旗的蒸发量(2711.5 mm)比更干旱的阿拉善左旗(2349.2 mm)还要高13.36%。可见,不但年降水量影响油蒿钙组分的特征,而且年蒸发量也影响油蒿钙组分特征,而这点是今后分析物种钙组分必须要注意的。那么,在本研究结果中,出现半固定沙丘油蒿体内水溶性钙显著低于固定沙地正是由于特殊的蒸发条件导致的。
诚然,植物的钙组分特征不但是当地生态环境条件的反映,而且也可能会影响植物的表型可塑性。由于植物根际交换性钙的含量显著低于非根际[27],根系吸收土壤中钙参与代谢,植物所吸收的钙不但调节气孔限制蒸腾[28-29]、改善光合[14]、增强氮素代谢[30],而且中和多余而有毒的草酸[31],而更重要的是,植物吸收的钙直接促进植物的生长和生物量的积累[32-33],进而影响植物的表型[34],但这方面的问题仍需深入探索。
[1]Jian L C,Wang H.Ca2+signaling in plant cell response and adaptation to low temperature,drought and salt stresses.Chinese Bulletin of Botany,2008,25(3):255-267.
[2]Hepler P K.Calcium:a central regulator of plant growth and development.The Plant Cell,2005,17(18):2142-2155.
[3]Clark CJ,Smith G S,Walker G D.The form,distribution,and seasonal accumulation of calcium in kiwifruit leaves.New Phytologist,1987,105(3):477-486.
[4]Matsumoto H,Yamada T.Repression of the K+uptake and cation-stimulated ATPase activity associated with the plasma membrane-enriched fraction of cucumber roots due to Ca2+starvation.Plant and Cell Physiology,1984,25(8):1501-1508.
[5]Carvajal M,CerdáA,Martínez V.Does calcium ameliorate the negative effect of NaCl on melon root water transport by regulating aquaporin activity?New Phytologist,2000,145(3):439-447.
[6]Song JQ,Mei X R,Fujiyama H.Adequate internal water status of NaCl-salinized rice shoots enhanced selective calcium and potassium absorption.Soil Science and Plant Nutrition,2006,52(3):300-304.
[7]Shah SH,Wainwright SJ,Merrett M J.The interaction of sodium and calcium chlorides and light on growth,potassium nutrition,and proline accumulation in callus cultures of Medicago sativa L.New Phytologist,1990,116(1):37-45.
[8]Bush D S.Calcium regulation in plant cells and its role in signaling.Annual Review of Plant Physiology and Plant Molecular Biology,1995,46:85-122.
[9]Blatt M R,Grabov A.Signalling gates in abscisic acid-mediated control of guard cell ion channels.Physiologia Plantarum,1997,100(3):481-490.
[10]Halperin SJ,Kochian L V,Lynch J P.Salinity stress inhibits calcium loading into the xylem of excised barley(Hordeum vulgare)roots.New Phytologist,1997,135(3):419-427.
[11]Sanders D,Brownlee C,Harper J F.Communicating with calcium.The Plant Cell,1999,11(4):691-706.
[12]Bowler C,Flubr R.The role of calcium and activated oxygens as signals for controlling cross-tolerance.Trends in Plant Science,2000,5(6):241-246.
[13]Mittova V,Volokita M,Guy M,Tal M.Activities of SOD and the ascorbate-glutathione cycle enzymes in subcellular compartments in leaves and roots of the cultivated tomato and its wild salt-tolerant Lycopersicon pennellii.Physiologia Plantarum,2000,110(1):42-51.
[14]Van Assche F,Clijsters H.Effects of metals on enzyme activity in plants.Plant,Cell and Environment,1990,13(3):195-206.
[15]Franceschi V R,Horner H T.Calcium oxalate crystals in plants.The Botanical Review,1980,46(4):361-427.
[16]Kostman T A,Franceschi V R.Cell and calcium oxalate crystal growth is coordinated to achieve high-capacity calcium regulation in plants.Protoplasma,2000,214(3/4):166-179.
[17]Volk G M,Lynch-Holm V J,Kostman T A,Goss L J,Franceschi V R.The role of druse and raphide calcium oxalate crystals in tissue calcium regulation in Pistia stratiotes Leaves.Plant Biology,2002,4(1):34-45.
[18]Mazen A M A.Calcium oxalate deposits in leaves of Corchorus olitorius as related to accumulation of toxic metals.Russian Journal of Plant Physiology,2004,51(2):281-285.
[19]Chen Z,Geng H C,Wang S S,Ding M L Chen X J,Chen J Y.Formation,degeneration and functions of oxalate in plant.Molecular Plant Breeding,2007,5(S1):105-110.
[20]McLaughlin SB,Wimmer R.Tansley review No 104 calcium physiology and terrestrial ecosystem processes.New Phytologist,1999,142(3):373-417.
[21]Ci H C,He X D,Li R,Wu W,Xue P P,Gao Y B,Zhao H L.Characteristics of plant calcium fractions for 25 species in Tengger Desert.Sciences in Cold and Arid Regions,2010,2(2):168-174.
[22]Xu J J,Ci H C,He X D,Xue P P,Zhao X L,Guo J T,Gao Y B.Features of calcium crystals and calcium components in 54 plant species in salinized habitats of Tianjin.Chinese Journal of Applied Ecology,2012,23(5):1247-1253.
[23]Zhu Z D.Desert in China(Recension).Beijing:Science Press,1980.
[24]Zhao X L.Discussion on sand-fixing plants in Shapotou area//Institute of Desert Research,Chinese Academy of Sciences,Lanzhou.Study on Controlling Shifting Sand in Tengri Desert(2nd).Yinchuan:Ningxia People Press,1991:27-57.
[25]Bradfield E G.Extraction of calcium fractions from plant material.Communications in Soil Science and Plant Analysis,1977,8(7):563-572.
[26]Pan R C.Plant Physiology.Beijing:Higher Education Press,2004.
[27]Ren W,Zhou ZY,Zhan Y Y,Xue Z Y.The characteristics of medium and traceelement concentrations in the rhizosphere of desert shrubs,Alxa.Acta Ecological Sinica,2009,29(7):3759-3767.
[28]Atkinson C J,Mansfield T A,Davies W J.Does calcium in xylem sap regulate stomatal conductance?New Phytologist,1990,116(1):19-27.
[29]Ng C K Y,McAinsh M R,Gray J E,Hunt L E,Leckie C P,Mills L,Hetherington A M.Calcium-based signalling systems in guard cells.New Phytologist,2001,151(1):109-120.
[30]Wang Z Q,Wang C L,Lin T B.Effects of exogenous Ca2+on nitrogen metabolism in wheat seedlings.Acta Ecological Sinica,2008,28(8):3662-3667.
[31]Mazen A M A,Zhang D Z,Franceschi V R.Calcium oxalate formation in Lemna minor:physiological and ultrastructural aspects of high capacity calcium sequestration.New Phytologist,2004,161(2):435-448.
[32]Giraldez-Ruiz N,Mateo P,Bonilla I,Fernandez-Pinas F.The relationship between intracellular pH,growth characteristics and calcium in the Cyanobacterium anabaena sp.Strain PCC7120 exposed to low pH.New Phytologist,1997,137(4):599-605.
[33]Huang H G,Li T X,Zhang X Z,Tian SK,Yang X E.Effects of exogenous Ca2+on the growth and Zn accumulation of two Sedum alfredii Hance ecotypes.Chinese Journal of Applied Ecology,2008,19(4):831-837.
[34]Knight M R,Knight H,Watkins N J.Calcium and the generation of plant form.Philosophical Transactions of the Royal Society B:Biological Sciences,1995,350(1331):83-86.
参考文献:
[1] 简令成,王红.Ca2+在植物细胞对逆境反应和适应中的调节作用.植物学通报,2008,25(3):255-267.
[19] 陈峥,耿华春,王沙沙,丁明丽,陈新建,陈军营.植物体内草酸(盐)的形成、降解及其作用.分子植物育种,2007,5(S1):105-110.
[22] 徐静静,慈华聪,何兴东,薛苹苹,赵雪莱,郭健潭,高玉葆.天津盐渍化生境54种植物钙晶体与钙组分特征.应用生态学报,2012,23(5):1247-1253.
[23] 朱震达.中国沙漠概论(修订版).北京:科学出版社,1980.
[24] 赵兴樑.沙坡头地区植物固沙问题的探讨//中国科学院兰州沙漠研究所沙坡头沙漠科学研究站.腾格里沙漠沙坡头地区流沙治理研究(二).银川:宁夏人民出版社,1991:27-57.
[26] 潘瑞炽.植物生理学.北京:高等教育出版社,2004.
[27] 任伟,周志宇,詹媛媛,薛梓瑜.阿拉善荒漠灌木根际中、微量元素含量特征.生态学报,2009,29(7):3759-3767.
[30] 王志强,王春丽,林同保.外源钙离子对小麦幼苗氮素代谢的影响.生态学报,2008,28(8):3662-3667.
[33] 黄化刚,李廷轩,张锡洲,田生科,杨肖娥.外源钙离子对东南景天生长及锌积累的影响.应用生态学报,2008,19(4):831-837.

