环丙沙星对土壤微生物量碳和土壤微生物群落碳代谢多样性的影响
马 驿 ,彭金菊,王 芸,陈法霖,陈进军,孙永学
(1.广东海洋大学农学院动物医学系,湛江524088;2.中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京100085;3.华南农业大学广东省兽药研制与安全评价重点实验室,广州510642)
近30年来,氟喹诺酮类(fluoroquinolones,FQs)的研究进展十分迅速,临床常用的有诺氟沙星、恩诺沙星、环丙沙星(Ciprofloxacin)等10多种药物。FQs为广谱杀菌药(对细菌、支原体、衣原体等均有作用),抗菌力强,被广泛应用于人类及动物感染性疾病的治疗。因FQs体内原型排泄率大,经人畜使用者排泄物进入环境中的范围广、量大。对北京污水及地表水测定结果显示,污水中含有12种氟喹诺酮类抗生素,浓度12—1208 ng/L,地表水含7种FQs,浓度1.3—535 ng/L[1]。FQs化学性质较稳定,导致其环境残留的抗菌生物活性时间相对较长,FQs在环境中持续地迁移扩散,对人类健康形成了不可预测的潜在风险[2],Schwarzenbach等[3]称FQs等新型污染物引起的微污染已成为“人类面临的重大环境问题之一”。环丙沙星对植物的影响已有报道[4]。
土壤微生物量碳作为土壤有机质中最活跃和最易变化的组分,能在很大程度上反映土壤质量和土壤微生物数量,因而是评价土壤微生物量和活性的重要指标[5]。土壤微生物碳源利用率和碳代谢多样性,能反映生态系统受干扰后的细微变化,是土壤生物肥力的重要指标,对土壤管理有重要的指示作用[6]。目前,重视分子生物学方法分析微生物群落功能多样性,但分子生物学方法要求的劳动强度大、时间长、技术含量较高,难以在较短的时间内分析较多的样品,以Biolog微孔板碳源利用为基础的定量分析为描述微生物群落功能多样性提供了一种更为简单、更为快速的方法[6-7]。土壤微生物对Biolog微平板中各类碳源的利用情况的差异反应了土壤中微生物群落代谢功能的不同,平均每孔颜色变化率(AWCD)是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物活性、微生物群落的反应速度和反应程度,已广泛应用于评价土壤微生物群落的功能多样性[8-10]。本试验通过在土壤中添加不同浓度环丙沙星,借助氯仿熏蒸浸提法和Biolog法,分析土壤微生物量碳和微生物群落碳代谢多样性,明确土壤微生物群落碳代谢的变化方向和程度,了解环丙沙星对土壤微生物群落的影响强度,以揭示环丙沙星在环境中残留对土壤微生物学性状的影响。
1 材料与方法
1.1 土壤
培养土壤采自广东海洋大学花园苗圃10—20 cm土层的土壤,为砖红壤,土有机质28.5 g/kg,全氮1.82 g/kg,全磷1.31 g/kg,全钾23.6 g/kg,速效磷14.5 mg/kg,速效钾145 mg/kg,pH值6.75。
采集的新鲜土样过4 mm筛,用湿纱布盖于土表于室温下放置3d,待微生物活化后,按每5 kg鲜土加入50 mL不同浓度的环丙沙星溶液(环丙沙星活性成分含量≥98.5%,浙江国邦兽药有限公司),使土壤中环丙沙星活性成分含量分别为:Ⅰ组(对照组)0μg/g、Ⅱ组0.01μg/g、Ⅲ组0.1μg/g、Ⅳ组1μg/g、Ⅴ组10μg/g、Ⅵ组100μg/g,用去离子水调土壤湿度至40%的饱和持水量,混合均匀后倒入10 L的塑料桶中,并用湿纱布盖于土表,置于室温(20—25℃)下培养35d,用称重法每隔3d调节1次土壤湿度,以保持土壤湿度稳定,每个处理设3次重复。
1.2 分析项目及方法
1.2.1 土壤微生物量碳
于处理后21d采取相当于20 g烘干质量的培养土壤,用氯仿熏蒸浸提法测定土壤微生物量碳[11]。
1.2.2 BIOLOG分析
分别于用药后7d、21d、35d采集新鲜土壤10 g,加90 mL灭菌生理盐水(0.85%),充分振荡30 min后,稀释至10-3倍,再吸取150μL接种到Biolog EcoPlate微平板的微池内,置于25℃下培养,每12 h在590 nm下BIOLOG读数器上读数。
平均每孔颜色变化率(AWCD)计算[12-13]:

式中,C为每个有培养基微池的光密度值,R为对照孔的光密度值,n为培养基数据,EcoPlate板中有31种不同碳源,n值为31。
采用曲线整合方法[14]估计碳源代谢强度:
梯形面积

式中,vi为i时刻的AWCD值。
丰富度指数为被利用的碳源的总数目,即31个微池中C-R值大于0.25的微池数[15]。多样性指数用Shannon-Wiener指数(H')表示:
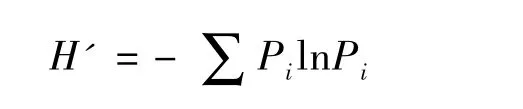
式中,Pi为有培养基的微池与对照微池的光密度值差与整板总差的比值。
即

本试验采用Biolog微平板培养72h的数据,来比较土壤微生物群落的碳源利用及代谢功能多样性,采用SPSS11.5软件进行统计分析和主成分分析。
2 结果与分析
2.1 土壤微生物量碳
用环丙沙星处理后21d土壤中微生物量碳含量如图1所示,环丙沙星(0.1—100μg/g)对土壤微生物量碳含量影响显著(与对照组比较,P<0.5),药物处理组土壤微生物量碳含量均低于对照组,土壤中环丙沙星浓度愈高,土壤微生物量碳含量愈低。100μg/g的环丙沙星处理使土壤微生物量碳下降58.69%。
2.2 土壤微生物群落碳代谢多样性
AWCD是反映土壤微生物活性,即利用碳源的整体能力的一个重要指标[16]。由图2可知,微生物活性随培养时间的延长而提高,不同组别土壤微生物利用单一碳源能力的大小顺序为:Ⅰ组>Ⅱ组>Ⅲ组>Ⅳ组>Ⅴ组>Ⅵ组。处理后7、21、35d,各处理组土壤微生物的AWCD基本都低于对照组,尤其是Ⅵ组(100μg/g组)降低了56.56%—78.94%。
培养基丰富度指数反映的是微生物利用碳源的数量,培养基Shannon-Wiener多样性指数表明的是土壤微生物群落利用碳源类型的多与少,即功能多样性。土壤微生物群落代谢功能丰富度指数和多样性指数与药物浓度的变化情况(表1)为:
第7天,对照组的丰富度指数与0.1、1、10、100μg/g组差异显著;第21天、35天,100μg/g组的丰富度指数与对照组差异显著。
第7天、21天,对照组的多样性指数与10、100μg/g组差异显著;第35天,对照组的多样性指数与其他各组之间差异不显著。
2.3 土壤微生物对碳源的利用强度
AWCD曲线的积分面积反映了土壤微生物群落在Biolog微平板整个培养期内利用碳源能力的差异,本研究采用AWCD曲线整合方法估计土壤微生物群落的代谢强度。环丙沙星含量不同,土壤微生物对碳源的利用强度不同(图3),第7天,对照组土壤微生物对碳源的利用强度最大,与用药各组均差异显著;第21天、35天,10、100μg/g组土壤微生物对碳源的利用强度与对照组差异显著。
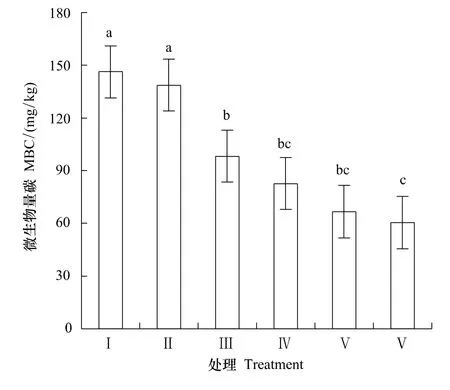
图1 处理后21d土壤微生物量碳含量Fig.1 Contents of soil microbial biomass carbon(MBC)for each treatment after 21 days
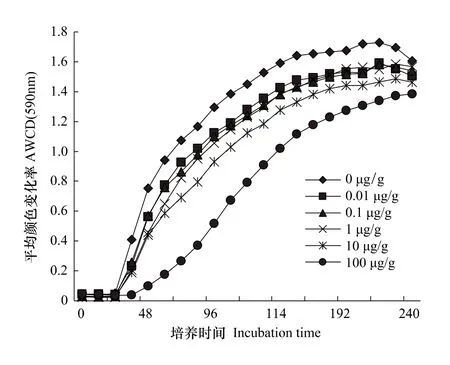
图2 处理后7d土壤平均颜色变化率Fig.2 Average well colour development in soil from different treatments after 7 days

表1 土壤微生物利用Biolog微平板碳源的丰富度指数和多样性指数Table1 Richness indexes and diversity indexes of utilized substrates for each treatment
2.4 土壤微生物群落代谢功能主成分分析
31种碳源的测定结果形成了描述微生物群落代谢特征的多元向量,不易直观比较,对31种碳源进行主成分分析结果表明:土壤微生物群落的代谢多样性类型分异明显。第7天(图4),第一主成分和第二主成分得分系数的差异均达显著水平(P<0.05),土壤中环丙沙星wCIP≥0.01μg/g与对照组差异显著;第21天,第一主成分和第二主成分得分系数的差异均达显著水平(P<0.05),土壤中环丙沙星wCIP≥1μg/g与对照组差异显著;第35天,第一主成分得分系数的差异达显著水平(P<0.001),土壤中环丙沙星wCIP=100μg/g与对照组在主成分1上差异显著。
2.5 不同处理土壤微生物对6类碳源的利用率
试验用31种碳源可分为6类,对6类碳源分别计算,其平均吸光值可直接反映土壤微生物对不同碳源的利用率。第21天,各组的土壤微生物对6类碳源的利用情况存在差异(表2)。药物处理组碳水化合物、羧酸、氨基酸、聚合物、酚类和胺类的平均吸光值均低于对照组,100μg/g组土壤微生物对6类碳源的平均吸光值均与对照组差异显著。

图3 不同浓度环丙沙星处理下土壤微生物群落利用碳源的强度Fig.3 Carbon metabolic intensity of soil microbial communities for each treatment

图4 处理后7d土壤微生物群落主成分分析Fig.4 Principal components analysis on soil microbial communities from different treatments after 7 days

表2 处理后21d土壤微生物对6类碳源的平均吸光值Table2 Average well color development of soil microbes from six carbon sources after 21 days
3 讨论
土壤微生物是土壤养分循环的推动力,土壤中的一系列过程以碳、氮循环为中心,土壤微生物量碳是评价微生物量和活性参数的重要指标,也是评价土壤碳库平衡和土壤化学、生物化学肥力保持的重要指标。试验结果表明,环丙沙星(wCIP≥0.1μg/g)使土壤微生物量碳含量显著降低,环丙沙星是通过干扰菌体DNA的复制而发挥特异性抗菌作用,对静止期和生长期的细菌均有效,对支原体、大肠杆菌、巴氏杆菌、丹毒丝菌、沙门氏菌、葡萄球菌、链球菌、绿脓杆菌、克雷伯氏菌、弯曲杆菌、气单胞菌属、嗜血杆属、弧菌属、变形杆菌、布氏杆菌等均有良好的抗菌作用,对部分真菌和放线菌也有抑制作用。环丙沙星使土壤微生物的数量和活性大大降低,所以土壤微生物量碳也减少。
试验结果表明,土壤中环丙沙星浓度愈大土壤微生物利用碳源的能力愈低,微生物群落碳代谢功能多样性也愈低。0.1、1、10μg/g的环丙沙星处理对土壤微生物群落代谢功能的影响主要体现在用药第7天、21天,100μg/g的环丙沙星处理在用药7、21、35d均显著影响土壤微生物群落。实验结果与恩诺沙星对土壤微生物的碳源利用及代谢功能多样性影响的结果一致[17],用药3、14d,恩诺沙星含量0.1—100μg/g使土壤微生物群落代谢功能多样性显著降低(P<0.05);第35天,恩诺沙星含量10—100μg/g使土壤微生物群落代谢功能多样性显著降低。原因是多方面的,首先,土壤是一个复杂的生态体系,任何一个生态系统的发展变化都是多因素综合作用的结果,各种理化因子如土壤含水量、温度、pH值、有机质、无机质等均能对环丙沙星的稀释、水解、氧化等降解作用有一定影响;其次,各种矿物质尤其是Mg2+、Ca2+等金属离子可与环丙沙星发生鳌合,加上土壤对药物的吸附作用不利于药物的解离,致使土壤中实际药物浓度降低[18];另外,土壤中微生物、原虫等土壤生物种类繁多,有些微生物对环丙沙星不敏感,所以微生物也能降解土壤中的环丙沙星,从而逐渐恢复土壤微生物生态平衡。因此,低浓度药物组的土壤微生物群落碳代谢功能多样性与对照组之间的差异变得不显著。但环丙沙星化学性质稳定,在环境中降解缓慢[19],污水处理厂污泥中环丙沙星的含量达1.96 mg/kg,将这种污泥施入土壤8个月后,环丙沙星含量为0.32 mg/kg,21个月后含量为0.3 mg/kg[20],如果药物在土壤中长期残留,其对生态环境的影响不容忽视。
金彩霞[3]等研究了环丙沙星对作物发芽的生态毒性效应,环丙沙星抑制小麦、白菜、番茄的种子发芽率、根伸长和芽伸长,本研究表明环丙沙星影响土壤微生物量碳和微生物群落碳代谢多样性。兽药进入生态环境后,不仅对陆生植物、土壤微生物造成影响,还影响土壤动物、原生生物,以及水生生物中的浮游类生物、微生物、鱼虾及水体甲壳动物等[21-23]。为了确保生态环境安全,应加强兽药安全使用,结合兽药暴露与效应两方面进行环境风险评估尤其重要[24]。
4 结论
环丙沙星对土壤微生物量碳和微生物群落碳代谢多样性有明显的抑制作用,且随药物浓度的增高而影响加大。本研究结果表明,环丙沙星(wCIP≥0.1μg/g)显著降低土壤微生物量碳含量、土壤微生物对各类碳源的利用率、土壤微生物碳代谢强度和代谢多样性,其中100μg/g的环丙沙星处理影响最大,使土壤微生物量碳下降58.69%,土壤微生物利用单一碳源能力降低56.56%—78.94%。同时,环丙沙星对土壤微生物群落碳代谢多样性的抑制作用还表现出时间差异,0.1、1、10μg/g的环丙沙星处理对土壤微生物群落碳代谢功能的影响主要表现在处理前期(用药第7天、21天),这种影响在处理后期(用药第35天)表现不明显,100μg/g的环丙沙星在用药的前期和后期均显著影响土壤微生物群落碳代谢功能。
致谢:本研究在中国科学院生态环境研究中心城市与区域生态国家重点实验室完成,谨致谢忱。
[1]Xiao Y,Chang H,Jia A,Hu J Y.Trace analysis of quinolone and fluoroquinolone antibiotics from wastewaters by liquid chromatographyelectrospray tandem mass spectrometry.Journal of Chromatography A,2008,1214(1/2):100-108.
[2]Tai Y P,Mo CH,Wu X L,Li Y W,Wang J Y,Sun Q Y,Huang X P.Occurrence of quinolone antibiotics in soils from vegetable fields of Dongguan City.Acta Scientiae Circumstantiae,2011,31(4):839-845.
[3]Sehwarzenbaeh R P,Gschwend PM,Imboden D M.Environmental Organic Chemistry.New York:John Wiley and Sons,2003:681-681.
[4]Jin CX,Chen Q Y,Liu J J,Zhou Q X.The eco-toxicological effect of two common veterinary drugs on crop germ inaction.Acta Scientiae Circumstantiae,2009,29(3):619-625.
[5]Isam H,Domsch K H.Relationship between soil organic carbon and microbial biomass on chronosequencse of reclamation sites.Microbial Ecology,l988,15(2):177-188.
[6]Preston-Matham J,Boddy L,Randerson P F.Analysis of microbial community functional diversity using sole-carbon-source utilization profiles-a critique.FEMSMicrobiology Ecology,2002,42(1):1-14.
[7]Zhao N,Lin W P,Cai K Z,Wang J W.Impacts of livestock waste compost on tomato bacterial wilt,soil enzyme activity and soil microbial functional diversity.Acta Ecologica Sinica,2010,30(19):5327-5337.
[8]Bossio D A,Scow K M.Impact of carbon and flooding on the metabolic diversity of microbial communities in soils.Applied and Environmental Microbiology,1995,61(11):4043-4050.
[9]Gmyston SJ,Wang SQ,Campbell CD,Edwards A C,Wang SQ.Selective influence of plant species on microbial diversity in the rhizosphere.Soil Biology and Biochemistry,1998,30(3):369-378.
[10]Chen F L,Zheng H,Yang B S,Ouyang Z Y,Zhang K,Xiao Y,Tu N M.The decomposition of coniferous and broadleaf mixed litters significantly changes the carbon metabolism diversity of soil microbial communities in subtropical area,southern China.Acta Ecologica Sinica,2011,31(11):3027-3035.
[11]Wu J S,Lin Q M,Huang Q Y,Xiao H A.Soil Microbial Biomass Determination and Its Applications.Beijing:Meteorological Press,2006:65-74.
[12]Schutter M,Dick R.Shifts in substrate utilization potential and structure of soil microbial communities in response to carbon substrates.Soil Biology and Biochemistry,2001,33(11):1481-1491.
[13]Garland J L,Mills A L.Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level solecarbon-source-utilization.Applied and Environmental Microbiology,1991,57(8):2351-2359.
[14]Guckert JB,Carr G J,Johnson T D,Hamm B G,Davidson D H,Kumagai Y.Community analysis by biolog:curve integration for statistical analysis of activated sludge microbial habitats.Journal of Microbiological Methods,1996,27(2/3):183-197.
[15]Rogers BF,Tate R LⅢ.Temporal analysis of the soil microbial community along a toposequence in Pineland soils.Soil Biology and Biochemistry,2001,33(10):1389-1401.
[16]Zabinski CA,Gannon J E.Effects of recreational impacts on soil microbial communities.Environmental Management,1997,21(2):133-238.
[17]Ma Y,Chen Z L.Effects of enrofloxacin on the functional diversity of soil microbial communities.Asian Journal of Ecotoxicology,2010,5(3):446-452.
[18]Johannes T.Sorption of veterinary pharmaceuticals in soils:a review.Environmental Science and Technology,2001,35(17):3397-3406.
[19]Li X,Chen J F,Nie X P,Lin J F,Zhou X Z.Degradation and residue of ciprofloxacin in different simulated water bodies.Acta Scientiarum Naturalium Universitatis Sunyaseni,2010,49(3):102-106.
[20]Golet E M,Strehler A,Alder A C,Giger W.Determination of fluoroquinolone antibacterial agents in sewage sludge and sludge-treated soil using accelerated solvent extraction followed by solid-phase extraction.Analytical Chemistry,2002,74(21):5455-5462.
[21]Liu F,Ying G G,Tao R,Zhao J L,Yang J F,Zhao L F.Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities.Environmental Pollution,2009,157(5):1636-1642.
[22]Santos L H,Araújo A N,Fachini A,Pena A,Delerue-Matos C,Montenegro M C.Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment.Journal of Hazardous Materials,2010,175(1/3):45-95.
[23]Migliorel L,Godeas F,Stefania P D F,Mantovi P,Barchi D,Testa C,Rubattu N,Brambilla G.Hormetic effect(s)of tetracyclines as environmental contaminant on Zea mays.Environmental Pollution,2010,158(1):129-134.
[24]Dong Y Y,Zhang Y,Cao Y,Qiao X L.Environmental risk analysis for three pharmaceuticals in the effluent from sewage treatment in Dalian economic development zone.Journal of Wuhan University:Natural Science Edition,2009,55(3):310-314.
参考文献:
[2] 邰义萍,莫测辉,吴小莲,李彦文,王纪阳,苏青云,黄献培.东莞市蔬菜基地土壤中喹诺酮类抗生素的污染特征研究.环境科学学报,2011,31(4):839-845.
[4] 金彩霞,陈秋颖,刘军军,周庆祥.两种常用兽药对作物发芽的生态毒性效应.环境科学学报,2009,29(3):619-625.
[7] 赵娜,林威鹏,蔡昆争,王建武.家畜粪便堆肥对番茄青枯病、土壤酶活性及土壤微生物功能多样性的影响.生态学报,2010,30(19):5327-5337.
[10] 陈法霖,郑华,阳柏苏,欧阳志云,张凯,肖燚,屠乃美.中亚热带几种针、阔叶树种凋落物混合分解对土壤微生物群落碳代谢多样性的影响.生态学报,2011,31(11):3027-3035.
[11] 吴金水,林启美,黄巧云,肖和艾.土壤微生物生物量测定方法及其应用.北京:气象出版社,2006:54-60.
[17] 马驿,陈杖榴.恩诺沙星对土壤微生物群落代谢功能多样性的影响.生态毒理学报,2010,5(3):446-452.
[19] 李霞,陈菊芳,聂湘平,林建锋,周孝治.盐酸环丙沙星在不同模拟水体中的降解与残留.中山大学学报:自然科学版,2006,12(1):36-43.
[24] 董玉瑛,张阳,曹瑛,乔显亮.大连经济开发区污水处理中3种医药品的环境风险分析.武汉大学学报:理学版,2009,55(3):310-314.

