酪丝缬肽的结构修饰及其稳定性和安全性的初步评价*
陈 鹏,吴 弄,国翠平,蔡绍晖,陈河如,3
(1.暨南大学药学院中药及天然药物研究所,广东广州 510632;2.暨南大学药学院药理教研室,广东广州 510632;3.广东省中药药效物质基础及创新药物研究重点实验室,广东广州 510632)
近年来,癌症的化学治疗取得了长足的进步,癌症患者的生存指数明显提高。但目前临床常用的抗肿瘤化学药物,如阿霉素、顺铂、紫杉醇、长春新碱等,由于药物本身毒性较强,缺乏靶向性,在杀伤癌细胞的同时亦不可避免地损伤机体的正常组织及细胞,限制了此类化疗药物的临床应用。因此,对现有药物进行靶向设计以降低其系统毒性或者寻找具有新作用机制的抗癌药物成为药物学家选择的策略[1]。靶向设计的关键在于针对细胞癌变过程中的基因、受体和信号转导途径中关键酶的异常变化[2],使得药物能够特异性地导向这些靶标[3]。目前,靶向抗肿瘤药物的研究取得了许多重要进展[4],其中,针对成纤维激活蛋白α(FAPα)的靶向药物设计正成为一个热点研究领域[5]。研究表明,FAPα是特异表达于肿瘤相关成纤维细胞 (TAF)表面的一种抗原分子,在正常组织细胞中几乎不表达,对肿瘤的生长、转移、侵润起重要作用。FAPα能特异性识别N端由苄氧羰基(Cbz)保护的甘氨酸-脯氨酰片段 (Z-GP-),能特异性酶切包含 Z-GP-片段的底物,如 Z-GPAMC[6]。研究表明,利用Z-GP对药物分子的修饰,可以将药物靶向肿瘤组织[7]。
抗肿瘤多肽由于其独特的作用机制正受到越来越多的关注,已从植物、动物 (包括海洋生物)分离获得许多具有潜在抗癌活性的多肽[8]。本研究所针对的酪丝缬肽 (tyroservatide,YSV)由三个氨基酸组成,化学结构组成为L-酪氨酰-L-丝氨酰-L-缬氨酸,是从猪脾脏水解液中分离纯化并经过大量筛查后得到的非细胞毒性抗癌制剂。研究表明,酪丝缬肽可显著抑制非小细胞肺癌 (non small cell lung cancer,NSCLC)等多种肿瘤[9]。不过,跟许多多肽类药物一样,酪丝缬肽在血浆中迅速被肽酶水解[10],这成为制约其临床应用的一大瓶颈。本研究着眼于改善酪丝缬肽的稳定性,采取的策略是在YSV的N端引入Z-GP,同时将其C端转化为酰胺,合成途径见路线1。Z-GP的引入还包含着靶向FAPα的设计意图。
1 仪器与试剂
质谱在Finnigan LCQ Advantage MAX质谱仪(Thermo Finnigan公司,美国)上测定;紫外吸收在 ELISA reader(Bio-Rad Laboratories Inc.,USA)上检测,波长为490 nm;纯度分析及化合物分离纯化在伍丰LC-100型高效液相色谱仪 (伍丰,上海)上进行;CO2培养箱 (2323-2)购自SHELLA公司;医用净化工作台 (SW-CJ-2FD型)购自苏州净化设备有限公司;倒置显微镜 (TS-100)购自Nikon公司;多肽合成器等玻璃仪器购自欣维尔玻璃仪器公司。
N,N-二甲基甲酰胺 (DMF)和 二氯甲烷(DCM)经CaH2回流干燥,重蒸、保存于分子筛中备用;哌啶用K2CO3回流干燥后过滤,重蒸。NFmoc氨基酸、苄氧羰基甘氨酰脯氨酸 (Z-GPOH)、Wang-resin、Rink-amide resin、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸 (TBTU)和1-羟基苯并三唑 (HOBt)均购自上海吉尔生化;二异丙基乙胺 (DIPEA)、四氯苯醌、三氟醋酸 (TFA)均购自上海晶纯科技有限公司。所有树脂使用前真空干燥过夜;
293细胞 (人胚肾细胞)来自中山大学药学院杜军教授实验室;RPMI1640培养基、DMEM培养基、胎牛血清 (FBS)、胰蛋白酶为Gibico公司产品;四氮噻唑蓝 (MTT)、二甲基亚砜 (DMSO)为Sigma公司产品;青霉素 (100万单位)、链霉素 (160万单位)为Gibico公司产品;
2 实验方法
2.1 酪丝缬肽和Z-GP-酪丝缬-NH2的固相合成
1)通用步骤:线性多肽采用从C端到N端的合成。使用Wang-resin或 Rink amide resin(当需将C端羧基改造成酰胺基时使用);缩合过程所有的N-Fmoc保护氨基酸和缩合剂均三倍过量。首先称取0.2 g树脂 (树脂负载0.6 mmol/g)于多肽合成器中,加3 mL 20%DCM/DMF(V/V),摇床震摇40 min。然后用3 mL 20%piperidine/DMF(体积比)脱Fmoc保护基两次,每次15 min;随后分别用干燥的 DCM(3×5 mL)、甲醇 (3×5 mL)、DMF(3×5 mL)洗涤树脂。取少量树脂用1%乙醛/四氯苯醌检测,如呈阳性 (树脂变深蓝色),则继续下面的步骤;如呈阴性 (树脂不变色),则重复脱保护直至检测呈阳性。将缩合剂TBTU、HOBt和N-Fmoc保护氨基酸用3 mL干燥DMF溶解,通过注射器加入0.02 mL DIPEA,搅拌30 min,将混合液转移至多肽合成器中,震摇1.5 h;取少量树脂,用乙醛/四氯苯醌检测法检验树脂,如呈阳性(树脂变深蓝色),则继续缩合至树脂呈阴性;当树脂检测呈阴性 (树脂不变色)时,将合成器内的溶液排干,新鲜DMF洗涤3次 (3×5 mL),再依上述方法脱Fmoc保护基、洗涤,进行另一个氨基酸的缩合。依目标多肽的氨基酸序列重复脱Fmoc保护基、洗涤、缩合的操作,直至最后一个氨基酸缩合完成。然后分别用DMF(3×5 mL)、甲醇(3×5 mL)、DCM(3×5 mL)洗涤肽树脂,用N2吹干树脂,加入切肽液 TFA∶DCM∶H2O=9.2∶0.25∶0.55(体积比)避光切肽3 h,滤出并合并切肽液,用N2吹去大部分TFA,室温减压旋蒸抽除残留TFA,残留溶液冷冻干燥得粗肽。用RP-HPLC对粗肽进行分离纯化,收集目标产物峰,室温减压蒸除有机溶剂,残留水溶液经冷冻干燥得粗多肽。
粗多肽的分离纯化在伍丰LC-100半制备型高效液相色谱仪上进行,制备柱:Comosil C18MSII(20(250 mm),粒度:5 μm;检测波长:214 nm;流速:8.0 mL/min。
纯度分析在伍丰LC-100分析型高效液相色谱仪上进行,分析柱:Comosil C18MS-II(4.6(250 mm),粒度:5 μm;检测波长:214 nm;流速:1.0 mL/min。
2)酪丝缬肽 (YSV)的合成:Wang树脂0.2 g(0.12 mmol);缩合的氨基酸顺序依次为Fmoc-Val-OH、Fmoc-Ser(tBu)-OH 和 Fmoc-Tyr(tBu)-OH;用于分离纯化和分析的洗脱剂:30%φ(甲醇)/0.1%φ(TFA)蒸馏水;得白色固体化合物20.3 mg,总收率45.3%;纯度98.8%;ESIMS(m/z):368.27[M+H]+,calc for C17H25N3O6+H:368.26。
3)苄氧羰基甘氨酰脯氨酰酪丝缬酰胺 (ZGP-YSV-NH2)的合成:Rink amide树脂 0.2 g(0.12 mmol);缩合的氨基酸顺序依次为Fmoc-Val-OH、Fmoc-Ser(tBu)-OH、Fmoc-Tyr(tBu)-OH和Z-GP-OH;用于分离纯化和分析的洗脱剂:50%φ(甲醇)/0.1%φ(TFA)蒸馏水;得白色固体化合物42.2 mg,总收率52.3%;纯度98.0%;ESIMS(m/z):677.53 [M+Na]+,calc for C32H42N6O9+Na:677.29;HR-ESI-MS(m/z):655.30877[M+H]+,calc for C32H42N6O9+H:655.3086。
2.2 稳定性实验
取大鼠静脉血,经高速离心 (15 000 r/min×15 min),取上清液,得大鼠血浆。PBS缓冲溶液、DMEM培养基均按标准配制。
将多肽用甲醇配成浓度为200 μg/mL的甲醇溶液,取 0.25 mL溶液分别与 0.25 mL PBS、DMEM、血浆混合,涡旋5 min,于37℃条件下温浴。分别于0、0.5、1、2、4、12 h时间点取样进行RP-HPLC分析,考察样品在3种介质中的浓度随时间变化的情况。每个实验重复3次,并与标准样品及空白实验做比较。
2.3 对293细胞的毒性实验
分别取10 mg的YSV和Z-GP-YSV-NH2溶于0.1 mL DMSO中,制成100 mg/mL的储存液,于4℃保存备用。实验时按半倍稀释法配制成200、100、50、25、12.5、6.25 μg/mL剂量组,同时每个质量浓度含有w=2‰的DMSO。
MTT溶液的配置:称取250 mg MTT粉末溶于50 mL PBS缓冲液中,磁力搅拌使MTT粉末完全溶解混匀后,0.22 μm微孔滤膜过滤除菌,于4℃冰箱避光保存备用。
实验组与对照组每组设6个复孔。取处于指数生长期的293细胞株配成4×104/mL的细胞悬液,加入96孔板,100 μL/孔,于37℃、φ=5%CO2条件下培养24 h,按照剂量分组分别加YSV和ZGP-YSV-NH2。阴性对照组加 RPMI1640培养基,给药体积为150 μL,溶媒对照组加RPMI1640培养基和2‰的DMSO,给药体积为150 μL,在37℃、φ=5%CO2条件下培养48 h之后取出,加MTT工作液20 μL/孔,混匀后置37℃、φ=5%CO2培养箱内继续培养4 h,取出后小心去上清液,加DMSO 150 μL/孔,室温振荡10 min,使其充分溶解,用酶标仪在490 nm波长条件下测其A值,按以下公式计算存活率。

实验数据用表示,均采用SPSS11.0软件进行处理,多组样本数据用单因素方差分析,组间比较应用t检验,以P<0.05为有统计学差异。
3 结果与讨论
3.1 酪丝缬肽及结构改造物的固相合成
酪丝缬肽 (YSV)及结构改造物苄氧羰基甘氨酰脯氨酰酪丝缬酰胺 (Z-GP-YSV-NH2)的合成采用Fmoc/tBu固相多肽合成法 (见路线1)。由于YSV的C端是羧基,所以采用Wang树脂;而ZGP-YSV-NH2的C端为酰胺,故此采用Rink amide树脂。Wang树脂与第一个氨基酸通过酯键连接,而Rink amide树脂与第一个氨基酸通过酰胺键结合。酯键比较不稳定,容易在缩合过程中断裂,使得合成收率降低。因此,YSV虽然是个三肽,但其总收率只有45.3%,低于Z-GP-YSV-NH2的合成总收率 (52.3%),估计与酯键的不稳定性有关。
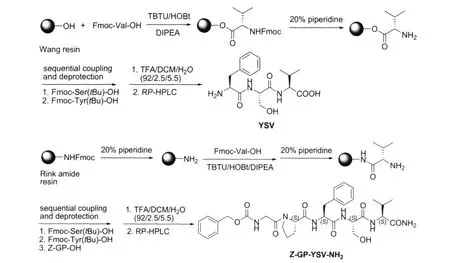
图1YSV和Z-GP-NH2的固相合成 (路线1)Fig.1 Solid phase synthesis of YSV and Z-GP-YSV-NH2(Scheme 1)
缩合过程中,Fmoc保护基的脱除用体积比为20%的哌啶 DMF溶液,一般处理两次以保证100%的脱除。在缩合反应、脱Fmoc和检测步骤中,树脂的洗涤至关重要,如果树脂洗涤不干净,不仅会影响反应的产率,还会影响树脂检测结果的判断。本实验注意到,树脂检测时,若树脂没有洗干净,则滴加φ=1%乙醛/四氯苯醌后,溶液都变成深色,难以判断树脂是否变色。因此,本实验根据树脂在不同溶剂中溶胀率不同,采用 DMF、DCM和甲醇交替洗涤的方法,使得残留在树脂内部的过量试剂、污染物能够有效地清洗出来,从而使得多肽合成能够更为顺利地进行。
3.2 YSV和Z-GP-NH2的稳定性比较
本文分别考察了YSV和Z-GP-YSV-NH2在PBS缓冲液、DMEM培养基和大鼠血浆中的稳定性,结果见图1。实验发现,YSV和Z-GP-YSV-NH2在PBS缓冲液和DMEM培养基中都相当稳定 (A1/B1和A2/B2),样品在37℃温浴12 h,没有观察到样品峰面积有明显的变化,表明待测物在介质中没有被降解。然而,酪丝缬肽在大鼠血浆中不稳定,温浴1 h,样品峰面积减少了50%,显示有一半的YSV被降解;温浴2 h后,YSV样品峰完全消失 (A3)。
相比而言,Z-GP-YSV-NH2在大鼠血浆中比较稳定,样品在血浆中温浴12 h后还能够检测到样品峰,峰面积为起始状态样品峰面积的33%,只降解了67%(B3)。可见,YSV经过结构修饰后,在血清中的稳定性增强,意味着Z-GP-YSV-NH2在体内可能有比YSV更好的耐受性。
其中A1、A2、A3分别为YSV在PBS、DMEM和大鼠血清中样品质量浓度随时间变化的HPLC图谱;B1、B2、B3分别为 Z-GP-YSV-NH2在 PBS、DMEM和大鼠血清中样品质量浓度随时间变化的HPLC图谱;时间长度:12 h;温浴温度:37℃;样品质量浓度:100 μg/mL
3.3 YSV和Z-GP-NH2对293细胞的毒性
293细胞是人胚肾细胞,本文利用该细胞株评价YSV和Z-GP-YSV-NH2对人正常细胞的毒性。实验结果表明,YSV和Z-GP-YSV-NH2对293细胞的毒性比较低 (见图2)。即使当质量浓度为200 μg/mL时,YSV对293细胞的增殖抑制率只有20%;而Z-GP-YSV-NH2更低,为10.3%。显然,YSV经结构修饰后并没有引起细胞毒性的增加,相反还略有降低,说明与YSV一样,Z-GP-YSVNH2在体内的安全性比较高。更真实的情况还有待动物毒性实验加以验证。

图2 YSV和Z-GP-YSV-NH2在PBS、DMEM和大鼠血浆中的稳定性Fig.2 Stabilities of YSV and Z-GP-YSV-NH2 in PBS buffer,DMEM culture and rat serum

图3 YSV和Z-GP-YSV-NH2对人胚肾293细胞的增殖抑制作用Fig.3 The growth inhibition of YSV and Z-GP-YSV-NH2 to human renal cell 293
综上所述,本实验通过固相多肽合成的方法成功合成了酪丝缬肽以及其结构修饰物Z-GP-YSVNH2,总收率分别为45.3%和52.3%。修饰后的YSV在大鼠血浆中更为稳定,而且对正常细胞的毒性略有下降,揭示Z-GP-YSV-NH2比YSV在临床上有更好的应用前景。有关Z-GP-YSV-NH2对肿瘤细胞株的增殖抑制作用、作用机理以及是否有靶向性正在进一步研究中。
[1]CHEN Y,HU L Q.Design of anticancer prodrugs for reductive activation [J].Medicinal Research Reviews,2009,29(1):29-64.
[2]郑杰.做好靶向病理诊断夯实靶向治疗的基础[J].中华病理学杂志,2007,36(7):433-436.
[3]HU L Q.Prodrugs:Effective solutions for solubility permeability and targeting challenges[J].Drugs,2004,7(8):736-742.
[4]颜琪,郭静,冯聪敏,等.靶向抗肿瘤药物研究进展[J].生物技术通报,2012,8:40-45.
[5]方瑞,杜军,陈宏远,等.成纤维细胞激活蛋白α与肿瘤的靶向治疗[J].中国生物工程杂志,2008,28(3):100-105.
[6]AERTGEERTS K,LEVIN I,SHI L,et al.Structural and kinetic analysis of the substrate specificity of human fibroblast activation protein alpha[J].J Biol Chem,2005,280:19441-19444.
[7]HUANG S,FANG R,XU J,et al.Evaluation of the tumor targeting of a FAPα-based doxorubicin prodrug[J].J Drug Targeting,2011,19(7):487-496.
[8]SUAREZ-JIMENEZ G M,BURGOS-HERNANDEZ A,EZQUERRA-BRAUER J M.Bioactive peptides and depsipeptides with anticancer potential:Sources from marine animals[J].Mar Drugs,2012,10:963 -986.
[9]贾晋斌,王文权,林刚.新型抗癌药酪丝亮肽和酪丝缬肽的研究进展[J].中国新药与临床杂志,2009,28(6):401-404.
[10]DING W,ZHANG J,YAO Z,et al.The synthesis,distribution,and anti-hepatic cancer activity of YSL[J].Bioorg Med Chem,2004,12(18):4989-4994.

