正交设计优化广西火桐ISSR-PCR反应体系
代文娟 骆文华 马虎生 符支宏,2 唐文秀 赵博 盘波 黄仕训
广西火桐(Erythropsis kwangsiensis)为梧桐科、火桐属(Erythropsis)植物,中国特有种,仅分布于广西中部至南部的石灰岩地区,对研究植物区系和植物地理及亲缘关系等均有重要的学术价值。野生资源量极少,具有重要的经济价值和科研价值,为国家二级重点保护植物[1]。
简单序列重复区间(Inter-simple sequence repeat,ISSR)是一种基于SSR的简单重复序列区间扩增多态性分子标记[2],它结合了SSR和RAPD的优点,主要特点是操作简单,遗传多态性高,重复性好,耗资少,模板DNA用量少。因此,ISSR标记技术广泛应用于植物遗传多样性的研究[3-6]。
目前,尚未见利用ISSR对广西火桐进行遗传分析的报道。为了确保ISSR分析结果的可靠性和重复性,对ISSR-PCR反应体系进行优化非常必要。本试验利用正交设计对广西火桐ISSR-PCR反应中的MgCl2浓度、dNTPs浓度、Taq DNA聚合酶浓度、模板DNA浓度进行系统的研究,并探讨退火温度和反应循环次数对ISSR-PCR的影响,以期建立稳定且重复性好的广西火桐ISSR-PCR反应体系。
1 材料与方法
1.1 材料
1.1.1 试验材料 广西火桐材料取自广西植物研究所内10 株成年植株的当年生嫩叶。
1.1.2 试 剂 Buffer、MgCl2、dNTPs、Taq DNA 聚合酶等均购于上海生物工程有限公司,ISSR引物由上海生物工程有限公司合成;经初步筛选将引物U835[(Ag)8YC]作为此次正交试验的引物。
1.2 方法
1.2.1 总DNA的提取 利用植物基因组DNA提取试剂盒(离心柱型)(上海捷瑞生物工程有限公司)进行DNA的提取,操作步骤参照说明。
1.2.2 ISSR-PCR反应体系的正交试验设计与PCR扩增采用 L16(44)正交试验设计,对 MgCl2、dNTPs、Taq DNA聚合酶、模板DNA进行4因素4水平筛选,方案如表1所示。表中共有16个处理,每个处理做2个重复,共32管,按表中的数据加样。在Biometra TProfessional PCR仪(华粤企业集团有限公司)上进行扩增。反应体系为25μL,除表中所列因素外,每管还有1× PCR buffer。根据文献资料[7,8],初步确定 ISSR-PCR 扩增程序为 :94℃预变性5min;94℃变性45s,50℃退火45s,72℃延伸1.5min,共35个循环;72℃最后延伸7min。扩增后的PCR产物在4℃保存。
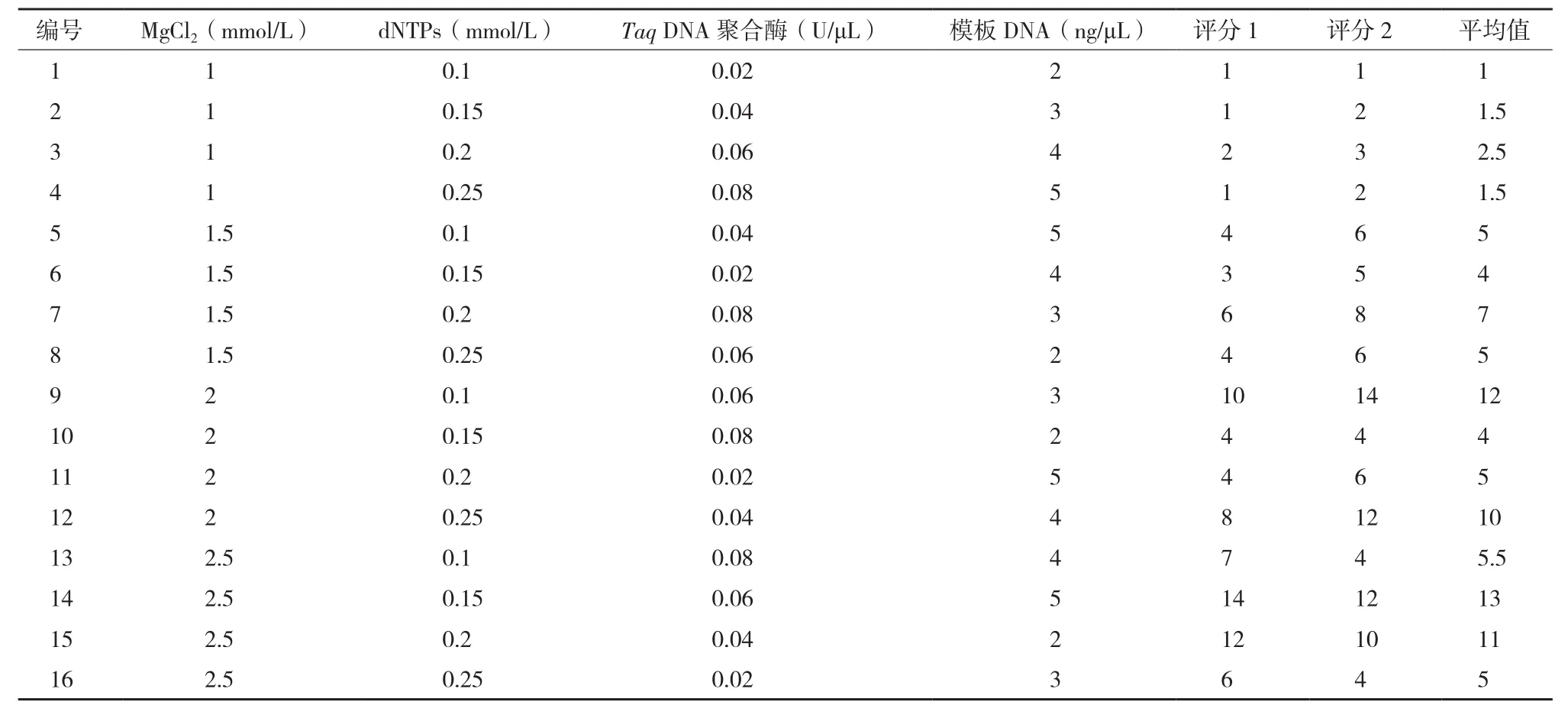
表1 ISSR-PCR反应体系的正交试验设计[L16(44)]
1.2.3 温度梯度PCR 在PCR梯度扩增仪上设置最小退火温度为45℃,最大为60℃,PCR仪自动形成8个梯度,即45℃、45.9℃、48℃、50.8℃、54.5℃、57.5℃、59.1℃、60℃每个梯度设3次重复。PCR反应体系根据正交试验的结果而定,扩增程序除退火温度外,其余同1.2.2。
1.2.4 循环次数的确定 设置25、30、35、40、45这5个不同循环次数,PCR反应体系和扩增程序中的退火温度分别根据正交试验和温度梯度PCR试验结果而定,其余同1.2.2。
1.2.5 ISSR-PCR产物的检测 扩增反应结束后,10μL上样液含1μL GelGreen核酸染料在1%琼脂糖凝胶中电泳60min,电压设定为120V,于生物电泳图像分析系统(美国UVP)成像分析系统拍照记录。
2 结果
2.1 正交设计的结果
2.1.1 各因素对PCR反应影响的差异 L16(44)正交设计的试验和PCR扩增结果,见图1。根据电泳条带数、亮度和背景对每个处理进行评分,并将结果计入表1中。图1显示第9、14和15组条带明亮、背景清晰、数量较多。其余组合或没有条带,或条带较暗、数量少,或背景模糊。因此,第9、14、15组的评分较高,第1、2、4组的评分较低。对重复处理的PCR电泳结果评分2计入表1,其结果与第1次PCR扩增结果高度一致。对16个处理评分结果进行极差分析,各因素对反应体系的影响从大到小依次为MgCl2、模板DNA、Taq DNA聚合酶、dNTPs(表2);各个因素的最佳反应水平分别为:MgCl2为第4个水平,dNTPs为第3个水平,Taq DNA聚合酶为第3个水平,模板DNA为第2个水平。最佳组合为MgCl2为2.5mmol/L,dNTPs为0.2mmol/L,Taq DNA 聚合酶为 0.06U/μL,模板 DNA为3ng/μL。但这一组合在正交表中并没有出现,与分值较高的两个组合(第14组和第15组)较接近。

图1 ISSR-PCR正交试验结果
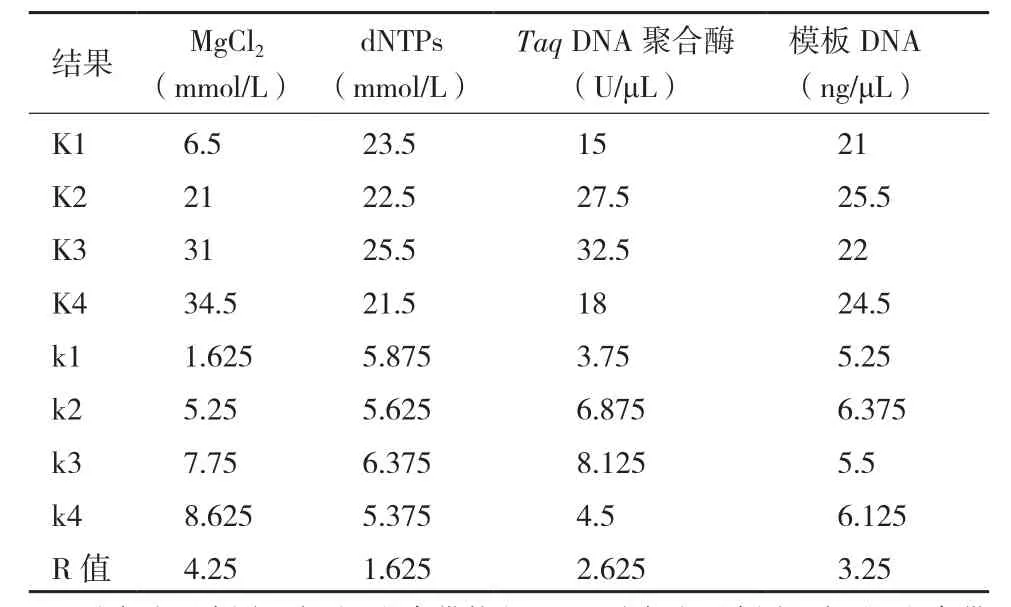
表2 ISSR-PCR正交试验结果极差分析
为了弥补极差分析的缺陷,用DPS 9.50统计软件对结果进行了方差分析。结果(表3)显示,各因素对广西火桐ISSR-PCR反应的影响程度从大到小依次为:MgCl2、TaqDNA聚合酶、模板DNA、dNTPs。其中,模板DNA浓度、dNTPs对结果的影响未达到显著水平;Taq DNA聚合酶对结果的影响都达到了显著水平,MgCl2对结果的影响都达到了极显著水平,所以还应对MgCl2和Taq DNA聚合酶进行水平间的多重比较。
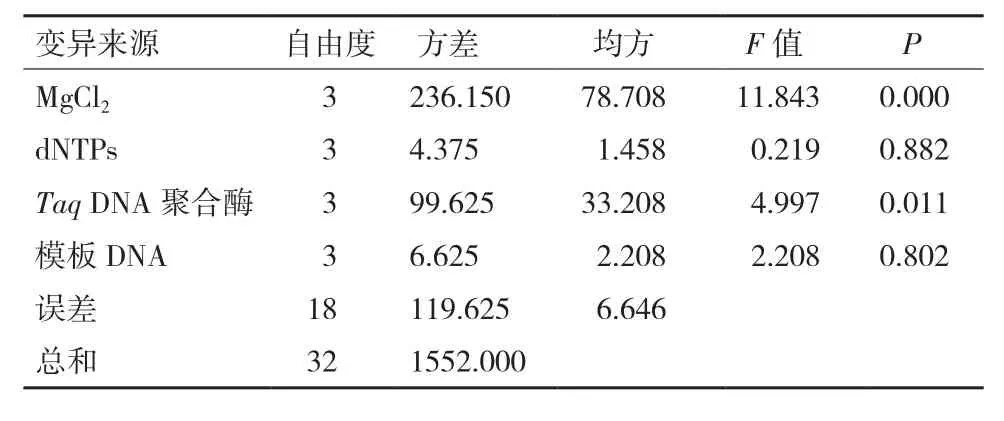
表3 ISSR-PCR正交试验结果方差分析
2.1.2 各因素不同水平间多重比较 随着MgCl2浓度从1.0-2.5mmol/L增加,扩增结果均值由小变大,当增加到2.5mmol/L时均值最大(图2),且与其他3个水平之间差异均达到极显著水平。因此,MgCl2最佳浓度为2.5mmol/L。
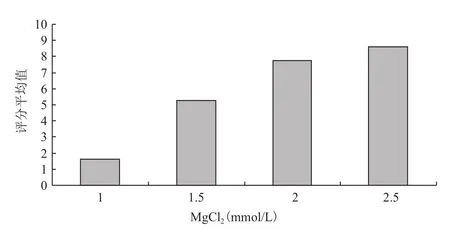
图2MgCl2浓度与评分结果均值的关系
dNTPs浓度从0.1-0.25mmol/L(图3),扩增结果均值没有规律变化,在0.20mmol/L时均值最大,且与其他3 个水平之间的差异达到极显著水平。
TaqDNA聚合酶浓度从0.02-0.08U/μL,扩增结果均值先增大后减小,在0.06U/μL时均值最高,0.02U/μL时均值最低(图4),且与其他3个水平之间的差异均达到极显著水平。
随着DNA模板浓度增大(图5),扩增结果均值无规律变化,当浓度为2ng/μL时均值最低,为3ng/μL时均值最高,且与其他3个水平之间差异达到极显著水平。
2.2 退火温度的确定
图6中,各个退火温度均能扩增出产物,且背景清晰。但若退火温度过低,特异性差,有些主带不明显,见图6中的泳道1(45℃)、泳道2(45.9℃)、泳道3(48℃);退火温度过高,引物与模板的特异性增强,造成多态性偏低,扩增产物较少或谱带亮度相对较弱,如图6 中的泳道6(57.5℃)、泳道7(59.1℃)、泳道8(60℃);合适的退火温度,即泳道4(50.8℃)和泳道5(54.5℃)扩增产物多态性高,条带清晰明亮,背景清晰。故本试验以52℃为ISSR-PCR扩增的最佳退火温度。
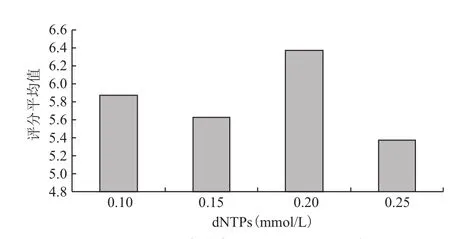
图3 dNTPs浓度与评分结果均值的关系
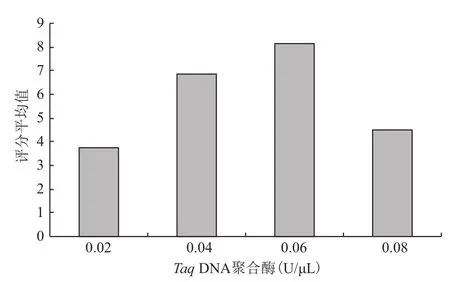
图4 Taq DNA聚合酶浓度与评分结果均值的关系
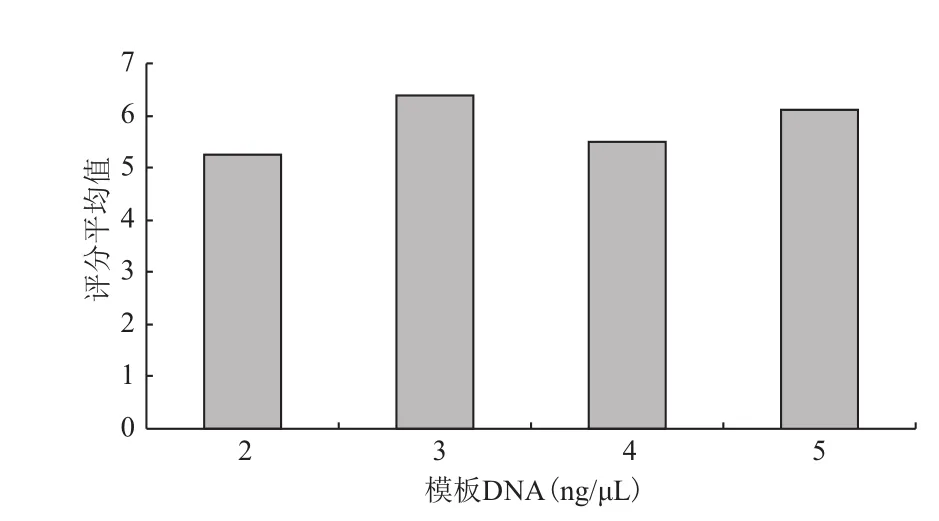
图5 DNA模板浓度与评分结果均值的关系
2.3 循环次数的确定
根据正交试验结果所得的最佳反应体系,在最适退火温度下,对PCR循环数进行梯度试验,设置5 个梯度,结果如图7所示。当循环次数为30时能得到清晰稳定且丰富的条带,而其他循环次数的扩增产物有所减少,背景模糊,有些条带较弱甚难辨读。因此,30个循环是该反应体系的最佳循环次数。
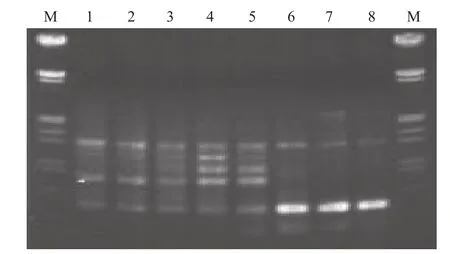
图6 温度梯度PCR电泳图(UBC857)
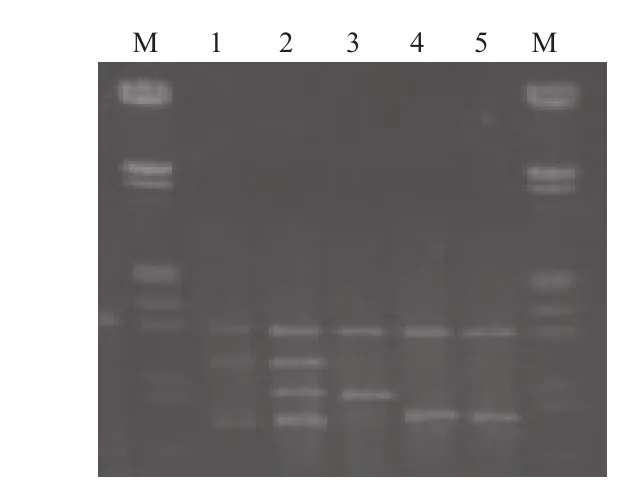
图7 循环次数试验
2.4 ISSR-PCR反应体系稳定性
用UBC835引物对10份广西火桐DNA用优化后ISSR-PCR体系及扩增程序进行扩增,结果显示(图8),扩增谱带明亮,背景清晰,稳定性好,多态性丰富,表明该反应体系和反应程序稳定性、重复性较好,适合于广西火桐进行ISSR-PCR反应。
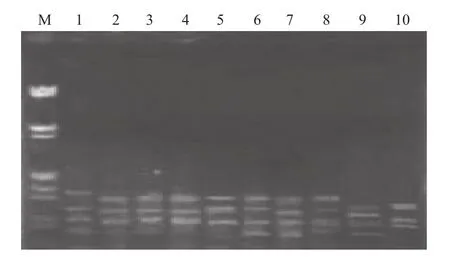
图8 引物U835在10份广西火桐样品中的ISSR扩增结果
3 讨论
影响ISSR反应体系的因素包括MgCl2浓度、dNTPs浓度、Taq DNA聚合酶浓度等。研究表明,MgCl2浓度对PCR反应影响较大,不仅影响Taq DNA聚合酶的活性,也影响 PCR 产物的解链温度、产物的特异性、模板与引物的结合等[9]。过量的MgCl2会导致酶催化非特异性产物的扩增,而浓度过低,又使酶的催化活性降低。本试验中,MgCl2浓度为2.5mmol/L时扩增效果最佳。dNTPs作为PCR反应的原料,浓度太低会使扩增反应不完全,从而降低PCR产物的产量;浓度过高会对MgCl2产生抑制作用,影响Taq DNA酶活力,造成浪费[10]。试验结果显示,dNTPs浓度为0.2mmol/L时,扩增得到的条带数量和质量均较理想。Taq DNA聚合酶浓度过高或过低都会影响扩增的结果。本试验中,0.06U/μL的Taq DNA聚合酶浓度最佳。PCR反应对模板DNA用量要求的范围通常较广,在60-100ng内均可获得较好的扩增效果[11,12]。但为避免DNA中杂质对试验的影响,应尽可能采用较低的模板浓度进行扩增。因此,本试验中的DNA用量为3ng/μL。综合以上分析和经济因素,选择第14组合作为广西火桐ISSR-PCR反应的最佳体系。
引物的理论退火温度(Tm值)和通过试验选出的最适退火温度并无明显规律性[13,14],试验结果支持这一观点。本试验中选用引物U835的理论退火温度为56℃, 但试验结果显示52℃是最佳退火温度。
循环次数决定产量,循环次数偏少,产物扩增不完全,条带不明亮;循环次数偏多,错配几率增加,非特异性产物增多,条带易弥散。此外,循环次数还受各反应成分的用量限制。通过试验,广西火桐ISSR-PCR反应的最佳循环次数为30。
4 结论
广西火桐的ISSR-PCR反应体系最佳扩增反应条 件 为 :25μL 体 系 中 1×PCR buffer,2.5mmol/L MgCl2,0.15mmol/L dNTPs,0.06U/μL Taq DNA 聚合酶,3ng/μL DNA模板,0.2μmol/L引物。适合广西火桐的最佳扩增程序为:94℃预变性5min;94℃变性 45s,52℃退火45s,72℃延伸 1.5min,共30个循环;72℃最后延伸7min。
[1]国家林业总局, 农业部.国家重点保护野生植物名录(第一批)[J].植物杂志 , 1999(5):4-11.
[2]Zietkiewicz E, Rafslski A, Labuda D. Genome Fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20:176-183.
[3]张杰, 吴迪, 汪春蕾, 等.应用ISSR-PCR分析蒙古栎种群的遗传多样性[J].生物多样性, 2007, 15(3):292-299.
[4]彭云滔, 唐绍清, 李伯林, 等.野生罗汉果遗传多样性的ISSR分析[J].生物多样性, 2005, 13(1):36-42.
[5]宾晓芸, 唐绍清, 周俊亚, 等.金花茶遗传多样性的ISSR分析[J].武汉植物学研究, 2005, 23(1):20-26.
[6]周俊亚, 唐绍清, 向悟生, 等.栽培罗汉果遗传多样性的ISSR分析[J].广西植物 , 2005, 25(5):431-436.
[7]代文娟, 唐文秀, 邓涛, 等.正交设计优化狭叶坡垒ISSR-PCR反应体系[J]. 中国农学通报, 2011, 27(18):143-147.
[8]张永夏, 刘晓, 黎科, 等.珍稀植物杨叶肖槿ISSR体系建立及检测[J].西北植物学报, 2012, 32(4):829-834.
[9]史云峰, 禹利君, 刘仲华, 等.皱边石杉内生真菌 ISSR-PCR 反应条件的优化[J]. 湖南农业大学学报:自然科学版, 2012,38(4):398-403.
[10]张龙进, 白成科.正交设计优化北重楼ISSR-PCR体系[J].植物研究, 2011, 31(1):105-108.
[11]李元春, 沈林, 等.山核桃SRAP体系的建立及与RAPD和ISSR标记的比较[J].浙江农林大学学报, 2011, 28(3):505-512.
[12]胡甦, 王永清, 陶炼.三角紫叶酢浆草ISSR反应体系的建立与优化[J].草业学报, 2011, 20(5):142-150.
[13]Pissard A, Ghislain M, Bertin P. Genetic diversity of the Andean tuber-bearing species, oca(Oxalis tuberoseMol.), investigated by inter-simple sequence repeats[J].Genome, 2006, 49(1):8-16.
[14]付燕, 罗楠, 杨芩, 等.枇杷属植物ISSR反应体系的建立和优化[J].果树学报, 2009, 26(2):167-172.

