香蕉枯萎病拮抗放线菌1-g-59的筛选与鉴定
刘小玉 周登博 谭昕 高祝芬 陈波 黄霄 张锡炎
香蕉枯萎病又称黄叶病、巴拿马病,是由尖孢镰刀菌古巴专化型(Fusarium oxysporiumf. sp. cubense)侵染香蕉植株引起的一种毁灭性土传维管束病害,近年来在中国香蕉主产区持续爆发,严重制约着我国香蕉产业的发展[1-3]。其病原菌有4个生理小种[4],其中4号生理小种(Fusarium oxysporium f. sp. cubense 4,FOC4)侵染范围最广,几乎危害所有的香蕉品种,我国香蕉品种多为巴西蕉,受FOC 4威胁最大,因此防治香蕉枯萎病迫在眉睫。据报道,目前对该病防治的主要途径包括轮作、选用抗病品种[5]、化学防治[6]及生物防治等。目前推广的抗病品种属中抗品种,并不能完全控制枯萎病的发生,且农艺性状不佳,品质较差,如台湾1号、GCTCV-215等;使用化学药剂,不仅会杀灭土壤中的有益菌类,且长期使用,对环境污染影响较大。因此生物防治被认为是目前最安全的防治措施,符合环境保护和有机食品发展要求。
香蕉枯萎病的生物防治已成为各国的研究热点。紫黑链霉菌(Streptomyces violaceusniger)[7]、荧光假单胞菌(Pseudomonas fluorescens)[8]、枯草芽孢杆菌(Bacillus subtilis)[9]被证明对FOC 4具有明显的抑制作用,Perez-Vicente等[10]研究报道,抗病品种种植与生防菌的施用相结合,对香蕉枯萎病的防效达95%以上,说明生物防治香蕉枯萎病是完全可行的。本研究是采集香蕉植株根际土壤,分离并筛选出对FOC 4有明显抑制作用的拮抗菌株,测定各拮抗菌株的发酵液对FOC 4菌丝生长和孢子萌发的抑制作用,筛选一株活性最强的拮抗菌株,旨在通过盆栽试验研究其对香蕉枯萎病的防治效果,并通过形态特征、培养特征、生理生化特征、细胞壁化学成分分析和16S rDNA 序列及其系统发育分析等研究对该菌株进行鉴定。
1 材料与方法
1.1 材料
1.1.1 供试病原菌 香蕉枯萎病病原菌(FOC 4):尖孢镰刀菌古巴专化型4 号生理小种(Fusarium oxysporium f. sp. cubense 4,FOC4),由本实验室保藏。
供试香蕉苗:巴西蕉,由中国热带农业科学院种苗组培中心提供。
1.1.2 样品采集 供分离的土样采自海南临高美台、南宝蕉园,去除大颗粒石块和植物残渣,备用。
1.1.3 主要培养基 分离放线菌采用高氏一号合成培养基,为抑制细菌与真菌的生长,倒平板前加入0.005%的无菌重铬酸钾。
FOC 4的培养及平板对峙试验采用PDA培养基。
拮抗菌的发酵采用黄豆粉液体培养基(可溶性淀粉20g,酵母粉5g,氯化钠4g,黄豆粉15g,蛋白胨2g,碳酸钙4g,pH7.2-7.4,1×105Pa灭菌50min)。
放线菌的形态学观察采用高氏一号琼脂、酵母膏麦芽汁琼脂、燕麦片琼脂、无机盐淀粉琼脂、葡萄糖天冬素琼脂、胨酵母膏铁琼脂、酪氨酸琼脂等7种培养基。
1.2 方法
1.2.1 放线菌的分离与筛选
1.2.1.1 土壤放线菌的分离 称取土样10g,加入90mL无菌水,于28℃、200r/min的摇床中充分震荡30min,取其上清液用无菌水10倍逐级稀释,依次稀释成10-2、10-3和10-4浓度,各吸取100μL涂布于加重铬酸钾的高氏一号培养基平板上,于28℃恒温培养箱中倒置培养,适时挑取不同形态的菌落进行划线,纯化后保存。
1.2.1.2 拮抗放线菌的筛选 采用平板对峙法,在无菌环境下,将培养5-6d的FOC 4(直径为6mm)靶标菌接种至PDA平板中央,并在距离靶标菌边缘2.5cm 处接种待测放线菌,以不接放线菌,只接FOC 4的PDA平板作为对照(CK),于28℃恒温培养箱中倒置培养5d后,测量各抑菌带的大小,初筛出对FOC 4有明显拮抗效果的菌株,连续接种5代进行复筛,最终筛选出拮抗效果最好的菌株进行下一步试验。
1.2.1.3 拮抗放线菌发酵液对FOC 4抑制作用的测定 拮抗菌发酵滤液的制备:拮抗菌接种于黄豆粉液体培养基中,28℃、200r/min的摇床中振荡培养7d,取发酵液8000r/min离心15min,上清液用微孔滤膜过滤除菌。
FOC 4孢子悬浮液的制备:将FOC 4接种于PDA固体培养基上,28℃恒温培养箱中倒置培养,待菌丝铺满平板后,用无菌水配制成1×106cfu/mL孢子悬浮液。
拮抗放线菌发酵液对FOC 4菌丝生长的影响[11]:在熔融态的PDA培养基中加入拮抗菌发酵滤液,摇匀制成平板。将直径为6mm的FOC 4靶标菌接种至平板中央,于28℃恒温培养箱中倒置培养5d后,观察FOC 4菌丝的生长情况,并用显微镜观察各处理的FOC 4菌丝形态变化,以纯培养的FOC 4菌落边缘菌丝为对照,每处理重复3次。
拮抗放线菌发酵液对FOC 4孢子萌发的影响:将拮抗菌发酵滤液与FOC 4孢子悬浮液等体积混合均匀并置于玻片上,于温度为28℃,湿度为80%的人工气候箱中光照培养24h,每一处理设5个重复。取出玻片在显微镜下观察孢子的萌发情况(以孢子萌发的芽管长度达到或超过孢子直径长度的一半定为萌发)[12],并计算各处理的孢子萌发率,以无菌水处理为对照(CK),以5次重复的平均值作为测定结果。
孢子萌发抑制率(%)=[(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率]×100%
1.2.2 拮抗放线菌1-g-59对香蕉枯萎病的盆栽效果测定 试验设3个处理:①处理1,清水;②处理2,接种病原菌+拮抗放线菌1-g-59发酵液;③处理3,接种病原菌。每处理15株香蕉苗,重复3次。
拮抗菌发酵液与病原菌孢子悬浮液的制备方法同1.2.1.3。
采用蘸根浸菌法接种[13]:用针刺伤香蕉组培苗的根尖,再将根浸没于1×106cfu/mL的孢子悬浮液中,30min后移栽于盆钵中,并将剩余的病原菌孢子悬浮液浇入栽有香蕉幼苗的土壤中,接种后置于室温、自然光照条件下培养,常规的水肥管理。接种病原菌10d后,处理2施用拮抗菌发酵液,每株灌注100mL。
病情分级:0级为无症状;1级为整株无变黄叶片;2级为1-2片叶萎蔫;3级为全株1/3-1/2叶片萎蔫;4级为全株1/2-3/4叶片萎蔫;5级为全株3/4以上叶片萎蔫或死亡。
DSI=∑(病害的级别×该级别的植株数)/供试植株数
相对防治效果(%)=[(对照病情指数- 处理病情指数)/对照病情指数]×100%
1.2.3 拮抗菌株的鉴定
1.2.3.1 形态特征 采用平皿插片法[14],将菌株1-g-59接种于高氏一号固体培养基上,28℃培养14d,取插片用台式扫描电镜进行菌株形态观察。
1.2.3.2 培养特征 参照《放线菌的分类和鉴定》[15]和《链霉菌鉴定手册》[16]中的方法。将菌株1-g-59和Streptomyces lunalinharesiiRCQ1071T分别接种于高氏一号琼脂、酵母膏麦芽汁琼脂、燕麦片琼脂、无机盐淀粉琼脂、葡萄糖天冬素琼脂、胨酵母膏铁琼脂、酪氨酸琼脂等7种培养基中,28℃下培养7-10d,观察菌丝体的颜色及可溶性色素情况。
1.2.3.3 细胞壁化学成分分析 采用Hasegawa等[17]薄板层析法对菌株1-g-59进行全细胞水解液的氨基酸和糖型分析。
1.2.3.4 生理生化特征 参照《放线菌的分类和鉴定》和《链霉菌鉴定手册》中的方法观察菌株1-g-59和Streptomyces lunalinharesiiRCQ1071T的生理生化特性,进行明胶液化、鼠李糖、L-酪氨酸、木糖、棉子糖、L-阿拉伯糖、精氨酸、蛋氨酸、淀粉酶水解、脲酶、H2S的产生等方面的检测。
1.2.3.5 16S rDNA 序列测定及其系统发育分析 基因组DNA提取参照姜淑梅[18]的方法。根据放线菌16S rDNA 的结构特点,PCR 扩增选用通用引物27F :5'-AGAGTTTGATCCTGGCTCAG-3',1492R :5'-GGTTACCTTGTTACGACTT-3'。反应体系 50μL :1μL 模板、1μL 引物 1492R 、1μL 引物 27F、25μL PCR mastermix、22μL ddH2O)。PCR 扩增程序 :94℃预变性5min;94℃变性1min,55℃退火1min,72℃延伸1.5min,35个循环;72℃终延伸10min,4℃保存。取50μL PCR产物用1%的琼脂糖凝胶进行电泳检测,在紫外灯下观察、并拍照保存。
电泳完成后的凝胶,经拍照保存后,对大小约为1500bp的条带进行切胶回收。回收片段装入2mL无菌离心管中,用爱思进生物技术有限公司提供的AxyPrep DNA 凝胶回收试剂盒进行回收得到DNA。回收得到的DNA用宝生物工程有限公司提供的pMD18-T Vector 进行克隆。将样品送至北京六合华大基因科技股份有限公司进行测序。
经测序获得拮抗放线菌1-g-59的16S rDNA序列,将该序列通过Blast程序与GenBank中核酸数据进行比对分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),采用BioEdit、Mega5.0等软件对菌株进行系统发育分析,采用邻接法(Neighbour-joining,NJ法)构建系统发育树。
2 结果
2.1 放线菌的分离与筛选
共分离出117株放线菌,采用平板对峙法进行复筛,最终筛选出对FOC 4拮抗效果较强的5株放线菌(表1)。
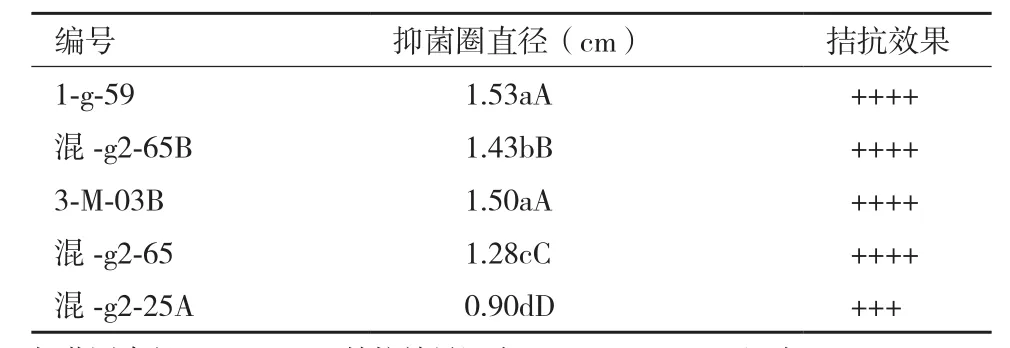
表1 五株放线菌的拮抗效果
2.2 5株拮抗放线菌发酵液对FOC 4抑制作用的测定
2.2.1 对FOC 4菌丝生长的影响 观察培养5d的FOC 4菌丝,发现经不同拮抗菌发酵滤液处理,FOC 4菌丝生长均受到不同程度的抑制,FOC 4直径均<1.0cm,混-g2-65B发酵滤液使FOC 4菌丝变为紫色,3-M-03B发酵滤液使带靶标菌的培养基块变黑,而1-g-59发酵液处理的FOC 4菌丝几乎消失,靶标菌的培养基块变为黑色,且培养基块底部有浅黄色黏性分泌物产生。此外,显微镜观察发现1-g-59发酵液处理的FOC 4菌丝体畸形、分枝增多、菌丝破裂、消解;而对照FOC 4菌丝细长、光滑、均匀。
2.2.2 对FOC 4孢子萌发抑制作用的测定 结果表明,对照组(CK)的FOC 4孢子萌发率达92%,经拮抗菌发酵液处理的FOC 4孢子萌发均受到不同程度的抑制,混-g2-25A发酵液处理的FOC 4孢子萌发率达88%,抑制率为4.3%;混-g2-65、3-M-03B、混-g2-65B这3株拮抗菌发酵液处理的FOC 4孢子萌发率均小于6.25%,抑制率均大于93.2%;而1-g-59发酵液处理的FOC 4孢子萌发率为0,抑制率达100%。图1为对照组(CK)和1-g-59发酵液处理的FOC 4孢子萌发情况。
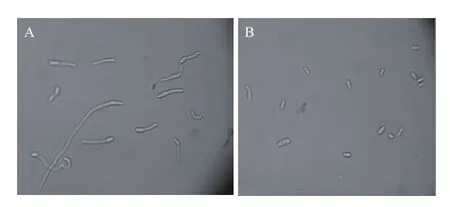
图1 1-g-59发酵液对FOC 4孢子萌发的影响
2.2.3 拮抗放线菌1-g-59发酵液对香蕉枯萎病的盆栽效果测定 移栽14d后,处理3(只接种病原菌)的植株出现黄叶,28d后处理3的植株出现假茎开裂,45d后处理3的蕉苗发病严重,有的植株枯死,病情指数为4.24;处理1(清水)的植株均健康生长;处理2(病原菌+发酵液)病情指数为1.49,防治效果为64.9%(表2)。结果表明,拮抗放线菌1-g-59发酵液对香蕉枯萎病有一定的防治效果。
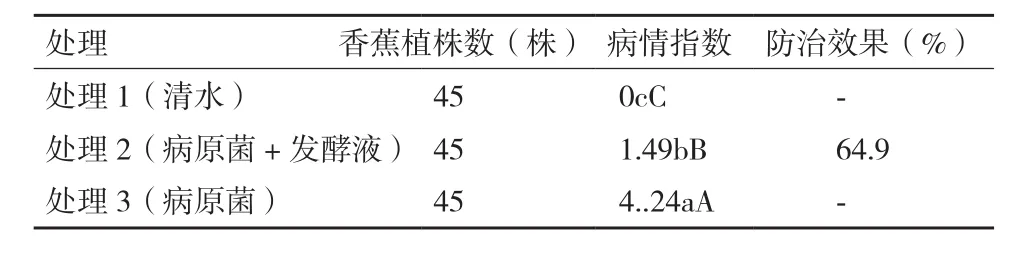
表2 1-g-59发酵液对香蕉枯萎病的盆栽防治效果
2.2.4 拮抗放线菌1-g-59的分类鉴定
2.2.4.1 形态学特征 菌株1-g-59在高氏一号培养基上培养5d后菌落呈灰白色,单菌落成不规则的圆形,表面干燥、有皱纹。基内菌丝黄褐色,气生菌丝灰白色,无可溶性色素。通过台式扫描电镜观察,发现该菌株气生菌丝发达,非轮生,孢子成直或柔曲的链,气生菌丝形成孢子链,孢子为圆柱状(图2)。
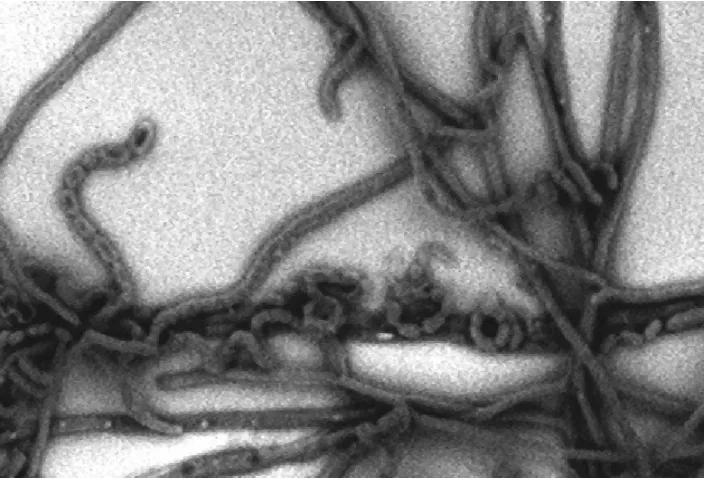
图2 菌株1-g-59的孢子链照片(6400×)
2.2.4.2 培养特征 由表3可以看出,菌株1-g-59在7种培养基中均能生长,但在无机盐淀粉琼脂和甘油天门冬酰胺琼脂培养基上生长得慢,产孢较少;在不同培养基上,基内菌丝颜色有黄褐色、灰黄色、灰色;气生菌丝有灰色、灰白色、白色;在7种培养基中均不产生可溶性色素。

表3 菌株1-g-59在不同培养基上的生长特征
2.2.4.3 细胞壁化学成分 菌株1-g-59全细胞水解液中含有L,L-DAP和甘氨酸,细胞壁属于I型,无特征性糖,糖型C,进一步验证菌株1-g-59为链霉菌属。
2.2.4.4 生理生化特征 由表4可以看出,菌株1-g-59能利用L-酪氨酸木糖、L-阿拉伯糖、鼠李糖、精氨酸、蛋氨酸;不能利用棉子糖;水解淀粉能力弱;明胶液化。菌株1-g-59与Streptomyces lunalinharesii的生理生化特征基本相同。

表4 菌株与Streptomyces lunalinharesii表型特征的比较
2.2.4.5 16S rDNA序列测定及其系统发育分析 将菌株1-g-59的16S rDNA进行PCR扩增得到一条1500bp左右的条带,经序列测定,其大小为1576bp。将其DNA序列与NCBI数据库中相应的DNA序列进行BLAST相似性分析,结果表明,与菌株1-g-59的16S rDNA同源性较高的均为链霉菌,其中与之同源性最高的是Streptomyces lunalinharesiiRCQ1071T,相似性达99.26%。根据序列同源性从高到低的原则,挑取11株菌株的16S rDNA序列,运用BionEdit、Mega5.0软件构建系统发育树(图3),菌株 1-g-59与Streptomyces lunalinharesiiRCQ1071T处于同一分支,亲缘关系最近。
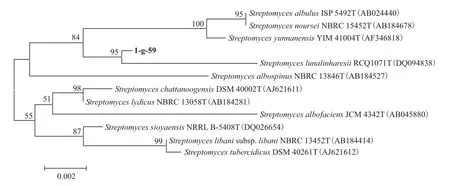
图3 依据16S rDNA 序列构建菌株1-g-59与链霉菌属相关种的系统发育树
3 讨论
近年来土传病害的防治研究在中国发展很快,尤其是在水稻、小麦和油菜方面,已有防治稻瘟病、纹枯病、菌核病等病害的生物农药相继问世[19]。但香蕉枯萎病的生物防治研究起步较晚,目前还没有成功的商业化产品。本研究从蕉园的根际土壤中分离出117株放线菌,通过筛选获得5株对FOC 4具有较强拮抗效果的放线菌,其中菌株1-g-59的拮抗效果最强,对FOC 4的菌丝生长和孢子萌发的抑制作用最大,其发酵液处理的靶标菌培养基块底部有浅黄色黏性分泌物产生,这有可能是拮抗菌发酵液产生的具有抑制FOC 4菌丝生长的分泌物,其成分有待进一步研究。菌株1-g-59发酵液能使FOC 4菌丝体畸形、分枝增多、菌丝破裂、消解,还能有效地抑制FOC 4孢子萌发,这与文献报道[20,21]生防菌的作用机制一致;且其发酵液对香蕉枯萎病的盆栽防治效果达64.9%,说明该菌株可能产生对FOC4有拮抗效果的活性物质,具有较好的开发价值。
菌株1-g-59具有典型的链霉菌特征,16S rDNA序列分析表明菌株1-g-59与Streptomyces lunalinharesiiRCQ1071T序列相似性达99.26%,在系统发育树上处于同一分支,亲缘关系最近,且经研究发现二者的形态特征、培养特征、生理生化特征基本相同[22],因此鉴定菌株1-g-59为Streptomyces lunalinharesii。
本研究为该菌株今后的应用、香蕉枯萎病的生防菌制剂的开发奠定了基础,该菌株的抑菌活性成分以及其抑菌机理还有待进一步的深入研究。
4 结论
通过分离和筛选获得5株对FOC 4具有拮抗作用的放线菌,其中以菌株1-g-59活性最强。菌株1-g-59发酵液能使FOC 4菌丝全部消失,且其对FOC 4孢子萌发的抑制率达100%。菌株1-g-59发酵液对香蕉枯萎病的盆栽防治效果达64.9%。鉴定菌株1-g-59为Streptomyces lunalinharesii。
[1]胡莉莉, 窦美安, 谢江辉, 等.香蕉枯萎病抗病性研究进展[J].广西热带农业, 2006, 102(1):16-18.
[2]莫贱友, 郭堂勋, 李华.广西香蕉枯萎病的发生与病原菌鉴定[J].广西农业科学, 2008, 39(4):481-484.
[3]陈琼武.乐东县香蕉枯萎病发生状况及防治措施[J].安徽农学通报, 2008, 14(12):73.
[4]麦明晓, 黄惠琴, 鲍时翔.香蕉镰刀菌枯萎病4号生理小种研究进展[J].中国生物防治, 2009, 25(增1):71-75.
[5]舒肇苏.台湾香蕉病害的防治[J].柑橘与亚热带果树信息,2000, 16(20):43-44.
[6]林兰稳, 奚伟鹏, 黄赛花.香蕉镰刀菌枯萎病防治药剂的筛选[J].生态环境, 2003, 12(2):182-183.
[7]Getha K, Vikineswary S. Antagonistic effects of Streptomyces violaceusniger strain G10 on Fusarium oxysporum f. sp. cubense race4[J]. Journal of Industrial Microbiology and Biotechnology, 2002, 28(6):303-306.
[8]Thandavelu R, Paaniswami A, Doraiswamy S, et al. The effect ofPseudomonas fluorescens and Fusarium oxyaporum f. sp. Cubenseon induction of defense enzymes and phenolics in banana[J].Biologia Plantarum, 2003, 46(1):107-110.
[9]Chen CY, Wang YH. Enhancement of the ant ifungal activity of Bacillus subtilis F29-3 by the chit inase encoded by Bacillus circulans chi A gene[J]. Canadian Journal of Microbiology, 2004, 51(6):451-455.
[10]Perze VL, Batlle A, Fonseca J, et al.Fusarium oxysporum f. sp. cubense in Cuba[A]. Reaction of cultivars and bio-control method 2nd international symposium on fusarium wilt on banana[C]. Salvador de Bahia. Brazil, 2003: 22-26.
[11]孙建波, 王宇光, 赵平娟, 等.香蕉枯萎病生防细菌的筛选、鉴定及其抑菌作用[J].中国生物防治, 2010, 26(3):347-351 .
[12]方中达.植病研究方法[M].北京:中国农业出版社, 1996:151-154.
[13]何欣, 黄启为, 杨兴明, 等.香蕉枯萎病致病菌筛选及致病菌浓度对香蕉枯萎病的影响[J].中国农业科学, 2010, 43(18):3809-3816.
[14]沈萍, 范秀容, 李光武.微生物学实验[M].北京:高等教育出版社, 2007:72-73.
[15]阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992:296-1048.
[16]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社, 1975:13-15.
[17]Hasegawa T, Takizawa M, Tanida S. A rapid analysis for chemical grouping of aerobic actinomycetes[J]. Journal of General Applied Microbiology, 1983, 29(4):319-322.
[18]姜淑梅, 张龙, 戴世鲲, 等.一种简单、有效的适于PCR操作的放线菌DNA提取方法[J].生物技术, 2007, 17(1):39-41.
[19]Rodrigo F, Rosalie R, Andrew M, et al.Streptomyces lunalinharesiisp. nov., a chitinolytic streptomycete isolated from cerrado soil in Brazil[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58:2774-2778.
[20]孔建, 赵白鸽, 王文夕.枯草芽孢杆菌抗菌物质对镰刀菌抑制的研究[J].植物病理学报, 1998, 28(4):327-340.
[21]秦涵淳, 杨腊英, 李松伟, 等.香蕉镰刀菌枯萎病拮抗放线菌的分离筛选及其抑制效果的初步评价[J].中国生物防治,2010, 26(2):174-180.
[22]刘邮洲, 陈志谊, 刘永锋, 等.南京地区蔬菜枯萎病菌拮抗细菌的筛选与评价[J].江苏农业学报, 2004, 20(1):18-22.

