浙江枝吻纽虫肌动蛋白基因的原核表达及其重组蛋白的体外自组装
李晔 陈蕾 周君 李成华 苏秀榕 李太武
浙江枝吻纽虫(Dendrorhynchus zhejiangensis),属于纽形动物门(Nematinea)、异纽目(Heteronemertea)、纵沟虫科(Lineidae)、枝吻纽虫属(Dendro-rhynchus),最早在浙江省东部奉化市沿海的虾塘中发现,因其独特的分支状的吻系统而得名[1,2]。纽虫在进化系统中,处于扁形动物和环节动物之间,具有完全的消化系统、初级的闭管式循环系统以及纵贯全身的发达的肌肉壁。另外,纽虫具有受到刺激后吐出可再生的捕食器以及身体易断裂、再生等特点。目前国内外关于纽虫的研究大多集中在新种的分类、形态解剖学、生理生化[1,3-6]、系统发育[7-9]。然而,在分子水平上对它的运动及再生的研究较少。有机体受损伤部分的愈合及再生过程依赖于细胞的运动,加强对细胞运动的了解,则有助于更深入地研究有机体的自我修复机制[10]。细胞运动是由于细胞骨架本身的聚合、解聚的相互协作,以及细胞不同部位与胞外基质的黏附、解附的结果。肌动蛋白(actin)不仅是细胞骨架的主要组成成分,而且在细胞运动中起着重要的作用[11]。
肌动蛋白是由Bruno Straub于1941年在兔子的骨骼肌中发现并为其命名,在以后的研究中人们发现它是一类高度保守的蛋白质,并普遍存在于真核生物中。1963年,Hanson和Lowy[12]提出了肌动蛋白单体(globular actin monomer,G-actin)以双螺旋形式构成肌动蛋白聚合体(filament actin,F-actin)的理论,这个理论极大地促进了对肌动蛋白的研究。细胞中肌动蛋白常与其结合蛋白(actin binding proteins,ABPs)结合,以单体、寡聚体及聚合体形式存在,执行不同的生理功能,聚合和非聚合形式的肌动蛋白在细胞中处于一种动态平衡。
F-actin是微丝的主要构成成分。微丝进一步参与细胞分裂、运动、迁移、形态的维持、生长等多种重要生理活动[13,14],因此F-actin的生长动力学行为是细胞运动,胞质分裂,以及细胞内不同器官的运动基础[15]。越来越多的研究表明肌动蛋白与更多的生物活动有关。例如,植物顶端生长,过氧化物酶体和线粒体的运动,信号转导,细胞内吞作用等过程均有肌动蛋白的参与[16-18]。然而,肌动蛋白的聚合的动力学过程及其影响还没有明确的定论。本试验已克隆到了1830bp的actin的cDNA序列(GenBank:JN601113),该序列包含一个1131bp的ORF,编码377个氨基酸,分子量约为41.816kD,包含了能与gelsolin、ATP和泛变应原肌动蛋白抑制蛋白(profiling)相结合的结合位点[19]。
原子力显微镜(AFM)是一种能够在生理条件下对生物大分子、活细胞表面以及细胞膜下结构进行体内或离体研究的新型工具,具有原子级的成像分辨率和纳米级的力测定功能。AFM能够通过探针扫描待测样品表面,记录探针与样品之间的作用力,获取生物大分子(蛋白质、核酸和多糖等)的分子构象、功能及其相互关系的有用信息。
为了进一步研究actin的结构和功能,本研究进一步对纽虫actin进行体外表达、纯化及复性,并通过原子力显微镜观察其体外自组装情况。旨在为进一步研究其结构及聚合的动力学过程,为找到相关疾病治疗的作用靶点奠定理论基础。
1 材料与方法
1.1 材料
浙江枝吻纽虫采自浙江省东部奉化市湖头渡(29.6ºN,121.6ºE)沿岸的虾塘中,带回实验室在22℃下充气养殖。原核表达载体pET-28a(+),大肠杆菌BL21(DE3)由本实验室保存。QIAquick Gel Extraction购自QIAGEN公司,SDS-PAGE低分子量蛋白标准、T4DNA连接酶、HindⅢ和BamHⅠ等均购自TaKaRa公司,ATP、Ni-NTA购自Invitrogen公司,actin标准品:actin from rabbit muscle购自Sigma公司。
1.2 方法
1.2.1 Actin的原核表达
1.2.1.1 重组表达载体的构建与鉴定 根据已克隆到的actin的全长cDNA序列(GenBank:JN601113),设计包含限制性内切酶BamHⅠ和Hind Ⅲ切点的引物(A-R’:5'-CGGGATCCATGTGTGACGACGAGAAT-3'和 A-F’:5'-CCCAAGCTTTTAGAAGCATTTCCTGTG-3')扩增得到纽虫的actin的ORF序列。ORF扩增产物经QIAquick Gel Extraction纯化后,用BamHⅠ和Hind Ⅲ双酶切并插入到含互补酶切位点的原核表达载体pET-28a(+)中,获得重组质粒pET-28a-A。转化E. coli DH5α后,经阳性克隆筛选和PCR鉴定,重组克隆子送上海英骏生物技术有限公司测序。然后提取插入正确序列的重组质粒,并转化到E. coli BL21(DE3)中。
1.2.1.2 重组质粒的诱导表达 将鉴定的阳性重组细菌接种到LB培养液(含50μg/mL卡那霉素),37℃、120r/min振荡培养至菌液A600值为0.6-0.8时加入IPTG使其终浓度为1mmol/L,37℃诱导表达。在加入诱导剂后0、1、2、3、4、5、6h收集菌液1mL经12000r/min离心5min,弃上清液4℃保存。样品用40μL pH7.4的PBS悬浮细菌沉淀物,加入10μL的5×样品缓冲液,水浴煮沸10min,通过SDS-PAGE电泳分离,考马斯亮蓝R-250染色检测表达情况。
1.2.2 表达产物的纯化及复性 收集诱导表达的菌液,4℃、12000r/min离心5min,1×PBS漂洗后离心收集沉淀,加入1×PBS及溶菌酶,4℃反应30min后超声破碎,离心后收集胞质中的可溶性物质和包涵体沉淀,分别进行12% SDS-PAGE电泳分析。收集3mL菌液的包涵体沉淀,加入200μL Buffer B(100mmol/L NaH2PO4,10mmol/L Tris,6mol/L GuHCl,pH8.0),0.5μL β-巯基乙醇和 4μL 咪唑(终浓度为20mmol/L),轻微混匀后,在室温放置1h,使包涵体充分溶解。4℃、12000r/min离心10min,上清置于新的离心管中备用。取50μL混合50%乙醇的Ni-NTA,轻微离心后,吸去上清,Ni-NTA用等量的Buffer B洗涤两次。把包涵体破碎后的上清,加入到Ni-NTA中,室温轻微混匀30min。4℃、12000r/min离心10s沉淀Ni-NTA,去上清。在Ni-NTA 中加入 250μL Buffer C(100mmol/L NaH2PO4,10mmol/L Tris,8mol/LUrea,pH6.3),和 5μL 咪唑(终浓度为20mmol/L),轻微混匀后,12000r/min离心10s,去上清,重复一次。加入25μL Buffer E(100mmol/L NaH2PO4,10mmol/L Tris,8mol/LUrea,pH4.5), 和 5μL 咪 唑(终 浓 度 为 160mmol/L),12000r/min离心10s,上清为含重组蛋白的洗脱液E,重复3次。将含有8mol/L尿素的重组蛋白洗脱液放入透析袋中,于6mol/L尿素缓冲液(100mmol/L NaH2PO4,10mmol/L Tris,6mol/LUrea,pH 8.0),4℃透析过夜。于2mol/L尿素缓冲液(100mmol/L NaH2PO4,10mmol/L Tris,6mol/LUrea,pH8.0)中,4℃透析过夜。然后在复性Buffer(20mmol/L Tris,2mmol/L GSH,0.2mmol/L GSSG,5mmol/L EDTA,50mmol/L Glycine,10mmol/L ATP,1%蔗糖和0.1%PEG6000,pH8.0)中,4℃透析24h,并更换一次复性Buffer。于50mmol/L Tris-HCl缓冲液,4℃透析过夜以交换复性Buffer。SDS-PAGE分析鉴定表达产物的分离纯化及复性情况。
1.2.3 Actin的体外自组装 用F-缓冲液(5mmol/L Tris-Cl pH7.5,2mmol/L MgCl2,100mmol/L KCl,0.5mmol/L DTT,0.5mmol/L ATP)将 1mL纯 化 复 性得到的r-actin精确稀释至最终浓度为5μg/mL,取5μg/mL的actin标准品作为对照组,然后将试验组及对照组样品置于37℃恒温箱中孵育0min、15min、30min及1h使其聚合。蛋白生长到预设的时间后,在新鲜剥离的云母表面(1cm×1cm)滴加4μL样品,使蛋白能够良好分散,沉降约5min后,置于干燥、洁净的环境中自然晾干,用原子力显微镜(multimode scanning probe microscopy,NanoscopeⅢa,Veeco Instruments,USA)观察,扫描所用探针型号为NSC11(三角形悬臂,MikroMash公司),其典型弹性常数为50N/m,典型共振频率为330KHZ,扫描速率为1-1.2Hz。原子力显微镜采集的图像保存为BMP格式,储存在电脑中做进一步的分析。上述所有操作均在超净工作条件下进行,以避免污染。
2 结果
2.1 Actin的原核表达
2.1.1 重组表达质粒鉴定 重组质粒pET-28a-A经BamHⅠ和HindⅢ双酶切后,琼脂糖凝胶电泳结果(图1)显示,出现了约4.5kb的pET-28a(+)载体DNA片段和约1.1 kb的插入片段,重组质粒pET-28a-A转化E.coli BL21后,挑取阳性克隆子测序后确定为目的片段。
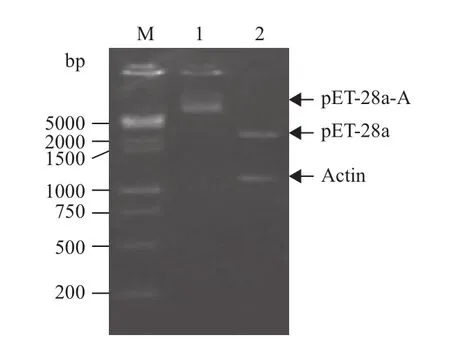
图1 重组表达质粒pET-28a-A的酶切鉴定结果
2.1.2 重组质粒的诱导表达 经SDS-PAGE电泳分析,含重组质粒的细菌在相对分子质量44.3kD附近可见明显的条带,而未经诱导菌株与空载体对照菌则无条带。由于质粒pET-28a(+)在多克隆位点上游有一段编码序列,分子量约为3.5kD,而目的蛋白为41.816kD,故融合蛋白约为45kD,两者相符。1mmol/L IPTG诱导后,目的蛋白随着诱导时间的增加,表达量逐渐增多,4h时达到最大值,见图2。
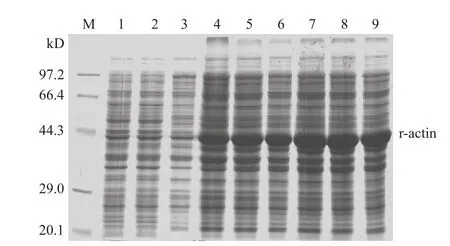
图2 pET-28a-A重组蛋白表达的SDS-PAGE分析图
2.2 表达产物的亲和纯化
将表达菌株超声破碎,离心获得的上清(胞质中的可溶性物质)和沉淀(包涵体沉淀)分别进行SDS-PAGE电泳分析,该基因的表达产物主要以不可溶性的包涵体形式存在(图3,泳道3)。进一步利用GuHCl和β-巯基乙醇溶解包涵体后,Ni-NTA Agarose亲和层析柱对r-actin进行纯化,收集洗脱液进行12% SDS-PAGE鉴定获得的重组蛋白,采用该方法纯化出的蛋白的得率约为100mg蛋白/250mL菌液。纯化后的蛋白经复性buffer处理后同样经12% SDS-PAGE鉴定(图3,泳道4,5)。
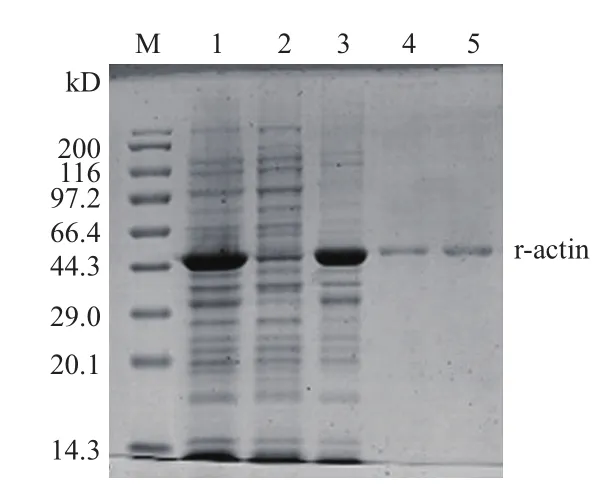
图3 Actin 表达产物的可溶性分析及纯化、复性后的SDSPAGE图谱
2.3 R-actin的体外自组装
经纯化复性后的r-actin蛋白在体外的自组装过程通过激光原子力显微镜(AFM)被分析研究。结果发现,复性后的r-actin和actin标准品在37℃条件下,培养结果有较强的同源性。随着培养时间的延长,两种actin在体外通过自装配过程除了形成无序的蛋白堆积物之外(图4-A,B),均还能够形成无规卷曲的纤维簇(图4-C,D),以及具有不同直径的长纤维等(图4-E,F)。但是两者在相同时间里达到的成熟度是不同的,r-actin培养30min后形成的无规卷曲的小纤维簇(图4-C),而actin标准品在培养了30min后形成比较成熟的纤维(图4-D),推测二者可能为聚合过程中不同阶段的产物,具有不同的空间拓扑构象。培养60min以后,更大尺度上的复杂聚集结构开始形成了,这种结构可能由上述两种纤维结构通过分支纤维间的相互作用所形成。在这一阶段,r-actin形成的是大量的,纤细的,彼此分离的纤维(图4-E),而actin标准品则能够形成多分枝的,具有较粗直径的长纤维(图4-F)。表明在没有ABPs或F-actin稳定剂存在的情况下,体外聚合的F-actin在一定条件下可进一步聚集缠绕形成复杂的纤维结构或无序的蛋白堆积物。
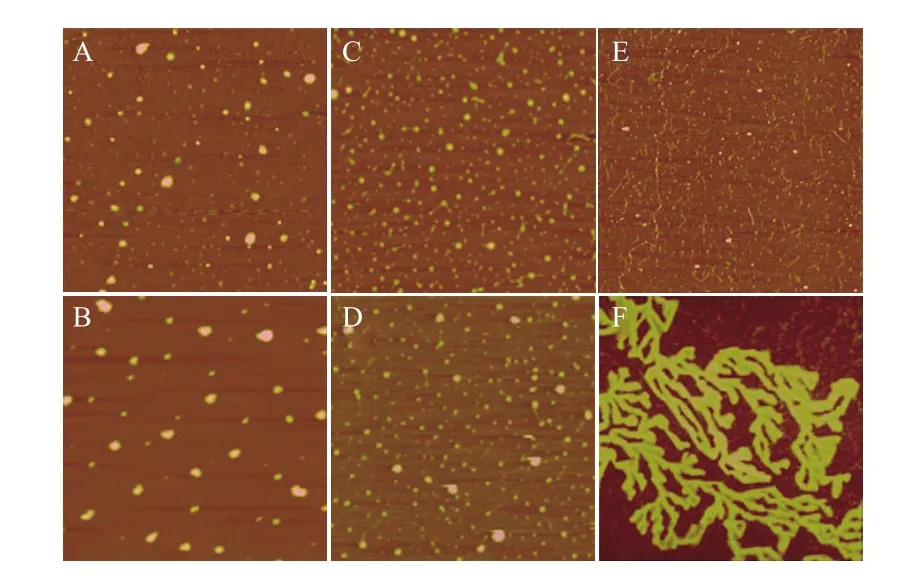
图4 r-actin体外自组装的AFM图
3 讨论
研究表明,浙江枝吻纽虫actin基因属于α类型,其cDNA全长为1830bp,包括167bp的5'非翻译区,532bp的3'非翻译区和1131bp的开放阅读框。预测分子量为41.816kD,理论等电点5.30。其中氨基酸序列分析显示actin序列中包含了能与gelsolin、ATP和泛变应原肌动蛋白抑制蛋白(profiling)相结合的结合位点[19]。双向电泳和Real-time PCR的结果显示浙江枝吻纽虫在断裂前后,actin蛋白和actin mRNA的表达均发生了显著的变化(结果未显示)。推测actin在纽虫的断裂和再生过程中起了重要的作用。为了进一步研究actin在纽虫再生中的调控作用及其在体外聚合的动力学过程,本试验将纽虫actin基因进行了原核表达,与来自兔肌肉的actin标准品进行比较,分析它们体外聚合的不同特点。
在本试验中,N端带有6×His-tag的纽虫actin的重组蛋白(r-actin)通过大肠杆菌表达系统获得,并通过Ni柱进行了纯化。由于r-actin的高表达,导致其在表达菌体中形成了难溶的、没有生物活性的包涵体。为了进一步研究r-actin的自装配过程,溶解包涵体、除去变性剂、使重组蛋白再折叠成活性形式是关键步骤[20]。本试验利用还原剂(β-巯基乙醇)打开二硫键,6mol/L GuHCl使蛋白质变性,通过Ni柱纯化得到变性的r-actin后,利用MaedeY设计的缓慢透析法进行复性,8mol/L的尿素溶液作为起始透析液,然后逐渐稀释透析液的尿素浓度,此种方法有助于减少蛋白质在复性中产生的沉淀,提高活性蛋白收率[21,22]。采用谷胱甘肽氧化法促进二硫键形成,即在复性液中加入低分子质量的还原和氧化的含巯基的化合物提供合适的氧化还原电位,试验表明,10∶1的还原型,氧化型的谷胱甘肽最有利于r-actin的复性。
在正常生理条件下,actin以两种形式存在:单体球形的G-actin和非共价、双螺旋、多聚体的F-actin,两者在细胞内通过聚合或解聚作用维持动态平衡,gelsolin等肌动蛋白结合蛋白则控制着这一动态过程,能在特定的时间、空间调节actin的聚合、解聚过程[23]。在体外简单热力学体系中,actin的自装配为单纯的、无干预的热力学过程,完全受其内在的热力学特性所驱动,往往形成大尺度的聚集纤维结构。其聚合动力学机制一般遵循非稳态的踏车模型,并可分为4个步骤:肌动蛋白单体的活化;肌动蛋白单体聚合成核;肌动蛋白纤维生长的过程;聚合达到动态平衡,肌动蛋白纤维不再生长[24-26]。
在本试验中,r-actin通过自装配过程除了形成蛋白堆积物体系,起初形成了蛋白球,随着培养时间的延长,还形成大量复杂的、离散细小的纤维结构,这些纤维结构分布比较分散,彼此间缺乏联系。以单根成熟的F-actin形式存在的纤维很少,而且较短;相比之下,actin标准品在同样条件下可长出较长的纤维,且一般直径较粗,多有分支产生,但也很难找到由单根微丝组成的交联网络。目前初步判断,观察到的高级结构可能是由单根微丝通过非共价作用(氢键,范德华力和静电作用等)进一步形成的有序结构;推测微丝间的相互缠绕或形成(多级)螺旋可能是高级纤维结构的主要构成方式。
与actin标准品相比,r-actin体外自组装的进程较缓慢的原因是由重组蛋白的纯度和活性所决定的。虽然电泳的验证r-actin经纯化后几乎为单一条带,但是即使溶液中存在少量的其他蛋白或离子均会对r-actin的自组装行为产生影响。而重组蛋白的活性则是更大的影响因素,由于r-actin在原核表达过程中以包涵体的形式存在,必须经过复性的步骤以恢复其正常的构象,因而重组蛋白的活性不可能为100%。重组蛋白的体外自装配过程是热力学条件下的“自催化”聚合行为,无活性蛋白的存在势必会干扰活性蛋白间的相互作用,从而影响聚合进程。此外,试验中的actin标准品来自于哺乳动物兔的肌肉,而r-actin则是来自于无脊椎动物纽虫的,尽管没有文献报道不同生物间的actin的作用的差异,但也不能排除由于物种的差异,导致r-actin的聚合行为与标准品间存在一些不同。
尽管肌动蛋白的聚合过程已经利用显微镜、原子力显微镜等进行了研究,但是在非活性阶段中,肌动蛋白单体发生了怎样的变化仍然未知,由于仪器的分辨率及蛋白球生长过程易受多种因素的干扰,仍然观察不到成核过程中中间体形成的过程[27]。调节肌动蛋白聚合过程的因素应构成一个整体,不同环境中肌动蛋白的形态与其所处的环境之间具体有何种依赖关系也是今后的研究的重点,这些问题的解决将有利于了解肌动蛋白体外自装配的过程,进一步了解细胞运动及有机体的自我修复机制。
4 结论
重组蛋白(r-actin)在体外的自组装过程量,其起初形成了蛋白球,随着培养时间的延长,还形成大量复杂的、离散细小的弱纤维结构,但彼此间缺乏联系。来源于兔肌肉的actin标准品,在同样条件下可生长为较为成熟的直径较粗、多有分支的长纤维。纤维间也缺乏联系,没有形成交联的网络结构。R-actin自装配过程反映了其固有的聚合热力学特性。
[1]吕慈仙, 李太武, 江锦波, 等. 浙江沿海最新发现一种枝吻类纽虫[J]. 水产科学 , 2008, 27(12):652-654.
[2]王孟前, 李太武, 江锦坡, 等. 浙江沿海一新纽虫的18S rDNA序列研究[J].科技通报, 2010, 26(1):67-71.
[3]尹左芬, 曾棻. 纵沟纽虫科(Lineidae)、枝吻纽虫属(Dendrorhynchus)的一新种—湛江枝吻纽虫(D.zhanjianggensis)的研究[J]. 海洋通报 , 1984, 3(6):51-58.
[4]尹左芬, 曾棻.异纽类纵沟纽虫科一新属新种—中华枝吻纽虫[J]. 海洋与湖沼 , 1985, 16(4):323-336.
[5]尹左芬, 曾棻. 纵沟纽虫科(Lineidae)具分枝吻纽虫的一新属新种—疣多枝吻纽虫(Polydendrorhyn chus papillaris)[J]. 山东海洋学院学报, 1986, 16(4):1-9.
[6]孙世春. 中国单针类纽虫一新记录[J]. 青岛海洋大学学报,1994, 24(3):436-438.
[7]Strand M, Sundberg P. GenusTetrastemmaEhrenberg, 1831(PhylumNemertea)—anatural group? Phylogenetic relationships inferred from partial 18S rDNA sequences[J]. Molecular Phylogenetics and Evolution, 2005, 37:144-152.
[8]Sundberg P, Strand M. Genetics do not reflect habitat differences inRiseriellus occultus(Heteronemertea, Nemertea)from Spain and Wales[J]. Marine Biology Research, 2007, 3:117-122.
[9]Chen HX, Sundberg P, Jon L, et al. The complete mitochondrial genome ofCephalothrix simula(Iwata)(Nemertea:Palaeonemertea)[J]. Gene, 2009, 442:8-12.
[10]Simon JA, Melanie AH, Bruce AM. Mechanism of actin polymerization in cellular ATP depletion[J]. JBC, 2003, 11:1-30.
[11]Christophe LC, Dominique P, Marie FC. ATP hydrolysis on actinrelated protein 2/3complex causes debranching of dendritic actin arrays[J]. PNAS, 2003, 100:6337-6342.
[12]Hason J, Lowy J. The structure of F-Actin and of Actin filaments isolated from muscle[J]. J Mol Biol, 1963, 6:46.
[13]Poliard TD, Cooper JA. Actin and actin-binding proteins:A critical evaluation of mechanisms and functions[J]. Annu Rev Biochem, 1986, 55:987-1035.
[14]秦玉明 , 苏秀榕 , 李晔 , 等 . 缢蛏(Sinonovacula constricta)cDNA文库的构建及肌动蛋白基因的研究[J]. 海洋与湖沼,2010, 41(1):54-59.
[15]Coluccio LM, Bretscher A. Reassociation of microvillar core proteins:making a microvillar corein vitro[J]. J Cell Biol,1989, 108:495-502.
[16]Wei MY, Leon LJ, Lee Y. Selective attachment of F-actin with controlled length for developing an intelligent nanodevice[J].Journal of Colloid and Interface Science, 2011, 356:182-189.
[17]Quamann BM, Kessels M, Kelly RB. Molecular links between Endocysis and the actin cytoskeleton[J]. The Journal of Cell Biology, 2000, 150:111.
[18]Vidal IL, Mckenna ST, Hepler PK. Actin polymerization is essential for pollen tube growth[J]. Molbiol Cell, 2001, 12:2534-2545.
[19]陈蕾, 李晔, 苏秀榕, 等. 浙江枝吻纽虫(Dendrorhynchus zhejiangensis)凝溶胶蛋白和肌动蛋白基因的克隆与序列分析[J]. 海洋与湖沼 , 2011, 42(2):1-8.
[20]杨晓仪, 林键, 吴文言. 重组蛋白包涵体的复性研究[J]. 生命科学研究, 2004, 8(2):100-105.
[21]Maeda Y,Ueda A, Imoto T. Effective renaturation of denatured and reduced immunoglobulin Gin vitrowithout assistance of chaperone[J]. Protein Eng, 1996, 9(1):95-100.
[22]Hwang HS, Chung HS. Preparation of active recombinant cathepsin K expressed in bacteria as inclusion body[J]. Protein Expr Purif,2002, 25(3):541-546.
[23]Estes J, Selden L, Kinosian H, et al. Tightly bound divalent cations of actin[J]. J Muscle Res Cell Motil, 1992, 13:272-284.
[24]Lehto T, Miaczynska M, Zerialb M, et al. Observing the growth of individual actin filaments in cell extracts by time - lap se atomic force microscopy[J]. FEBS Letters, 2003, 551:25-28.
[25]张军, 王远亮, 程超, 等.利用激光AFM和TEM探索肌动蛋白体外自装配聚合结构[J]. 激光生物学报, 2008, 17(1):1-6.
[26]Chaudhurio, Parekh SH, Fletcher DA. Reversible stress softening of actin networks[J]. Nature, 2007, 445(7125):295-298.
[27]Kawabata K, Sado Y, Nagayama M, et al. Visuation of dynamic organization of cytoskeleton gels in living cells by hybrid-SPM[J]. Chinese Journal of Polymer Science, 2003, 21:169.
[28]Tan XW, Promoda A, Perera P, et al. Comparison of candidate materials for a synthetic osteo-odonto keratoprosthesis device[J].IOVS, 2011, 52(1):21-29.

