Snail和N-cadherin在乳腺浸润性导管癌中的表达
曹 莉,熊正文,黄 勇,韩亚伟,苏 红,张华东,李 伟
研究发现肿瘤细胞的浸润转移是患者病死率较高的一个重要原因,上皮细胞-间质转化(epithelial-mesenchymal transition,EMT)和癌细胞脱离原发部位在浸润转移过程中起重要作用[1]。Snail和N-cadherin异常的表达是EMT发生的一个重要机制,增加了癌细胞的侵袭转移性[2]。现探讨Snail和N-cadherin在乳腺不同病变组织中的表达变化差异、与乳腺浸润性导管癌临床病理特征的关系以及它们的相关性,旨在探讨其在乳腺癌发生、发展和浸润转移中的作用。
1 资料与方法
1.1 标本来源 解放军251医院病理科于2008年1月—2009年12月收集乳腺普通型增生、乳腺导管内癌组织标本各30例,乳腺浸润性导管癌80例。乳腺普通型增生年龄28~56岁,中位数42岁。乳腺导管内癌年龄30~62岁,中位数48岁;低级别癌8例,中级别癌15例,高级别癌7例,均无淋巴结转移。乳腺浸润性导管癌年龄22~75岁,中位数50岁;组织学分级Ⅰ~Ⅱ级55例,Ⅲ级25例;TNM分期Ⅰ~Ⅱ期26例,Ⅲ~Ⅳ期54例;有淋巴结转移46例,无淋巴结转移34例。术前均未接受化疗、激素治疗及放疗。
1.2 主要试剂 兔抗人Snail多克隆抗体购自Abcom 公司(17732),N-cadherin(MAB-0571)、免疫组化SP试剂盒及DAB显色剂均购自福州迈新生物技术开发有限公司。
1.3 免疫组化染色(SP法) 标本均经10%甲醛溶液固定,常规石蜡包埋,4 μm连续切片,采用0.01 mmol/L的枸橼酸缓冲液抗原修复,染色程序按SP试剂盒说明书进行。以PBS代替一抗作阴性对照,已知阳性切片为阳性对照。
1.4 结果判定 Snail免疫组化阳性信号以胞核出现棕黄色为阳性细胞,按染色强度的深浅积分,0分:无染色,1分:弱阳性,2分:强阳性;按着色细胞百分比积分,1分:≤25%,2分:26% ~50%,3分:51% ~75%,4分:>75%;按照阳性细胞×染色强弱计积分,积分1~2分为阴性,3~8分为阳性[3-4]。
N-cadherin阳性表达为细胞膜及细胞质内出现棕黄色颗粒,光镜下每张切片随机选取10个400倍视野,每个视野计数100个细胞。阳性细胞数评分:阳性细胞数≤10%为0分,11% ~25%为1分,26% ~50%为2分,≥51%为3分。染色强度评分:无着色为0分,淡棕黄色为1分,棕黄色为2分,深棕色为3分。将两项评分相乘,结果≤2分为阴性,>2分为阳性。
1.5 统计学分析 数据采用SPSS 17.0统计分析软件处理,计数资料运用χ2检验、Spearman相关性检验分析,以α=0.05为检验水准。
2 结果
2.1 Snail、N-cadherin在不同乳腺病变中的表达乳腺浸润性导管癌组织中,Snail阳性率为82.5%(66/80),分别高于乳腺导管内癌组织53.3%(16/30)和乳腺普通型增生组织13.3%(4/30),差异有统计学意义(χ2=9.78,P <0.01 和 χ2=45.11,P <0.01);乳腺浸润性导管癌组织中,N-cadherin阳性率为60.0%(48/80),分别高于乳腺导管内癌组织26.7%(8/30)和乳腺普通型增生组织10.0%(3/30),差异有统计学意义(χ2=9.70,P <0.01 和χ2=12.97,P <0.01),见图1、2。
2.2 Snail、N-cadherin在乳腺浸润性导管癌中表达与临床病理指标的关系 Snail和N-cadherin在淋巴结转移组中、TNM分期中Ⅲ~Ⅳ表达明显较无淋巴结转移组、TNM分期中Ⅰ~Ⅱ高,差异有统计学意义(P<0.01);Snail和N-cadherin与患者年龄、肿瘤直径大小、组织学分级均无关(P>0.05),见表1。

图1 Snail在不同乳腺病变中的阳性表达(SP×200)
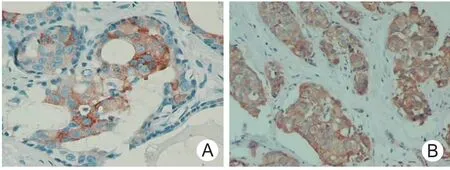
图2 N-cadherin在不同乳腺病变中的阳性表达(SP×200)
2.3 乳腺浸润性导管癌组织中Snail、N-cadherin表达之间的关系 乳腺浸润性导管癌中Snail和N-cadherin表达同时阳性者45例,同时阴性者11例,Snail阳性、N-cadherin阴性者21例,Snail阴性、N-cadherin阳性者3例,两者呈显著正相关(r=0.36,P<0.01)。
3 讨论
3.1 Snail、N-cadherin在乳腺不同病变组织中的表达情况 Snail首先被发现存在于果蝇中,是锌指蛋白超家族的第一个成员,人Snail基因定位于第20号染色体 20q12.3,全长 5882 bp,包含 3个外显子[5]。Snail与E-cadherin启动子区的E盒(E-box)结合,抑制E-cadherin的表达,诱导EMT的发生[6]。本研究显示Snail在乳腺浸润性导管癌中的阳性表达率高于乳腺导管内癌、乳腺普通型增生。N-cadherin是钙黏附素家族中第一个在中枢神经系统发现的成员,其编码基因定位于人染色体18ql1.2,分子量为127 kD,全长4132 bp,由906个氨基酸组成[7]。在成熟组织中,N-cadherin只表达在神经外胚层和中胚层来源的组织,如成熟的神经、肌肉和造血组织等。N-cadherin的表达有助于上皮细胞-间质细胞的迁移,从而使肿瘤细胞更加富于侵袭力,易于转移[8]。本研究显示N-cadherin在乳腺浸润性导管癌阳性表达率高于乳腺导管内癌、乳腺单纯性增生。提示Snail和N-cadherin蛋白在乳腺癌中的异常表达对其发生、发展可能起重要作用。
3.2 乳腺癌组织中Snail、N-cadherin的表达与临床病理指标的关系 研究发现EMT在各种上皮细胞来源的恶性肿瘤的侵袭转移过程中发挥了重要作用,而Snail可以诱导EMT的发生,因此Snail在肿瘤转移中的作用越来越受到人们的关注。本研究发现乳腺癌组织中Snail表达与年龄、肿瘤大小和组织学分级无关,与淋巴结转移、TNM分期表达差异有统计学意义。结果提示,Snail高表达与乳腺癌发生、浸润转移密切相关,与Come等[9]的实验结果基本一致。Snail在肿瘤中的表达越高,肿瘤的转移能力可能也随之增高,癌细胞更容易侵袭周围组织并发生转移,故其高表达可能提示预后不良。
本研究发现乳腺浸润性导管癌组织中N-cadherin表达与年龄、肿瘤大小和组织学分级无关,与淋巴结转移、TNM分期表达差异有统计学意义。提示随着肿瘤转移能力的增强,N-cadherin表达逐渐升高。N-cadherin的增加可以通过 FGFR激活MAP-KERK信号转导途径,诱导MMP-9基因表达,有利于肿瘤血管的形成,使肿瘤易于生长和转移[10-11]。体外实验也表明,给N-cadherin阴性表达的癌细胞转染N-cadherin后,细胞的侵袭力明显增强[12]。进一步说明 N-cadherin在乳腺癌浸润和转移过程中可能起着重要的作用,可以作为乳腺癌发生、发展以及浸润转移的指标。
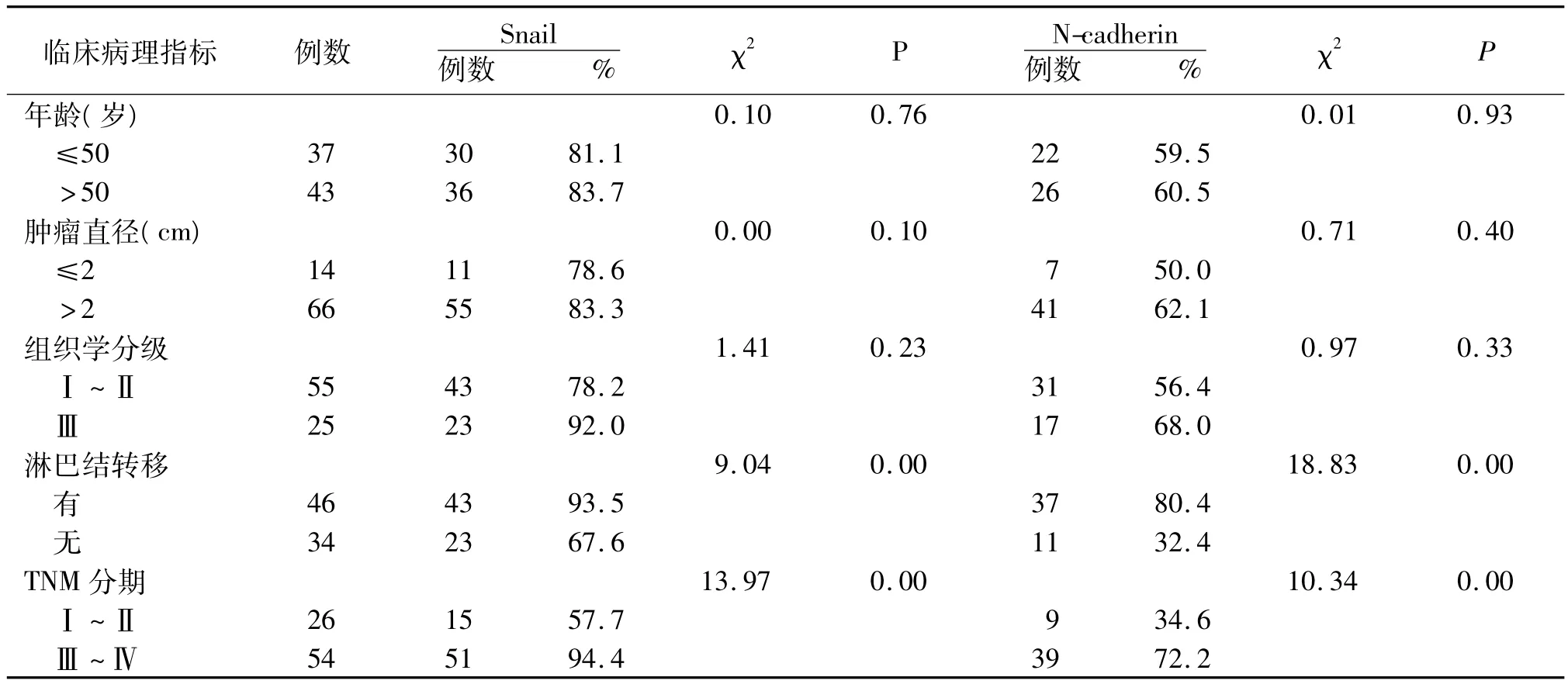
表1 Snail、N-cadherin在乳腺浸润性导管癌中表达与临床病理指标的关系
3.3 乳腺浸润性导管癌中Snail、N-cadherin表达的相关性 Snail与许多靶基因相互作用,而其中E-cadherin被认为是最重要的靶基因。Snail可与E-box结合,在转录水平上抑制E-cadherin的表达,诱导N-cadherin的高表达。随着对经典的cadherin分子深入研究发现,N-cadherin表达的增多,在引起肿瘤浸润转移方面有着比E-cadherin减少更为重要的作用,故在肿瘤的恶性生物学行为中,N-cadherin起着更重要的作用[13]。本研究发现,乳腺浸润性导管癌组织中Snail、N-cadherin表达变化一致上调,呈明显正相关。因此,Snail可能间接导致N-cadherin的异常表达,从而导致上皮间连接的破坏,使癌细胞间黏附力减弱,更具有侵袭力。
综上所述,乳腺浸润性导管癌的浸润转移是多种因素共同作用的结果,其中Snail、N-cadherin的异常表达是一个主要因素,这两种基因共同参与乳腺肿瘤的发展及转移,它们可以共同作为判断乳腺癌转移和预后的参考指标。推测Snail可能作为转录因子,居于信号通路的中间环节,对其上游信号转导通路以及下游Snail转录调控基因进行调控,并诱导N-cadherin的异常表达。因而通过阻断Snail信号途径,采取针对Snail的干预方案,有望降低乳腺浸润性导管癌的浸润转移率,从而改善预后。
[1]Zablocki G J,Ruzycki P A,Overturf M A,et al.Aldose reductase-mediated induction of epithelium-to-mesenchymal transition(EMT)in lens[J].Chem Biol lnteract,2011,191(1-3):351-356.
[2]Zhao J H,Luo Y,Jiang Y G,et al.Knockdown of β-Catenin Through shRNA Cause a Reversal of EMT and Metastatic Phenotypes Induced by HIF-1α[J].Cancer Invest,2011,29(6):377-382.
[3]Rosivatz E,Becker I,Specht K,et al.Differential expression of the epithelial-mesenchyalt-ransition regulators Snail,SIP1,and twist in gast ric cancer[J].Am J Pathol,2002,161(5):1881-1891.
[4]Pang R W,Joh J W,Johnson P J,et al.Biology of hepatocellular carcinoma[J].Ann Surg Oncol,2008,15(4):962-971.
[5]Mathias R A,Simpson R J.Towards understanding epithelial-mesenchymal transition:a proteomics perspective[J].Biochim Biophys Acta,2009,1794(9):1325-1331.
[6]寻风华,熊正文.转录因子Snail与女性常见肿瘤关系研究进展[J].中国妇幼保健杂志,2011,25(1):69-72.
[7]Morishita H,Yagi T.Protocadherin family:diversity,structure,and function[J].Curr Opin Cell Biol,2007,19(5):584-592.
[8]Kamikihara T,Ishigami S,Arigami T,et al.Clinical implications of N-cadherin expression in gastric cancer[J].Pathol Int,2012,62(3):161-166.
[9]Come C,Magnino F,Bibeau F,et al.Snail and slug p lay distinctr oles during breast carcinoma pr ogression[J].Clin Cancer Res,2006,12(18):5395-5402.
[10]Thomson S,Petti F,Sujk A,et al.Kinase switching in mesenchymal-like non-small cell lung cancer lines contributes to EGFR inhibitor resistance through pathway redundancy[J].Clin Exp Metastasis,2008,25(8):843-854.
[11]Dwivedi A,Slater S C,George S J.MMP-9 and MMP-12 cause N-cadherin shedding and thereby beta-catenin signlaling and vascular smooth muscle cell proliferation[J].Cardiovasc Res,2009,81(1):178-186.
[12]Nagi C,Guttman M,Jaffer S,et al.N-cadherin expressi on in breast cancer:correlati on with an aggressive histologic variant-invasive micropap illary carcinoma[J].Breast Cancer Res Treat,2005,94(3):225-235.
[13]Nguyen P T,Kudo Y,Yoshida M,et al.N-cadherin expression is involved in malignant behavior of head and neck cancer in relation to epithelial-mesenchymal transition[J].Histol Histopathol,2011,26(2):147-156.

