高效液相色谱-质谱法检测血清中维生素D含量
曾 义
(重庆市黔江中心医院,重庆 409000)
维生素D缺乏不仅与骨质疏松症和骨软化症相关,而且容易导致肌肉力量下降,近年来发现维生素D与癌症、心血管疾病、糖尿病等都有相关性,足量的体内维生素D水平对癌症、多发性硬化症、糖尿病等有一定预防作用[1]。国外研究表明,维生素D的摄入与癌症的预防呈正相关,血清低水平维生素D与较高的外周动脉疾病发病率存在关联[2]。维生素D有两种存在形式,即钙化醇(维生素D2)和胆固醇(维生素D3)。维生素D状况评估主要是通过测量循环中血清25-(OH)-D水平。传统检测方法采用竞争结合试验和免疫测定法来检测循环中总的维生素D(D2和D3),这些方法中抗体交叉反应性通常不足100%[3],因此结果差异较大。采用液-质联用分析技术可克服以上缺点,并定量检测体内维生素D。
1 仪器与试药
安捷伦1200型液相色谱仪和安捷伦6430型液质联用仪。25-(OH)-D2(99.5%),25-(OH)-D3(99.0%),均为上海研生生化试剂有限公司;氘代25-(OH)D3(Sigma and Medical lsotopes);甲醇、乙腈为色谱纯,甲酸等为分析纯。
2 方法与结果
2.1 溶液制备
25-(OH)-D2标准溶液:以甲醇配制 10 μg/mL的 25-(OH)-D2贮备液,在15℃以下储存,备用;用5%牛血清蛋白的溶液制备 5,10,25,50,100 ng/mL 的不同浓度的标准溶液。25 -(OH)-D3标准溶液配制如25-(OH)-D2对照品溶液配制。以甲醇配置10 μg/mL的氘代25-(OH)-D3贮备液,储存在15℃以下备用;用去离子水制备400 ng/mL的氘代25-(OH)-D3溶液作为内标贮备溶液。
2.2 测定条件[4]
色谱条件:色谱柱为C18柱,流动相为0.1%甲酸水溶液-0.1%甲酸的甲醇溶液(15∶85),检测波长240 nm,柱温50℃,流速 0.5 mL/min,进样量 5 μL。
质谱条件:ESI+APCI组合离子源,正离子模式;离子源喷射电压5 000 V,离子源温度250℃,离子源喷雾流速5 L/min。此条件下,总离子流色谱图见图1。
2.3 样品前处理
空白血清前处理:用Chromabond C18EC固相萃取柱萃取血清样品,在250 μL血清中加入1 mL含2%甲酸的乙腈,静置15 min;将固相萃取柱安装在其专用真空架上,3 000 r离心10 min,顺序用1×1 mL甲醇,1×1 mL甲醇,去离子水(50∶50)淋洗固相萃取柱,然后将离心管的上清液转移至与预活化的固相萃取柱上。再次用1×1 mL甲醇,1×1 mL甲醇,去离子水(50∶50)淋洗固相萃取柱。开启真空30 s,然后每个柱子加200 μL正庚烷,静置2 min,然后将真空开至最大6 min。然后用甲醇和去离子水250 μL 顺序洗脱。
血清样品前处理:用Chromabond C18ec固相萃取柱萃取血清样品,在250 μL血清样品中加入内标溶液50 μL,方法同空白血清前处理。
2.4 维生素D2、维生素D3以及氘代内标的分析参数
结果见表1。
2.5 方法学考察
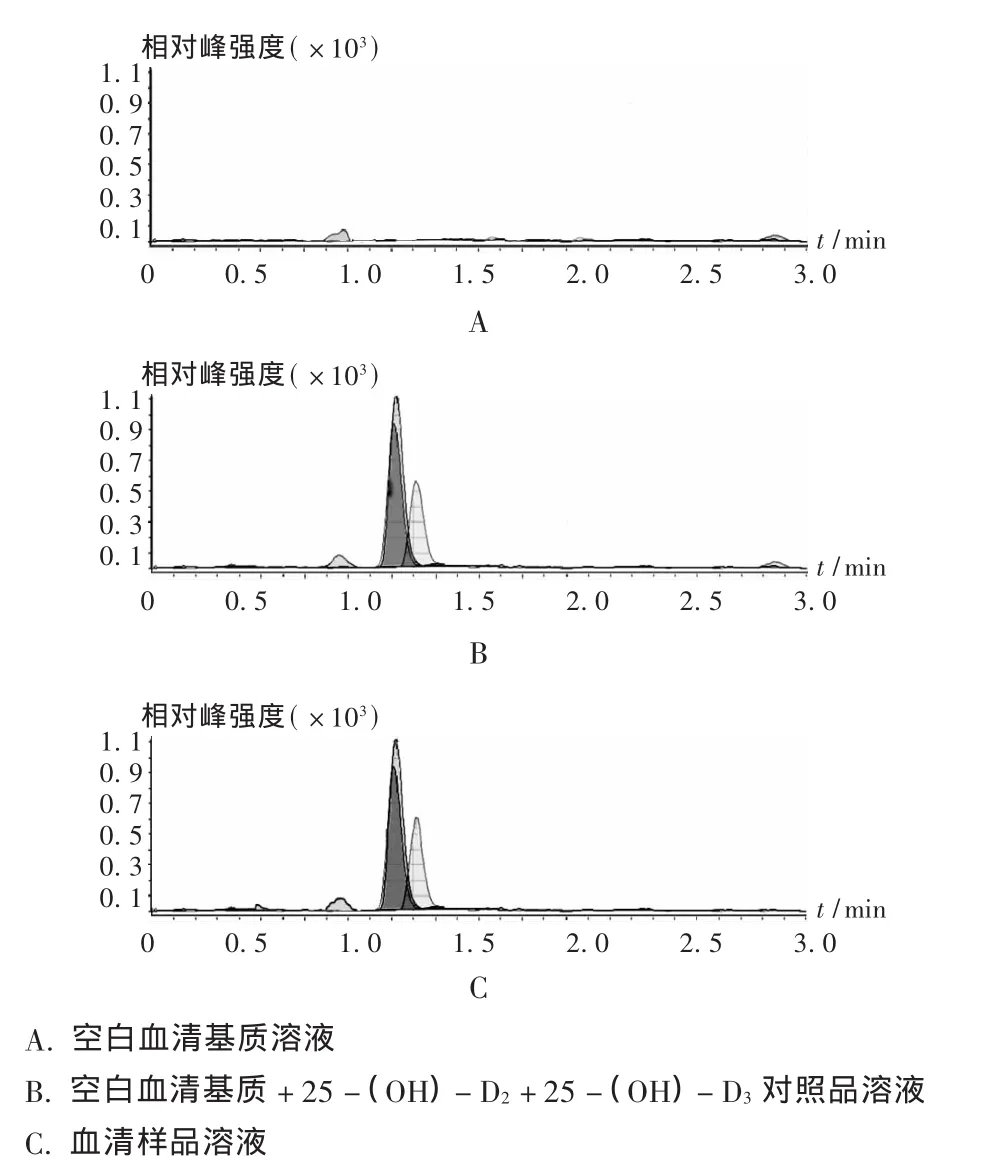
图1 总离子流色谱图
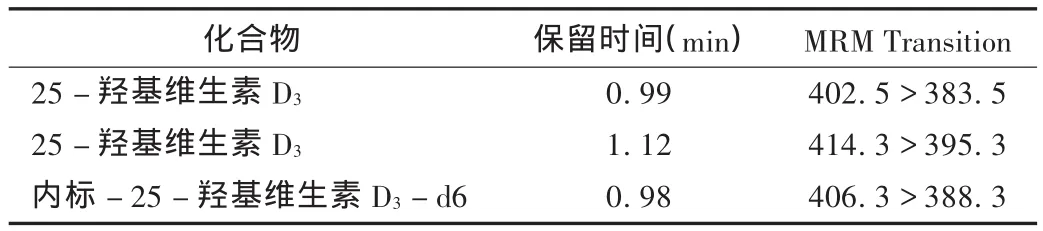
表1 维生素D2、维生素D3以及氘代内标的分析参数
线性考察:精密量取2.1项下25-(OH)-D2和25-(OH)-D3标准溶液,加流动相稀释至质量浓度 5,10,25,50,100 ng/mL,分别进样5 μL。记录峰面积,以质量浓度(C)为横坐标、峰面积(A)为纵坐标作图,得 25-(OH)-D2和 25-(OH)-D3回归方程分别为 A=0.015 8 C+0.002 7,R2=0.999 2;A=0.034 8C -0.013 5,R2=0.999 5。结果表明,25-(OH)-D2和 25-(OH)-D3质量浓度在5~100 ng/mL范围内与峰面积有良好的线性关系。
日内精密度试验:精密量取2.1项下25-(OH)-D2和25-(OH)-D3标准溶液,流动相配制为 10,25,50 ng/mL 的高、中、低3个质量浓度的25-(OH)-D2和25-(OH)-D3溶液各3份。按2.2项下测定条件,每个质量浓度分别进样进行含量测定,记录色谱峰面积。结果25-(OH)-D2和25-(OH)-D3高、中、低3 个浓度日内精密度 RSD 分别为 3.71% ,2.66% ,1.29% 和3.57%,2.21%,1.53%,RSD 均小于 5%,表明日内精密度较好。
日间精密度、稳定性试验:精密量取2.1项下25-(OH)-D2和25-(OH)-D3对照品溶液,流动相配制为10,25,50 ng/mL的高、中、低3个浓度的25-(OH)-D2和25-(OH)-D3溶液,密封避光于4℃保存。按2.2项下色谱条件,同一溶液进样含量测定5 d,记录色谱峰面积,计算供试品测得的质量浓度。计算得25-(OH)-D2和25-(OH)-D3高、中、低3个质量浓度日内精密度RSD 分别为 7.10%,5.25%,4.69%和 6.87%,5.30%,4.03%。结果5 d内含量测定 RSD都小于10%,表明该方法日内精密度好,且5 d内25-(OH)-D2和25-(OH)-D3稳定性较好。
提取回收率:取质量浓度为10,25,50 μg/L的血清标样50 μL各5份,按2.3项下样品处理方法处理后,氮气吹干,残渣用50 μL流动相复溶解,涡旋 2 min,12 000 r/min离心 10 min,血清处理后25-(OH)-D2和25-(OH)-D3质量浓度的理论推算值为 9.9,24.75,49.5 μg/L 和 9.95,24.87,49.75 μg/L,取 5 μL注入高效液相色谱-质谱仪,测定样品峰面积A。另用流动相配制 9.9,24.75,49.5 μg/L 和 9.95,24.87,49.75 μg/L 质量浓度的 25-(OH)-D2和 25-(OH)-D3溶液,进样 5 μL,记录峰面积 A,按提取回收率公式为提取回收率=A血清/A标准×100%。结果提取回收率分别为 83.23% ,80.55% ,76.34% 和 85.21% ,83.10%,79.44%,RSD 均小于 8%。
回收率试验:取 2.1项下 25-(OH)-D2和 25-(OH)-D3标准溶液,配制质量浓度为 5.0,10.0,25.0,50.0,100.0 μg/L 的血浆标样各5份,按2.3项下血清样品处理方法处理后,取5 μL注入高效液相色谱-质谱,测定药物峰面积 A及内标峰面积 A内,计算药物峰面积与内标的峰面积比值 Y(A/A内),按回归方程 A=0.016 0 C+0.002 9,A=0.033 5 C -0.013 8 求出对应质量浓度。结果25-(OH)-D2和25-(OH)-D3的方法回收率分别 为 108.23% ,100.56% ,98.73% ,96.19% ,98.55% 和106.16% ,101.15% ,100.53% ,99.17% ,97.10% ,RSD 分别为7.02% ,5.71% ,4.43% ,3.80% ,2.01% 和 6.72% ,3.14% ,3.49% ,3.32% ,1.65%。
2.5 真实样品检验与检测限
采用预先定量的新鲜血清样品对该法进行了验证,定量结果与以前高效液相色谱法结果相关性良好,相关系数为 R2=0.978。两种维生素 D的检测限和定量限分别为2 ng/mL和3 ng/mL。部分样品含量测定结果见表2。
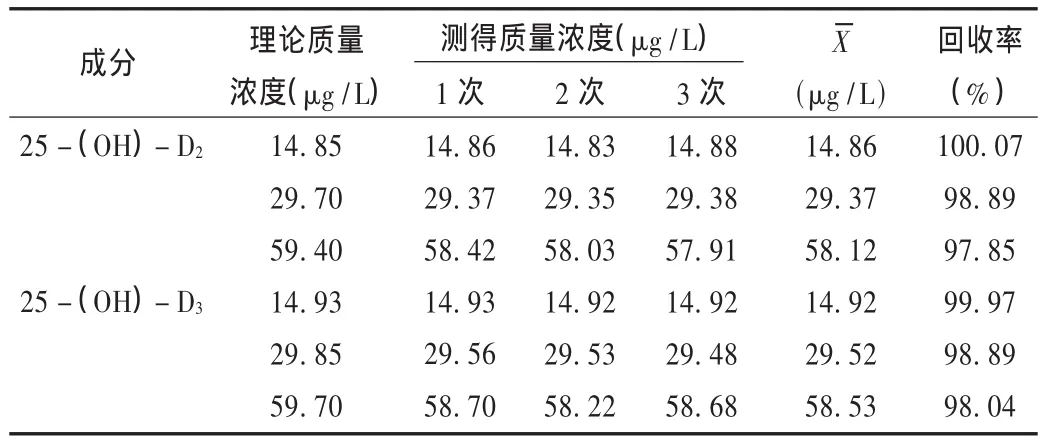
表2 血清样品含量测定结果
3 讨论
本研究中采用了一种新的液质联用方法检测血清中25-羟基维生素D2或D3的含量,采用固相萃取样品制备方法,有效抑制基质效应和由脂类及血清中其他化合物导致的离子抑制效应。
本试验中采用高效液相色谱-质谱法进行血清中维生素D的含量的测定,与常规高效液相色谱法、竞争结合试验、免疫测定法比较,可同时血清中维生素D2和维生素D3的含量,且测定分析时间短,分析结果更准确、可靠,可作为血清中维生素D检测的新方法,为临床中合理补充D族维生素、临床相关疾病的诊断提供参考。
[1]Chakraborti CK.Vitamin D as a promising anticancer agent[J].Indian J Pharmacol,2011,43(2):113 - 120.
[2]Chua G,Chan Y.Vitamin D status and peripheral arterial disease:evidence so far[J].Vasc Health Risk Manag,2011,7:671 - 675.
[3]Greta Snellman.Determining Vitamin D Status A Comparison between Commercially Available Assays[J].PLoS One,2010,5(7):e11 555.
[4]阳利龙,银雪花,祝文兵,等.HPLC测定血清中25-羟基维生素D3和维生素A及应用[J].儿科药学杂志,2010,1(3):41-42.

