狂犬病毒MHC限制性CTL与Th表位的预测与鉴定①
胡晓波 朱乃硕
(复旦大学生命科学学院分子免疫实验室 遗传工程国家重点实验室 生物医学研究院,上海200433)
狂犬病是一种由狂犬病毒引起的、危害极大的致命传染病。中国是狂犬病严重流行的国家之一,每年因狂犬病而死亡的人数高达3000人左右,位居世界第二[1-3]。疫苗是当前防治狂犬病的唯一途径,然而现有的狂犬疫苗存在免疫程序复杂、细胞免疫反应较弱等严重缺陷,无法保证在病毒潜伏期内产生较高的保护力,不利于狂犬病的防治工作。有研究表明T细胞产生的CTL与Th免疫应答反应在抗狂犬病毒感染时发挥了重要作用[4-6],因此筛选鉴定出相关的CTL与Th表位,并由此开发出具有高效预防或治疗性作用的表位疫苗对防治狂犬病工作有重要的意义,但迄今为止,仅报道了少数几个狂犬病毒的 CTL 与 Th 表位[4,7-9]。
随着生物信息学的迅速发展,计算机软件预测表位的方法和精确度有了很大的改善[10-12]。在狂犬病毒的四种蛋白中,糖蛋白(G蛋白)与核蛋白(N蛋白)是两种诱导细胞免疫与体液免疫的重要蛋白,因此本研究采用生物信息学软件 BIMAS[13]、RANKPEP[14]和 SYFPEITHI[11]对 G 蛋白及 N 蛋白的CTL与Th表位进行预测,并以淋巴细胞增殖试验、ELISPOT以及流式细胞法对获得的表位进行鉴定,初步获得2条BALB/c小鼠MHC限制性CTL和Th表位,为下一步开发狂犬病毒的表位疫苗提供实验依据。
1 材料与方法
1.1 实验动物 BALB/c小鼠24只,雌性,6~8周龄,25~30 g/只,购自中国人民解放军第二军医大学实验动物中心。
1.2 实验材料 人用狂犬病疫苗(Vero细胞)购自辽宁成大生物股份有限公司(生产批号:201106099)。ELISPOT试剂盒、小鼠淋巴细胞分离液购自深圳达科为生物技术有限公司。CCK-8试剂盒购自碧云天生物技术研究所。小鼠FITC-CD3、PE-CD4和PE/Cy5-CD8a荧光抗体购自美国Bio-Legend公司。RPMI1640培养基、胎牛血清购自美国Gibco公司。
1.3 方法
1.3.1 狂犬病毒G蛋白与N蛋白的表位预测 狂犬病毒的 G蛋白(gi_32440976)与 N蛋白(gi_294999043)氨基酸序列检索自NCBI数据库。其中CTL表位采用BIMAS及SYFPEITHI软件进行预测,Th表位采用RANKPEP进行预测,输入G蛋白或N蛋白全长序列,选择相应MHC表型及参数,按结果得分的高低各选择4条候选多肽用于鉴定实验。
1.3.2 多肽合成、溶解与分装 多肽合成由上海强耀生物科技有限公司完成,纯度≥90%,共计8条。合成的多肽分别溶解于DMSO中,浓度为5 mg/ml,-80℃保存备用。
1.3.3 小鼠分组与免疫 将BALB/c小鼠随机分为两组,即实验组和对照组,每组12只。其中实验组腹腔注射0.5 ml人用狂犬病疫苗(Vero细胞),对照组注射相同剂量的生理盐水。各组小鼠均在第0天和第7天各免疫一次,注射部位与剂量均相同。
1.3.4 多肽刺激的淋巴细胞增殖试验 小鼠末次免疫后10天断头处死,无菌取脾后研磨过滤,用淋巴细胞分离液制成单细胞悬液,调整细胞浓度为106个/ml,加入96 孔细胞培养板,100 μl/孔,同时加入稀释好的多肽,终浓度为20 μg/ml,阳性对照孔加入终稀释度为1∶10的狂犬病疫苗原液,空白对照孔为普通1640培养基。将淋巴细胞置于37℃,5%CO2饱和湿度条件下进行培养。5天后每孔加入10 μl CCK-8溶液,继续培养4小时,于450 nm处测定吸光度A值,结果以3复孔的平均A450值表示。
1.3.5 ELISPOT法筛选可刺激分泌 IL-4和 IFN-γ的多肽 脾细胞分离后,调整细胞浓度为106个/ml,每只小鼠脾细胞样品设4个复孔。其余步骤按照试剂盒说明操作:每孔加入100 μl细胞,阳性对照加入10 μl PHA,实验孔加入 10 μl终浓度为 20 μg/ml的合成多肽,空白对照孔为普通1640培养基。将细胞置于37℃,5%CO2饱和湿度条件下培养20小时,弃去细胞样品,洗涤后加入100 μl生物素标记的抗体,孵育1小时后再次洗涤,加入100 μl酶标亲和素,孵育1小时。最后一次洗涤后加入100 μl显色液于室温下(25℃)显色25分钟,观察斑点形成。显色完毕后,用去离子水洗板3次终止反应,将板放置于室温避光阴凉处,干燥后用ELISPOT读板机进行读板计数。
1.3.6 流式细胞法筛选可刺激T细胞反应的多肽脾细胞分离后,调整细胞浓度为107个/ml,加入96孔细胞培养板,100 μl/孔,同时加入稀释好的多肽,终浓度为20 μg/ml。淋巴细胞培养5天后,收集细胞,每管加入100 μl细胞悬液,并加入FITC antimouse CD3、PE anti-mouse CD4以及 PE/Cy5 antimouse CD8a荧光抗体各2 μl,冰上避光孵育20分钟。然后离心洗涤细胞2次,去除残留的荧光抗体。最后以0.5 ml细胞染色缓冲液重悬细胞,转移至流式管中,上机检测。
1.4 统计学分析 用统计学软件SPSS19.0进行统计学处理,结果以±s表示,组间均数差异以t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 狂犬病毒G蛋白与N蛋白的表位预测及合成 对NCBI数据库中获得的狂犬病毒G蛋白与N蛋白的序列进行CTL表位以及Th表位预测。小鼠的MHCⅠ类分子包括 H-2kd、H-2Dd和 H-2Ld三个亚类,MHCⅡ类分子包括I-Ad和I-Ed两个亚类。因此为了获得CTL和Th表位,需要分别对这几个亚类进行分析与预测。对于MHCⅠ类分子,使用SYFPEITHI和BIMAS软件进行预测,选择共同得分较高的4条序列。对于MHCⅡ类分子,使用RANKPEP软件进行预测,选择得分较高的4条序列。以上多肽合成后经 HPLC纯化,纯度在91.34% ~96.65%之间。经质谱分析,合成的多肽实际相对分子质量与理论相符,说明合成的多肽正确,可用于后续鉴定实验。所合成的多肽基本信息见表1和表2。
2.2 经多肽刺激后淋巴细胞增殖情况 所合成的8条多肽体外刺激经狂犬疫苗免疫后的BALB/c小鼠脾淋巴细胞,检测淋巴细胞增殖后的OD值变化,并以刺激指数SI(Stimulation index)值表示结果,SI=实验孔OD值/阴性孔OD值,如图1所示。以 SI>2作为判断淋巴细胞增殖阳性结果的标准,从结果中可以看出,多肽 G367-381、G137-151、G297-311和 G333-341能够有效刺激经狂犬疫苗免疫后的小鼠脾淋巴细胞增殖(SI>2),同时不能引起生理盐水对照组小鼠脾细胞的增殖(SI<2),因此这4条多肽具有成为表位的可能。
2.3 ELISPOT法筛选可刺激分泌IFN-γ和IL-4的多肽 为了进一步验证淋巴细胞增殖实验的结果以及判断多肽诱导细胞免疫反应的种类,使用ELISPOT法检测经多肽刺激的淋巴细胞分泌IL-4和IFN-γ的情况。ELISPOT结果中的每一个斑点代表一个分泌IFN-γ或IL-4的T淋巴细胞,称为斑点形成细胞(Spot forming cell,SFC),如图2所示。最后结果以SFC/106个脾细胞表示,反映机体细胞免疫的水平。由图3的结果可知,经淋巴细胞增殖法初步筛选到的4条多肽中,G367-381及G333-341诱导产生的分泌IFN-γ和IL-4的细胞数量均显著高于阴性对照组(P <0.05),而G137-151和G297-311诱导产生的分泌IFN-γ和IL-4的细胞数量与阴性对照组并无显著性差异(P >0.05),说明G367-381及G333-341可确认为狂犬病毒的潜在表位。而从分泌细胞因子的种类来看,这2条多肽均能诱导淋巴细胞分泌Th1型的细胞因子 IFN-γ以及 Th2型的细胞因子 IL-4,其中G367-381主要诱导分泌IL-4,G333-341主要诱导分泌IFN-γ。在先前的表位预测中,G367-381被预测为Th表位,G333-341被预测为CTL表位,因此这一结果提示不同的细胞表位可引起的细胞免疫反应种类有所不同。
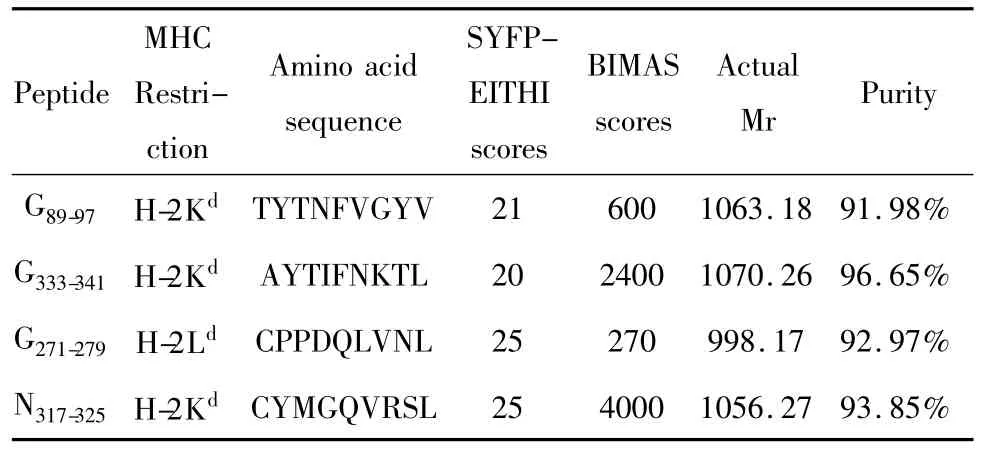
表1 狂犬病毒G蛋白与N蛋白CTL表位预测结果Tab.1 The information of the predicted CTL epitopes of glycoprotein and nucleoprotein of rabies virus
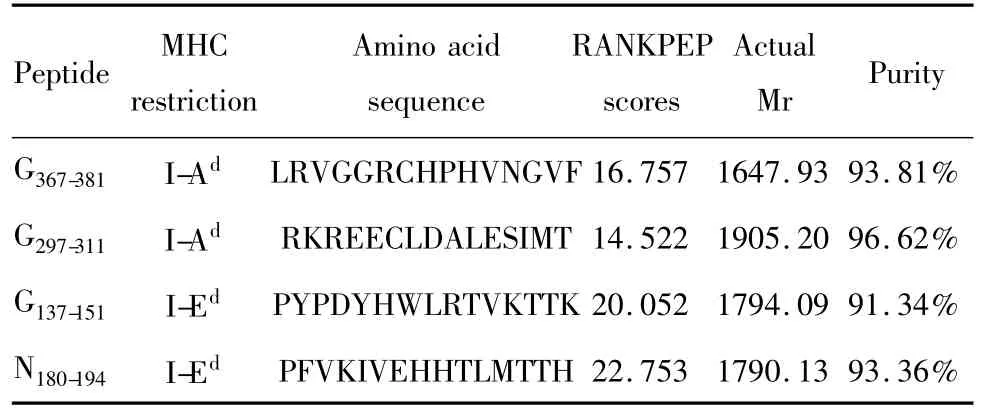
表2 狂犬病毒G蛋白与N蛋白Th表位预测结果Tab.2 The information of the predicted Th epitopes of glycoprotein and nucleoprotein of rabies virus
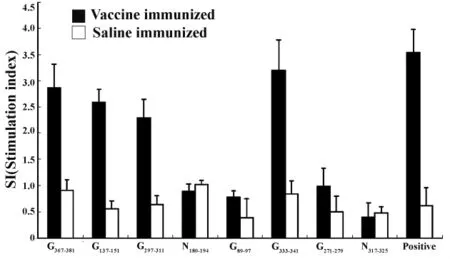
图1 合成的多肽刺激小鼠脾淋巴细胞增殖Fig.1 Proliferation of spleen cells of immunized mice after stimulation of synthetic peptides
图2 合成多肽刺激小鼠脾细胞分泌IFN-γ和IL-4 ELISPOT斑点图Fig.2 Spot forming pictures of IFN-γ-and IL-4-secreting splenocytes of immunized mice induced by synthetic peptides
2.4 流式细胞法筛选可刺激T细胞反应的多肽为了进一步验证ELISPOT筛选法的结果以及分析候选表位的种类,使用流式细胞法检测多肽对CD4+与CD8+T细胞刺激增殖的情况。由于CD3是T细胞的特有标记,因此以CD3设门,检测增殖的CD3+CD4+T细胞以及CD3+CD8+T细胞占脾淋巴细胞的百分比。结果如表3显示,G367-381及G333-341刺激增殖的CD3+CD4+T细胞以及CD3+CD8+T细胞百分比均显著高于阴性对照组(P<0.05),而G137-151和G297-311刺激增殖的CD3+CD4+T细胞以及CD3+CD8+T细胞百分比与阴性对照组相比无显著差异(P>0.05),这一结果与先前ELISPOT的结果相符,进一步表明多肽G367-381及G333-341可能成为狂犬病毒的潜在表位。从诱导产生的细胞免疫反应种类来分析,2条多肽中,G367-381主要诱导产生以CD3+CD4+T细胞增殖为主的Th型免疫应答,而G333-341则主要诱导产生以CD3+CD8+T细胞增殖为主的CTL型免疫应答,综合ELISPOT结果中IL-4与IFN-γ细胞因子的分泌情况,可初步确定G367-381是潜在的Th表位,而G333-341则可能成为CTL表位。
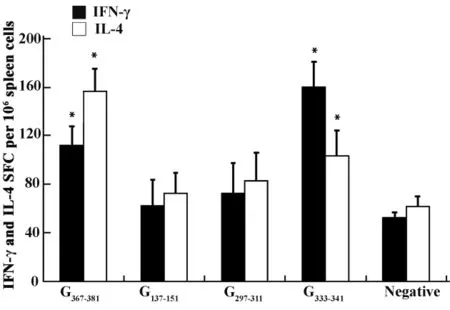
图3 合成的多肽刺激小鼠脾细胞分泌IFN-γ和IL-4Fig.3 IFN-γ and IL-4 secreting in splenocytes of immunized mice induced by synthetic peptides
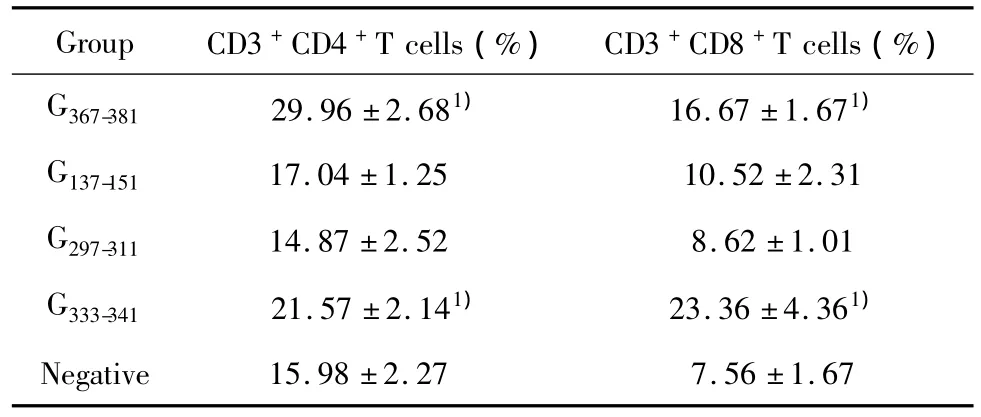
表3 合成多肽刺激小鼠CD3+CD4+T细胞和CD3+CD8+T细胞增殖情况Tab.3 Proliferation of CD3+CD4+T and CD3+CD8+T cells in mice induced by synthetic peptides
3 讨论
现有的狂犬疫苗尽管能够提供一定的保护作用,但往往存在免疫原性较差、抗体产生缓慢、免疫程序繁琐等不足,在严重的情况下,患者还需要同时注射昂贵的免疫球蛋白进行辅助治疗[11]。机体在狂犬病毒侵入后,一般通过产生中和抗体以及细胞免疫反应两种途径清除感染,中和抗体只能清除游离于细胞外的病毒,而对于进入细胞内的病毒,只能依靠细胞免疫的杀伤作用进行清除,因此细胞免疫对于预防和清除狂犬病毒的感染非常重要[17]。一些研究也表明,CD4+和CD8+T细胞诱导的Th以及CTL免疫应答能够通过分泌一系列细胞因子如IL-4、TNF-α、IFN-γ等在抵御狂犬病毒感染的过程中发挥关键的作用[18]。
表位疫苗作为近年来新发展起来的一种新型疫苗技术,其含有能够被机体免疫细胞直接识别的MHC限制性多肽,能够产生具有细胞杀伤作用的CTL和促进中和抗体产生的Th免疫应答反应,对于清除病毒感染和提供免疫保护具有重要的作用[19,20]。目前,表位疫苗已经在部分病毒疫苗的研究中取得了显著的成效,如针对A型流感病毒M2蛋白的表位疫苗已经在小鼠和恒河猴上进行了临床前研究,并取得了一定的效果[21];丙型肝炎(HCV)的治疗性表位疫苗经过人体实验也证明了其较好的免疫原性和安全性[22]。这些结果都表明表位疫苗能够克服传统疫苗的种种不足,是一种具有广阔前景的新型疫苗,但同时表位疫苗还存在免疫原性较弱、在体内容易被降解等不足,需要进一步的改进。
研究表位疫苗首先必须筛选到合适的多肽表位,在以往筛选表位的过程中,重叠肽法是一种经典的实验方法,此方法不易发生漏选的情况,但是需要合成大量的肽段,所需时间较长,费用较高,对于较长的蛋白序列并不适用[23]。近年来,随着人们对MHCⅠ类及Ⅱ类分子与抗原肽结合规律的逐步认识,用生物信息学研究细胞表位的方法已经得到了广泛的应用,与重叠肽法相比,计算机软件预测能够节省大量时间与成本,并且提高筛选的准确率[24]。
本研究利用生物信息学软件 BIMAS、SYFPEITHI以及RANKPEP对狂犬病毒的糖蛋白以及核蛋白的CTL和Th表位进行预测,其中BIMAS和SYFPEITHI通过矩阵法分析抗原每一种氨基酸在MHCⅠ类配体特定位点上出现的频率来预测CTL表位[12]。RANKPEP通过位置特异性打分矩阵的算法对较长片段的Th表位进行预测,克服了之前预测软件只对简单序列模式进行预测的不足,故准确率较高[14]。本研究通过运用三种生物信息学软件,从狂犬病毒的糖蛋白与核蛋白序列中预测出8条可能成为细胞表位的多肽,并利用体外淋巴细胞增殖实验进行初步筛选,以及ELISPOT和流式细胞法进行进一步的筛选,最终获得2条可能成为细胞表位的多肽G367-381及G333-341,并通过实验结果证明了G367-381能诱导Th型免疫应答,是潜在的Th表位,而G333-341则可诱导CTL型的免疫应答,可能成为CTL表位。
综上所述,本研究以BALB/c小鼠为哺乳动物模型,结合生物信息学与免疫学实验方法,预测并筛选出2条狂犬病毒蛋白的Th及CTL表位,这将为进一步开发狂犬病毒的表位疫苗及其应用提供实验依据。
1 Faber M,Li J,Kean R B et al.Effective preexposure and postexposure prophylaxis of rabies with a highly attenuated recombinant rabies virus[J] . ProcNatlAcadSciUSA,2009;106(27):11300-11305.
2 Yu J,Li H,Tang Q et al.The spatial and temporal dynamics of rabies in China[J].PLoS Negl Trop Dis,2012;6(5):e1640.
3 Zhang L,Wilson D P.Trends in notifiable infectious diseases in China:implications for surveillance and population health policy[J].PLoS One,2012;7(2):e31076.
4 Dietzschold B,Wang H H,Rupprecht C E et al.Induction of protective immunity against rabies by immunization with rabies virus ribonucleoprotein[J] .Proc Natl Acad Sci USA,1987;84(24):9165-9169.
5 Dietzschold B,Ertl H C.New developments in the pre-and post-exposure treatment of rabies[J].Crit Rev Immunol,1991;10(5):427-439.
6 Fu Z F,Dietzschold B,Schumacher C L et al.Rabies virus nucleoprotein expressed in and purified from insect cells is efficacious as a vaccine[J].Proc Natl Acad Sci USA,1991;88(5):2001-2005.
7 Ertl H C,Dietzschold B,Gore M et al.Induction of rabies virus-specific T-helper cells by synthetic peptides that carry dominant T-helper cell epitopes of the viral ribonucleoprotein[J].J Virol,1989;63(7):2885-2892.
8 Larson J K,Wunner W H,Otvos L J et al.Identification of an immunodominant epitope within the phosphoprotein of rabies virus that is recognized by both class I-and class II-restricted T cells[J].J Virol,1991;65(11):5673-5679.
9 Otvos L J,Urge L,Xiang Z Q et al.Glycosylation of synthetic T helper cell epitopic peptides influences their antigenic potency and conformation in a sugar location-specific manner[J].Biochim Biophys Acta,1994;1224(1):68-76.
10 Hagmann M.Computers aid vaccine design[J].Science,2000;290(5489):80-82.
11 Rammensee H,Bachmann J,Emmerich N P et al.SYFPEITHI:database for MHC ligands and peptide motifs[J].Immunogenetics,1999;50(3-4):213-219.
12 Schuler M M,Nastke M D,Stevanovikc S.SYFPEITHI:database for searching and T-cell epitope prediction[J].Methods Mol Biol,2007;409:75-93.
13 Parker K C,Bednarek M A,Coligan J E.Scheme for ranking potential HLA-A2 binding peptides based on independent binding of individual peptide side-chains[J] .J Immunol,1994;152(1):163-175.
14 Reche P A,Glutting J P,Zhang H et al.Enhancement to the RANKPEP resource for the prediction of peptide binding to MHC molecules using profiles[J] .Immunogenetics,2004;56(6):405-419.
15 Ertl H C.Novel vaccines to human rabies[J].PLoS Negl Trop Dis,2009;3(9):e515.
16 Shen E,Li L,Li L et al.PIKA as an adjuvant enhances specific humoral and cellular immune responses following the vaccination of mice with HBsAg plus PIKA [J] .Cell Mol Immunol,2007;4(2):113-120.
17 Moore S M,Wilkerson M J,Davis R D et al.Detection of cellular immunity to rabies antigens in human vaccinees[J].J Clin Immunol,2006;26(6):533-545.
18 Hooper D C.The role of immune responses in the pathogenesis of rabies[J].J Neurovirol,2005;11(1):88-92.
19 Kirnbauer R,Booy F,Cheng N et al.Papillomavirus L1 major capsid protein self-assembles into virus-like particles that are highly immunogenic[J].Proc Natl Acad Sci USA,1992;89(24):12180-12184.
20 Martinez C,Dalsgaard K,Lopez D T J et al.Production of porcine parvovirus empty capsids with high immunogenic activity[J].Vaccine,1992;10(10):684-690.
21 Fan J,Liang X,Horton M S et al.Preclinical study of influenza virus A M2 peptide conjugate vaccines in mice,ferrets,and rhesus monkeys[J].Vaccine,2004;22(23-24):2993-3003.
22 Firbas C,Jilma B,Tauber E et al.Immunogenicity and safety of a novel therapeutic hepatitis C virus(HCV)peptide vaccine:a randomized,placebo controlled trial for dose optimization in 128 healthy subjects[J].Vaccine,2006;24(20):4343-4353.
23 Aoshi T,Suzuki M,Uchijima M et al.Expression mapping using a retroviral vector for CD8+T cell epitopes:definition of a Mycobacterium tuberculosis peptide presented by H2-Dd[J] .J Immunol Methods,2005;298(1-2):21-34.
24 Reche P A,Glutting J P,Reinherz E L.Prediction of MHC class I binding peptides using profile motifs[J] .Hum Immunol,2002;63(9):701-709.