ANKIB1单克隆抗体的制备及应用①
杨子善 谢云飞 解博红 任太芳 王永淑 丰慧根 刘世饶 马振玲 (新乡医学院生命科学技术学院,河南省“遗传性疾病与分子靶向药物”高校重点实验室培育基地,新乡453003)
锚蛋白重复序列(Ankyrin repeat,ANK)是最常见的一种介导蛋白质-蛋白质相互作用的蛋白模体,常与 F-box、锌指、PDZ(PSD-95/Dlg/ZO-1)、离子转运结构域和蛋白激酶等结构域共存,其中F-box与蛋白质泛素化密切相关[1-3]。RING(Really interesting new gene)结构域则是E3泛素连接酶中最常见的结构域,大部分含RING结构域的蛋白具有E3连接酶活性[4]。
含锚蛋白重复结构域和IBR结构域蛋白1(Ankyrin repeat and IBR domain-containing protein 1,ANKIB1)又称KIAA1386,由1 089个氨基酸残基组成,含有丰富的结构域和模体,其中包括RING-IBRRING(RBR)结构域、ANK模体和泛素结合模体(Ubiquitin-interacting motif,UIM)。RBR 由 两 个RING结构域和1个与RING同源的IBR(in-between RING)结构域组成,已经发现的12种人源RBR蛋白中,除了ANKIB1和RNF144A研究太少尚无定论,其余10种均已证明具有 E3泛素连接酶活性[5]。因此,ANKIB1极可能因为RBR结构域的存在而具有E3泛素连接酶活性,或者是E3连接酶复合体的一部分。ANKIB1是唯一含有ANK和UIM结构的RBR蛋白,UIM广泛参与泛素分子的转运和蛋白质的泛素化修饰[6],两种模体很可能赋予ANKIB1特殊的修饰途径和分子机制。然而ANKIB1发现十多年来,相关研究报道极少,目前仅知的功能是其UIM能够结合泛素和促进S5a蛋白的泛素化[7,8]。Muscarella 等[9]在一个脑海绵状血管瘤(CCM)家族中发现,全部3个病人的同一条染色体缺失ANKIB1基因90%的序列,但ANKIB1基因与CCM是否有关尚需进一步研究。
为了探索ANKIB1的表达、功能和分子机制,我们在大肠杆菌中表达和纯化了ANKIB1重组蛋白,并通过杂交瘤技术制备了ANKIB1单克隆抗体,为ANKIB1的研究提供了有效的工具。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Pyrobest DNA聚合酶购自大连宝生物公司,引物由苏州金唯智生物科技有限公司合成。限制性内切酶、T4 DNA连接酶和Xa因子购自NEB公司,质粒提取试剂盒和DNA胶回收试剂盒购自上海生工。DNA分子量标准购自天根生化科技公司,蛋白分子量标准购自 Fermentas公司。Glutathione Sepharose 4B凝胶购自GE Healthcare公司。弗氏完全佐剂、弗氏不完全佐剂和PEG3500购自Sigma公司,HAT和 HT购自Biological Industry公司,抗体纯化试剂盒购自万华士(北京)生物科技有限公司,抗体分型试剂盒购自北京义翘神州生物技术有限公司,兔抗人c-myc单克隆抗体(#2278)购自Cell Signaling Technology公司,兔抗人GST(谷胱甘肽S转移酶)抗体、HRP标记山羊抗兔和山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司。ECL试剂盒购自Thermo scientific公司。RPMI1640和DMEM培养基购自Hyclone公司,胎牛血清和胰酶购自Gibco公司,GenEscortⅡ转染试剂购自南京慧基生物技术有限公司。质粒pGEX-5X-3和pCMV-Myc为本实验室保存,包含人ANKIB1基因部分或全长CDS的质粒pEGFP-N1-ANKIB1Δ3和pCMV-Myc-ANKIB1由本实验室构建。
1.1.2 菌株、细胞、实验动物和人胚胎 大肠杆菌DH5α和BL21(DE3)为本实验室保存。HEK293ET细胞购自中国医学科学院基础医学研究所细胞资源中心,SP2/0骨髓瘤细胞由新乡医学院检验系王辉教授惠赠,BALB/c小鼠由河南科技学院动物科学院王选年教授惠赠,昆明系小白鼠和SD大鼠由新乡医学院实验动物中心提供。不可避免流产人胚胎经新乡医学院第三附属医院伦理委员会批准采集。
1.2 方法
1.2.1 表达载体的构建 按照姊妹PCR克隆法[10]构建表达载体 pCMV-Myc-ANKIB1(1-480)和pGEX-5X-ANKIB1(1-480)。PCR以表达人ANKIB1蛋白(Q9P2G1,1089 aa)1-741氨基酸残基的pEGFP-N1-ANKIB1Δ3为模板,4条引物的序列分别为ANK-FL:5'-GATCTCCATGGGAAATACAACC-3',ANK-FS:5'-TCCATGGGAAATACAACC-3',ANK-RL:5'-GGCCGCTCATGTTTGGCAGTCACAAG-3',ANK-RS:5'-GCTCATGTTTGGCAGTCACAAG-3'。ANKIB1(1-480)在质粒pCMV-Myc和pGEX-5X-3中的克隆位点分别是BglⅡ/NotⅠ和BamH Ⅰ/NotⅠ,DNA测序确认插入片段的序列。
1.2.2 GST 和 GST-ANKIB1(1-480)在大肠杆菌中的表达和纯化 取pGEX-5X-3和pGEX-5XANKIB1(1-480)分别转化E.coli BL21(DE3),然后分别挑取单克隆接种于3 ml 2×YTA培养基中,37℃培养过夜。取过夜培养菌液,按1∶100的比例分别接种到50~100 ml预热的2×YTA培养基中,37℃培养使A600达到0.6 ~0.8,加入IPTG 至终浓度0.1 mmol/L,20℃培养5小时。离心收集菌体,加入STE(150mmol/LNaCl,10mmol/LTris-HCl,pH7.5,1 mmol/L EDTA,100 μg/ml 溶菌酶,3%Triton X-100)裂解缓冲液,超声波破碎,4℃ 12 000 r/min离心10分钟,收集上清。利用 Glutathione sepharose 4B亲和层析柱分别纯化GST和GSTANKIB1(1-480)重组蛋白,使用PBS透析去除谷胱甘肽,SDS-PAGE分析蛋白纯度,BCA法测定蛋白浓度。
1.2.3 小鼠免疫和阳性杂交瘤细胞株的筛选 选择3只8周龄雌性BALB/c健康小鼠,取纯化的GST-ANKIB1(1-480)重组蛋白腹腔注射免疫小鼠(100 μg/只)。经过3次免疫后尾静脉采血,ELISA测定血清效价,选择ELISA效价高于1∶10 000的小鼠进行冲击免疫。3天后眼眶采血,取脾脏细胞与SP2/0骨髓瘤细胞混合,使用PEG法融合[11]。加入含有20%胎牛血清的RPMI1640培养基重悬细胞,100 μl/孔分配到含有饲养细胞的96孔板中培养,24小时后每孔加入100 μl含有2×HAT的完全培养基。待细胞数量达到孔底面积的1/3时,采用间接ELISA筛选GST-ANKIB1(1-480)阳性的克隆。通过有限稀释法连续克隆化3次,以保证获得纯净的单克隆细胞株。采用间接ELISA筛选抗GST阴性、抗GST-ANKIB1(1-480)阳性的杂交瘤细胞株。
1.2.4 间接ELISA检测单抗 使用纯化的GST或GST-ANKIB1(1-480)包被酶标板,加入细胞培养上清或腹水,37℃孵育1小时,PBST洗涤3次。加入HRP标记的山羊抗小鼠IgG,37℃孵育1小时,PBST洗涤3次。加入底物和TMB显色液,室温显色5~10分钟,使用酶标仪测定OD450。细胞融合当天所取免疫BALB/c小鼠的血清作为阳性对照,未免疫BALB/c小鼠的血清作为阴性对照,未接种细胞培养孔中的培养基作为空白对照。
1.2.5 腹水制备、抗体纯化和亚类鉴定 扩大培养阳性杂交瘤细胞,按每只小鼠5×106个杂交瘤细胞腹腔注射小鼠,10~14天后收集腹水,抗体纯化和亚类鉴定按照试剂盒说明书进行,BCA法测定抗体浓度。
1.2.6 细胞转染和脑蛋白制备 使用含有2 mmol/L L-谷氨酰胺和10%胎牛血清的DMEM高糖培养基培养HEK293ET细胞,取对数生长期细胞接种于35 mm或10 cm培养皿中,16~24小时后按说明书转染,转染24小时后使用含有蛋白酶抑制剂的RIPA缓冲液[150 mmol/L氯化钠,1 mmol/L EDTA,50 mmol/L Tris-HCl,pH8.0,1% 乙基苯基聚乙二醇(Nonidet P-40),1 mmol/L苯甲基磺酰氟(PMSF),0.5 μg/ml亮抑酶肽(Leupeptin),0.5 μg/ml胃酶抑素(Pepstatin),1 μg/ml抑肽酶(Aprotinin)]裂解细胞,4℃ 12 000 r/min离心10分钟收集上清。取刚出生的昆明系小白鼠和SD大鼠以及5月龄人胚胎脑组织200 mg,匀浆后分离细胞,加入RIPA缓冲液裂解细胞,4℃ 12 000 r/min离心10分钟收集上清。
1.2.7 免疫沉淀 取0.5 ml转染过 pCMV-Myc-ANKIB1的细胞裂解液,加入2 μg ANKIB1单克隆抗体,4℃孵育2小时,然后加入蛋白G-琼脂糖凝胶(Protein G-agarose),4℃混合过夜。使用RIPA缓冲液漂洗3次,然后加入1×SDS上样缓冲液煮沸洗脱。
1.2.8 Western blot 蛋白样品经SDS-PAGE分离后转移至PVDF膜上,浸泡于5%脱脂牛奶室温封闭1小时。加入第一抗体(anti-GST、anti-myc或anti-ANKIB1),室温孵育1小时或4℃过夜。TBST洗涤3次后加入HRP标记山羊抗兔或山羊抗小鼠IgG,37℃孵育1小时,TBST漂洗3次。加入ECL化学发光试剂,X光胶片感光记录光信号。
2 结果
2.1 重组质粒的构建与鉴定 采用姊妹PCR克隆法成功构建了pCMV-Myc-ANKIB1(1-480)和pGEX-5X-ANKIB1(1-480)重组载体(图1)。在构建表达载体的过程中,杂交ANKIB1(1-480)片段与经过BglⅡ/NotⅠ双酶切的pCMV-Myc质粒能够有效连接,但与经过BamHⅠ/NotⅠ酶切具有相同黏性末端的pGEX-5X-3连接效率很低,推测不同质粒载体的二级或高级结构对连接反应有较大影响。
2.2 抗原的表达与纯化 经过诱导条件的优化,当培养温度降至20℃,重组E.coli在含有0.1 mmol/L IPTG的2×YT培养基中培养3~5小时,可溶性蛋白组分中出现一条稳定的蛋白条带,其分子量与GST-ANKIB1(1-480)重组蛋白的理论值(80.2 kD)相符(图2A),同时菌体中还有少量包涵体存在。相比之下,0.05 mmol/L IPTG只能诱导表达很低水平的可溶性GST-ANKIB1(1-480)蛋白。经过Glutathione-sepharose 4B一步亲和层析,获得了很好的纯化效果(图2B)。
2.3 杂交瘤细胞的筛选 初次ELISA筛选得到了2孔抗GST-ANKIB1(1-480)阳性、抗GST阴性和5孔抗GST-ANKIB1(1-480)及抗GST双阳性的杂交瘤克隆,经过连续3次克隆化,从抗GST-ANKIB1(1-480)阳性、抗GST阴性的孔中筛选出1株能够稳定分泌ANKIB1抗体的杂交瘤克隆株,命名为7A9。随机取5孔克隆化7A9细胞的培养上清,间接ELISA全部表现为抗GST-ANKIB1(1-480)阳性、抗GST阴性(表1)。Western blot得到了和ELISA一致的结果,7A9抗体能够特异性识别GST-ANKIB1(1-480)和 Myc-ANKIB1(1-480)(图 3),表明 7A9能够分泌ANKIB1特异性抗体。使用兔抗小鼠IgG1、IgG2a、IgG2b、IgG3 和 IgM 单克隆抗体分别对7A9抗体的亚类进行了鉴定,ELISA结果显示该抗体属于IgG1。
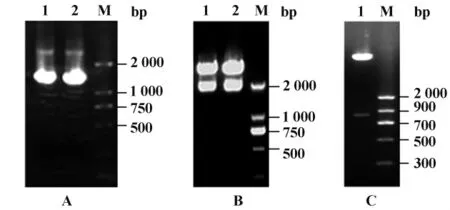
图1 ANKIB1(1-480)表达质粒的酶切鉴定Fig.1 Digestion of ANKIB1(1-480)expression vectors
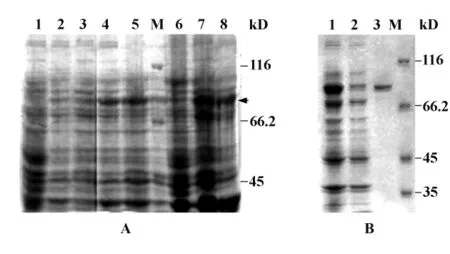
图2 SDS-PAGE检测可溶性GST-ANKIB1(1-480)Fig.2 SDS-PAGE analysis of soluble GST-ANKIB1(1-480)

表1 间接ELISA检测7A9抗体特异性Tab.1 Specificity of 7A9 McAb detected by indirect ELISA
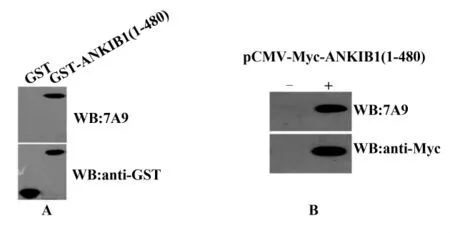
图3 Western blot检测7A9抗体的特异性Fig.3 Western blot analysis of the 7A9 McAb specificity

图4 Western blot检测内源性和过表达ANKIB1Fig.4 Detection ofendogenousand overexpressed ANKIB1 by Western blot

图5 Western blot检测免疫沉淀的ANKIB1Fig.5 Western blot analysis of immunoprecipitated ANKIB1
2.4 ANKIB1在哺乳动物细胞中的表达 我们使用纯化的7A9抗体检测了人、大鼠和小鼠脑细胞以及HEK293ET细胞中ANKIB1蛋白的表达情况,Western blot结果显示,所有细胞中均存在至少两种分子量的ANKIB1蛋白,其中大蛋白的分子量与Q9P2G1的理论分子量相符(121.9 kD),最小蛋白的分子量约为88 kD,人胎脑中还有一条特异的约110 kD的蛋白带(图4B),两种小蛋白可能是ANKIB1转录本选择性剪接并翻译的产物。3种蛋白在人、大鼠和小鼠脑细胞中的表达存在明显差异,可能是种属不同所致,也可能与三种组织细胞的发育程度不完全一致有关。令人意外的是,在HEK293ET细胞中过表达的Myc-ANKIB1重组蛋白分子量接近150 kD(图4A),与其理论分子量(125.1 kD)相差很大。
2.5 ANKIB1单抗在免疫沉淀中的应用 为了确定7A9单抗的应用范围,我们通过免疫沉淀实验检测了其对不同分子量ANKIB1蛋白的免疫沉降作用,结果显示7A9单抗对过表达和121.9 kD的内源性ANKIB1蛋白均有很好的免疫沉降作用,对约88 kD的内源性ANKIB1蛋白的免疫沉降作用较差(图5)。
3 讨论
为了使用不含外源氨基酸序列的ANKIB1(1-480)蛋白作为抗原免疫BALB/c小鼠,避免在筛选阳性杂交瘤细胞时受到GST特异性克隆的干扰,我们曾使用Xa因子消化GST-ANKIB1(1-480)融合蛋白以切除GST。可能是融合蛋白的构象掩盖了Xa因子的识别位点,多次消化均不能从GST-ANKIB1(1-480)中切除 GST,所以我们直接使用 GSTANKIB1(1-480)融合蛋白作为抗原免疫BALB/c小鼠。在杂交瘤筛选过程中,分别以 GST和 GSTANKIB1(1-480)蛋白作为抗原包被酶标板进行间接ELISA检测,从阳性杂交瘤中剔除了分泌GST抗体的阳性克隆。为了保证ANKIB1抗体的特异性,我们进一步通过Western blot进行鉴定,包括分别使用GST抗体和7A9抗体检测GST-ANKIB1(1-480),另外使用Myc抗体和7A9抗体检测Myc-ANKIB1(1-480),7A9抗体的检测结果与GST以及Myc抗体完全一致,充分说明7A9抗体是ANKIB1特异性抗体。经鉴定,7A9抗体株所分泌单抗为IgG1。实验证明我们所制备的ANKIB1单克隆抗体还可以应用于免疫沉淀,同时,由于人源ANKIB1(1-480)与小鼠和大鼠ANKIB1(1-481)的同源性分别高达96.9%和97.1%,7A9抗体还能够有效识别小鼠和大鼠的ANKIB1。后续实验还将确定抗体是否可以应用于免疫组织化学实验,以拓宽该抗体的应用范围,并确定ANKIB1基因的时空表达谱。
利用7A9单克隆抗体,我们初步确定了ANKIB1在人胚胎、大鼠和小鼠脑细胞以及HEK293ET培养细胞中的表达,不同细胞中均存在两种以上不同分子量的ANKIB1蛋白,其中人体细胞以121.9 kD的蛋白为主。88 kD的ANKIB1蛋白在人体细胞中表达十分稳定,在小鼠和大鼠脑组织中甚至是主要的表达形式,因此可以确定该蛋白是一种正常表达的蛋白,而不会是121.9 kD蛋白的降解产物。110 kD的蛋白可能同88 kD的蛋白一样,分别由ANKIB1 hnRNA的不同剪接体编码。但目前确定的含有典型Kozak序列的人源ANKIB1 mRNA仅有NM_019004一种,编码1089 aa的ANKIB1蛋白。确定110 kD和88 kD蛋白的mRNA编码序列,还需要新的研究支持。在不同细胞中,我们还检测到一条含量很低分子量接近150 kD的蛋白,在HEK293ET细胞中进行ANKIB1的过表达时,我们发现带有Myc标签的ANKIB1重组蛋白分子量明显超过理论值,与内源性150 kD的蛋白十分接近,Miller等[7]在 HEK293T细胞中过表达 HA-ANKIB1时也出现了重组蛋白分子量显著大于理论值的现象。因此我们推测,150 kD的蛋白是经过翻译后修饰的ANKIB1,在正常细胞中含量很低,当ANKIB1的N端融合Myc和HA等标签后,蛋白的构象受到标签的影响发生变化,暴露出可修饰位点,使重组蛋白全部被修饰。如果此推测成立,将表明ANKIB1的N端对维持其构象具有重要的意义,也提示150 kD的蛋白可能是ANKIB1的一种主要修饰形式。
1 Li J,Mahajan A,Tsai M D.Ankyrin repeat:a unique motif mediating protein-protein interactions[J].Biochemistry,2006;45(51):15168-15178.
2 Al-Khodor S,Price C T,Kalia A et al.Functional diversity of ankyrin repeats in microbial proteins[J].Trends Microbiol,2010;18(3):132-139.
3 Zhao J,Wei J,Mialki R K et al.F-box protein FBXL19-mediated ubiquitination and degradation of the receptor for IL-33 limits pulmonary inflammation[J].Nat Immunol,2012;13(7):651-658.
4 Budhidarmo R,Nakatani Y,Day C L.RINGs hold the key to ubiquitin transfer[J].Trends Biochem Sci,2012;37(2):58-65.
5 Marín I.RBR ubiquitin ligases:Diversification and streamlining in animal lineages[J].J Mol Evol,2009;69(1):54-64.
6 Song A X,Zhou C J,Peng Y et al.Structural transformation of the tandem ubiquitin-interacting motifs in ataxin-3 and their cooperative interactionswith ubiquitin chains [J].PLoS One,2010;5(10):e13202.
7 Miller S L,Malotky E,O'Bryan J P.Analysis of the role of ubiquitininteracting motifs in ubiquitin binding and ubiquitylation [J].J Biol Chem,2004;279(32):33528-33537.
8 Uchiki T,Kim H T,Zhai B et al.The ubiquitin-interacting motif protein,S5a,is ubiquitinated by all types of ubiquitin ligases by a mechanism different from typical substrate[J].J Biol Chem,2009;284(19):12622-12632.
9 Muscarella L A,Guarnieri V,Coco M et al.Small deletion at the 7q21.2 locus in a CCM family detected by real-time quantitative PCR[J].J Biomed Biotechnol,2010;2010:854737.
10 Xie B H,Xie Y F.Twin PCRs:a simple and efficient method for directional cloning of PCR products[J].World J Microb Biot,2011;27(9):2223-2225.
11G.C.霍华德,M.R.凯瑟.抗体制备与使用实验指南[M].北京:科学出版社,2010:60-66.