脑脊液中Th17细胞相关因子对脱髓鞘疾病鉴别诊断的意义
刘 力 何红美 康熙雄 (石家庄市第四医院检验科,石家庄050000)
脱髓鞘疾病是中枢和外周神经纤维剥脱导致的一系列疾病。最常见的为多发性硬化(Multiple sclerosis,MS),还包括一些具有炎性脱髓鞘临床及MRI改变的尚不能确诊的神经疾病。多发性硬化具有时间多发性和空间多发性的特点,临床表现与其他神经系统脱髓鞘疾病很相似,鉴别诊断缺乏良好的实验室指标。
Th17细胞是近些年关注较多的参与自身免疫性疾病的效应细胞,可分泌特异性IL-17A,在免疫炎症演变过程中发挥重要作用。Th17活化及分泌行为受某些细胞因子的影响,如IL-6、TGF-β刺激Th17分化,而IL-21、IL-23维持Th17细胞增殖,并促进IL-17A的分泌[1]。由于各因子在免疫病理不同阶段发挥作用,因此,综合应用Th17细胞相关的上游和下游因子来评价脱髓鞘疾病的免疫炎症状态可能为鉴别诊断脱髓鞘疾病提供新的思路。
1 材料与方法
1.1 病例选择 选择2011年1月~8月北京天坛医院神经内科入院患者,其中复发缓解型多发性硬化(MS)患者25例,临床诊断符合2005年新修订的Mcdonald诊断标准。炎性脱髓鞘病(Inflammatory demyelinating diseases,IDDs)患者21例。以上两组排除严重心肝肾疾病、其他自身免疫病、急慢性感染及急性脑梗塞。病例对照组(Control cases,CCs)患者7例,分别为特发性高颅内压(2例)、癫痫(2例)、单纯性头痛(1例)、颅内静脉血栓(1例)、副肿瘤综合征(1例)。患者三个月内未接受任何糖皮质激素和其他免疫调节剂治疗。
1.2 实验方法
1.2.1 收集患者临床信息,包括性别、年龄、病程、发作次数等。
1.2.2 标本留取 患者入院第二天,抽取脑脊液、全血送检。检验项目包括脑脊液常规、24小时鞘内IgG合成率、寡克隆区带等临床免疫学指标。
1.2.3 液体芯片技术检测Th17细胞相关因子IL-17A、IL-6、TNF-α、IL-21、IL-23 采用流式-荧光液体芯片试剂及Luminex 200多功能流式点阵仪。试剂盒为美国Millipore细胞因子检测试剂盒(MPXHCYTO-60K-04:IL-17A,IL-6,TNF-α;MPXHCYP2-62K-02:IL-21,IL-23)。严格按照试剂盒说明书操作,设定空白对照及阳性对照,制定标准曲线。
1.3 统计学方法 应用SPSS11.5统计软件包进行数据分析。实验各计量资料均进行正态性检验,对于符合正态分布或近似正态分布的计量资料采用±s表示,符合正态分布的两组均数之间差别的比较采用t检验;不符合正态分布的计量资料和百分比等计数资料采用中位数和四分位数间距表示,采用非参数U-Mann-Whitney检验比较两组独立样本的差异。P<0.05认为差异有统计学意义。
2 结果
2.1 各组临床免疫学项目比较 各组基本信息及血脑屏障完整性、寡克隆区带检测结果见表1。其中年龄、性别比例、白蛋白指数均无显著差异。而MS组和IDDs组的血脑屏障受损比例、24小时鞘内IgG合成率及寡克隆区带阳性率显著高于CCs组,MS与IDDs组之间无显著差异。此结果符合免疫性脱髓鞘疾病的实验室改变[2]。
2.2 MS组细胞因子显著升高 比较各组脑脊液中细胞因子水平的差异。结果显示,MS组(P=0.025)和IDDs(P=0.044)组IL-17A均显著高于CCs组;MS组与IDDs组比较,差异无显著统计学意义。MS组 TNF-α显著高于 IDDs组和CCs组(均P<0.01),IDDs组与 CCs组无显著差异。IL-6和IL-21在各组之间无显著差异。见表2。
2.3 IL-17A诊断 MS的ROC曲线 将CCs组和MS组脑脊液中IL-17A建立ROC曲线(P=0.026),曲线下面积为0.780,当 IL-17A浓度为6.5 pg/ml时,特异度与灵敏度之和最大,对MS的诊断价值最高。
2.4 MS组IL-23显著升高 CCs组只有1例标本检测出IL-23水平,并且含量较低。MS组和IDDs组各有10例标本可检测出IL-23。被检测出的样本分析显示,MS组 IL-23显著高于 IDDs组(P=0.005)。见表2。本研究亦针对MS患者病程与IL-23水平做相关性分析,并未得出阳性结果。鉴于IL-23在Th17活化后期发挥作用[8],推测 IL-23表达可能与疾病病程和发作次数有关,对于鉴别诊断MS及IDDs具有一定的意义。
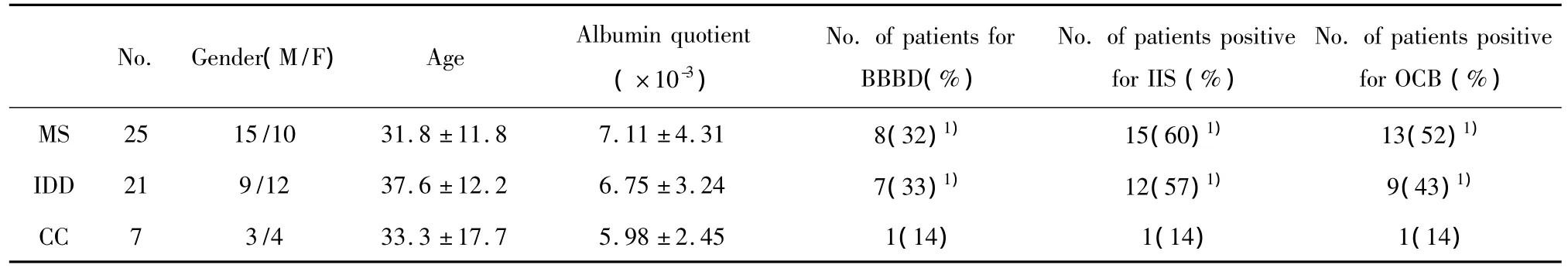
表1 各组临床常规检测项目结果Tab.1 Results of routine clinical items in every group
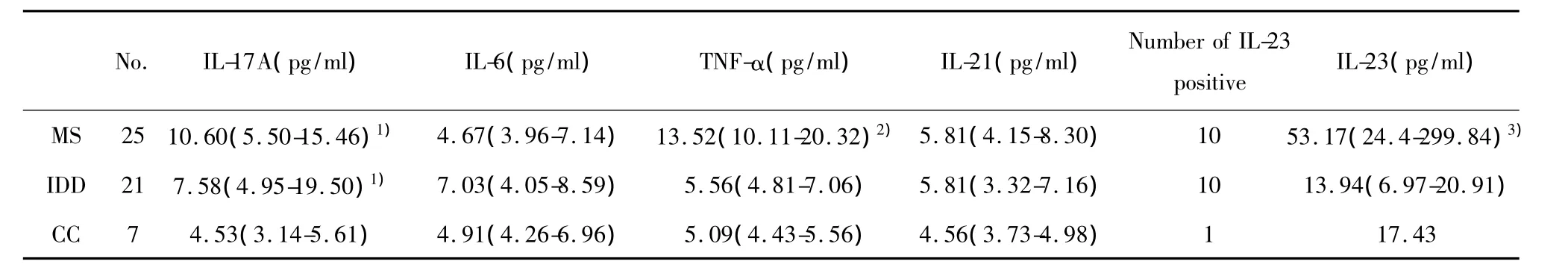
表2 各组Th17相关细胞因子水平Tab.2 Cytokines associated with Th17 lymphocyte in every group
2.5 MS组脑脊液中IL-17A与IL-23呈正相关 将MS组CSF中IL-17A与IL-23做相关性分析,结果显示,相关系数 r=0.648,说明二者具有相关性(P=0.043)。
3 讨论
免疫炎症是神经脱髓鞘疾病重要的病理机制,多种免疫细胞和免疫分子参与其中。Th17是近年来研究参与自身免疫性疾病的效应细胞,血液和脑脊液均可检测到较低比例的Th17细胞。Th17分泌的特征性细胞因子IL-17A是重要的炎症介质,多种自身免疫性疾病患者和实验动物血清及病变组织中分离出的单个核细胞均高表达IL-17A,且外周血和病灶处IL-17A水平与疾病严重程度密切相关。MS复发期脑脊液中Th17细胞增多,对神经系统自身免疫性疾病的早期启动病理具有一定的作用[3]。
Th17细胞的增殖与分化受多种细胞因子调控,包括早期调控因子 IL-6、TNF-α、IL-1β、IL-21 和后期的IL-23,这些细胞因子在MS的病理过程具有复杂的联系[4]。IL-6和TGF-β促进Th17细胞的病理性分化[5],IL-21以自分泌形式为主,可替代IL-6而放大Th17细胞效应。关于TNF-α的作用尚存在争论。一方面,TNF-α可中和IL-17,下调T细胞分泌IFN-γ 的能力,另一方面,体外可促进 IL-17分泌[6]。IL-23对Th17的生存和激活支持作用,是介导自身免疫所必需的[7]。早期T细胞几乎不表达IL-23R,推断IL-23不参与Th17分化的早期阶段[8]。虽然,体外IL-17A与IL-6和IL-23均具有相关性,但体内这些因子的关联性却罕见报道。本试验检测MS组患者TNF-α和IL-23均高于炎性脱髓鞘病,且IL-17A和IL-23的在体水平则具有一定的相关性,与体外研究的结果是一致的。因此,联合三种细胞因子分析可为脱髓鞘病的鉴别诊断提供参考。
IL-17A与Th17细胞群具有正相关。体外刺激MS患者外周血单个核细胞,结果显示病程小于2年的MS患者,培养上清中IL-17A和IL-6显著高于病程大于2年的患者[9]。而IL-23水平与病程长短呈负相关。本研究分析MS患者病程与IL-23的相关性,并未得出阳性结果。分析原因可能是入组样本量较少,对评价总体水平的差异存在一定的局限性。后续研究可结合患者脑脊液中Th17细胞数目的定量检测,将对脱髓鞘疾病的实验诊断更有意义。
1 Segal B M.Th17 cell in autoimmune demyelinating disease[J].Semin Immunopathol,2010;32(1):71-77.
2 Nordberg M,Forsberg P,Johansson A et al.Cytotoxic mechanisms may play a role in the local immune response in the central nervous system in neuroborreliosis[J].J Neuroimmun,2011;232(1-2):186-193.
3 Brucklacher-Waldert V,Stuerner K,Kolster M et al.Phenotypical and functional characterization of T helper17 cells in multiple sclerosis[J].Brain,2009;132(12):3329-3341.
4 Wilson N J,Boniface K,Chan J R et al.Development,cytokine profile and function of human interleukin 17-producing helper T cells[J].Nat Immunol,2007;8(9):950-957.
5 Ogura H,Murakami M,Okuyama Y et al.Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction[J].Immunity,2008;29(4):628-636.
6 Kimura A,Kishimoto T.IL-6:Regelator of Treg/Th17 balance[J].Eur J Immunol,2010;40(7):1830-1835.
7 Bettelli E,Carrier Y,Gao W et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006;441(7090):235-238.
8 McGeachy M J,Chen Y,Tato C M et al.The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo[J].Nat Immunol,2009;10(3):314-324.
9 Chen Y,Langrish C L,McKenzie B et al.Anti-IL-23 therapy inhibits multiple inflammatory pathways and ameliorates autoimmune encephalomyelitis[J].J Clin Invest,2006;116(5):1317-1326.