CTP-HBcAg18-27-Tapasin融合表达载体的构建及其表达和纯化
刘红红,陈小华,周丽芹,刘雪妮,余永胜,臧国庆,汤正好
上海交通大学附属第六人民医院感染科,上海 200233
乙型肝炎病毒慢性感染是严重的公共卫生问题。病毒清除很大程度上依赖于活化表位肽特异性CD8+细胞毒性T淋巴细胞(cytotoxicity T lymphocyte,CTL),CTL通过T细胞受体(TCR)特异性识别病毒肽段并通过MHC-Ⅰ类分子提呈引起感染细胞溶解,是宿主清除 HBV的关键[1]。HBcAg18-27是具有免疫优势的HLA-A2限制性CTL表位肽,在急性自限性HBV感染中能诱发强大的CTL反应。Tapasin是抗原提呈相关运载体蛋白(transporter associated with antigen processing,TAP)的基因产物,与MHC-Ⅰ类分子同为免疫球蛋白超家族成员。Tapasin在形成抗原肽MHC复合物中有重要作用,是MHC-Ⅰ类分子与TAP之间的桥梁。胞浆转导肽(cytoplasmic transduction peptide,CTP)转导的融合蛋白定位于细胞浆,可以在体内外将不同蛋白和多肽转导入多种细胞[2]。
本实验选用转运效率高的新型胞浆转导肽CTP(GGRRARRRRRR)、MHC-Ⅰ类分子限制的HBcAg18-27CTL表位肽(FLPSDFFPSV)及分子伴侣Tapasin,构建了CTP-HBcAg18-27-Tapasin融合表达质粒并表达纯化得到CTP-HBcAg18-27-Tapasin融合蛋白,为进一步体内外实验诱导HBV特异性CTL免疫应答提供了实验基础。
1 资料与方法
1.1 资料 pCMV-SPORT6质粒购自Open Biosystems公司,pREST-B质粒及BL21(DE3)菌株购自Novagen公司,JM109菌株、DNA连接酶、限制性内切酶、DNA Marker、PCR试剂盒及质粒小量抽提试剂盒均购自Takara公司,Ni+-NTA填料购自美国Promega公司,蛋白标记物为Fermentas公司,Tapasin抗体及二抗均购自Santa Cruze公司,其他试剂均为国产分析纯。
1.2 方法
1.2.1 pREST-B-CTP-HBcAg18-27-Tapasin 融合基因表达质粒的构建:以质粒pCMV-SPORT6中Tapasin基因为模板,设计出一对引物,其中,上游引物中带有融合基因 CTP-HBcAg18-27,所以整体上游引物为5'-tttggatccggcggccgtcgtgcgcgtcgtcgtcgtcgtcgttttctgccgagcgatttttttc cgagcgtgaagcctctgctc-3'(划线部分为 BamHⅠ酶切位点);下游引物为:5'-aaagaattcttattactgtgacttctttga-3'(划线部分为 EcoR1酶切位点),进行聚合酶链反应(PCR)扩增含有BamHⅠ和EcoR1酶切位点的融合基因序列,回收纯化PCR产物,与pREST-B质粒在DNA连接酶的作用下4℃反应12 h,反应产物转化JM109感受态细胞,然后接种于含氨苄西林的LB培养板上,放置37℃培养箱中过夜,次日挑取单菌落接种于LB培养基振摇12 h后抽提质粒,BamHⅠ和EcoR1双酶切鉴定。并挑取其中一个阳性质粒进行测序(由上海生物工程技术有限公司完成)。
1.2.2 CTP-HBcAg18-27-Tapasin 融合蛋白的诱导及表达:取测序正确的pREST-B-CTP-HBcAg18-27-Tapasin质粒加入到200 μl BL21(DE3)感受态细胞中,接种LB固体培养基,37℃培养12 h,挑取单菌落接种于3 ml上述LB培养基,37℃振摇12 h。取1 ml菌液加至200 ml上述LB培养中,37℃振摇至菌液OD600达0.5时,留取2 ml备用,其余菌液加入异丙基-β-D-硫代半乳糖苷(IPTG)诱导,终浓度为1 mmol/L,28℃振摇5 h,离心收集细菌,用 PBS液重悬菌体,进行 SDSPAGE电泳分析。
1.2.3 CTP-HBcAg18-27-Tapasin融合蛋白的纯化:超声后菌液沉淀2000 r/min离心10 min后取上清加入Ni2+-亲和层析柱,静置30 min后,用10倍柱体积的结合缓冲液洗柱,然后用6倍柱体积的漂洗缓冲液洗柱,最后用洗脱缓冲液洗柱,得到含有6-His标记的CTPHBcAg18-27-Tapasin融合蛋白,留取200 μl纯化蛋白进行SDS-PAGE电泳分析及Western blotting鉴定,其余纯化蛋白于-20℃条件下保存。
1.2.4 CTP-HBcAg18-27-Tapasin 融合蛋白 Western blotting鉴定:诱导前、后和纯化前、后融合蛋白经SDSPAGE 电泳后,采取电转膜(45 V,1.5 h),转移后的硝酸纤维(NC)膜用清洗液(TBST)清洗5 min,以10 ml 50 g/L脱脂乳37℃封闭2 h,取出膜,于摇床上用TBST洗膜3次,5 min/次,加入1∶1000稀释的一抗(Tapasin单克隆抗体,封闭缓冲液稀释),4℃缓慢摇动孵育过夜,TBST洗涤液清洗NC膜5 min 3次,加入1∶1000稀释的二抗(辣根过氧化物酶标记的兔抗山羊IgG,封闭缓冲液稀释)室温孵育1 h,TBST洗涤液清洗NC膜3次,10 min/次,膜放于化学发光检测试剂(Millipore)反应2 min,取出膜甩去多余的液体,暗室中用X胶片感光、显影、定影。
2 结果
2.1 pREST-B-CTP-HBcAg18-27-Tapasin 融合基因表达质粒的构建 CTP-HBcAg18-27-Tapasin融合基因PCR产物的琼脂糖凝胶电泳可见约1480 bp大小的条带(见图1a),与预期结果相符;构建的 pREST-B-CTPHBcAg18-27-Tapasin表达质粒经BamHⅠ和EcoR1双酶切鉴定,酶切后小片段产物约1470 bp大小的条带(见图1b)。酶切鉴定正确的质粒经测序显示碱基序列与CTP、HBcAg18-27及pCMV-SPORT6中插入的Tapasin序列一致(见图1c),表明pREST-CTP-HBcAg18-27-Tapasin表达质粒构建成功。
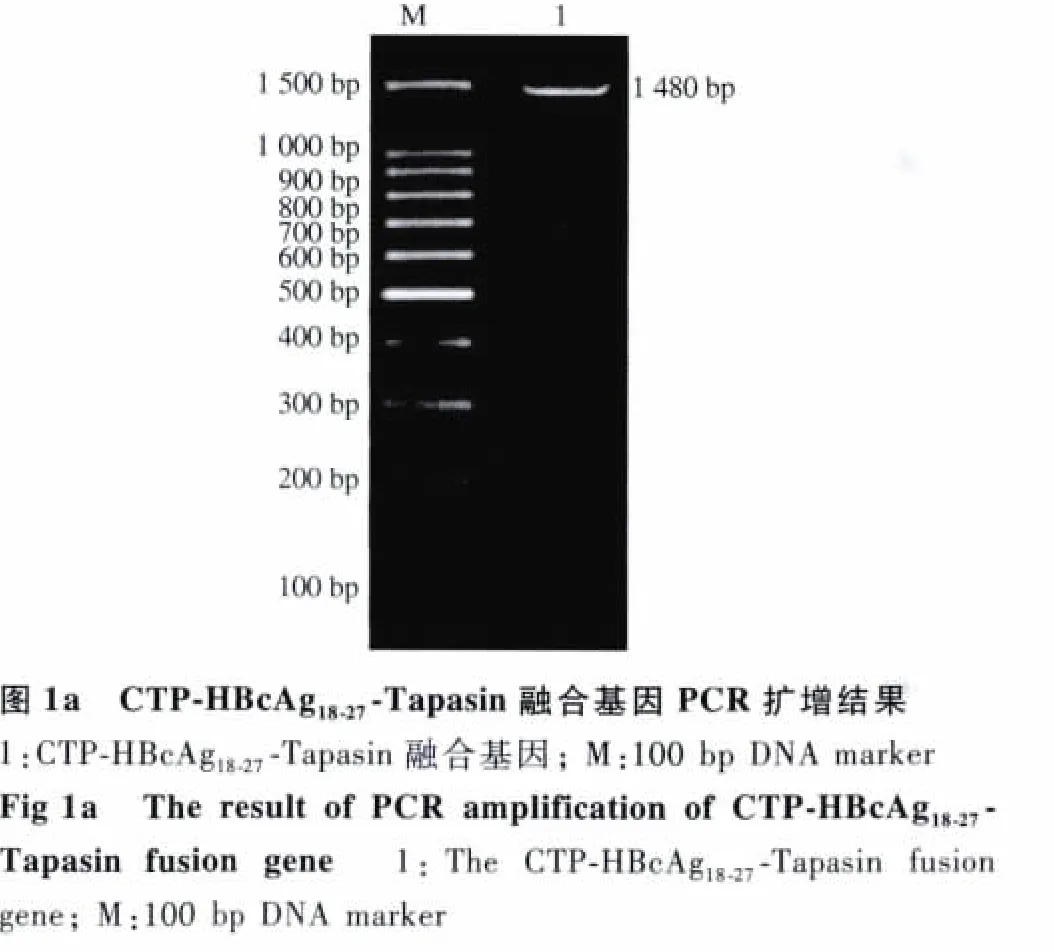


图1c pREST-B-CTP-HBcAg18-27-Tapasin基因测序Fig 1c The gene sequencing of pREST-B-CTP-HBcAg18-27-Tapasin
2.2 CTP-HBcAg18-27-Tapasin融合蛋白的诱导表达及纯化 融合表达质粒转化大肠埃希菌BL21(DE3),经IPTG诱导后与诱导前相比较(见图2),在SDSPAGE电泳图谱上出现了分子量约52.3 KD大小的条带,与预计的 His-CTP-HBcAg18-27-Tapasin大小相当(His为6个组氨酸的载体标签蛋白)。镍柱亲和层析所得的目的蛋白经测定纯度为2.1 mg/ml,分子质量为52.3 KD(见图 3)。

图2 6 His-CTP-HBcAg18-27-Tapasin融合蛋白的表达 1:诱导前;2:经IPTG诱导后;M:蛋白分子量标记Fig 2 The expression of 6 His-CTP-HBcAg18-27-Tapasin fusion protein 1:Before induction;2:After induction of IPTG;M:Marker
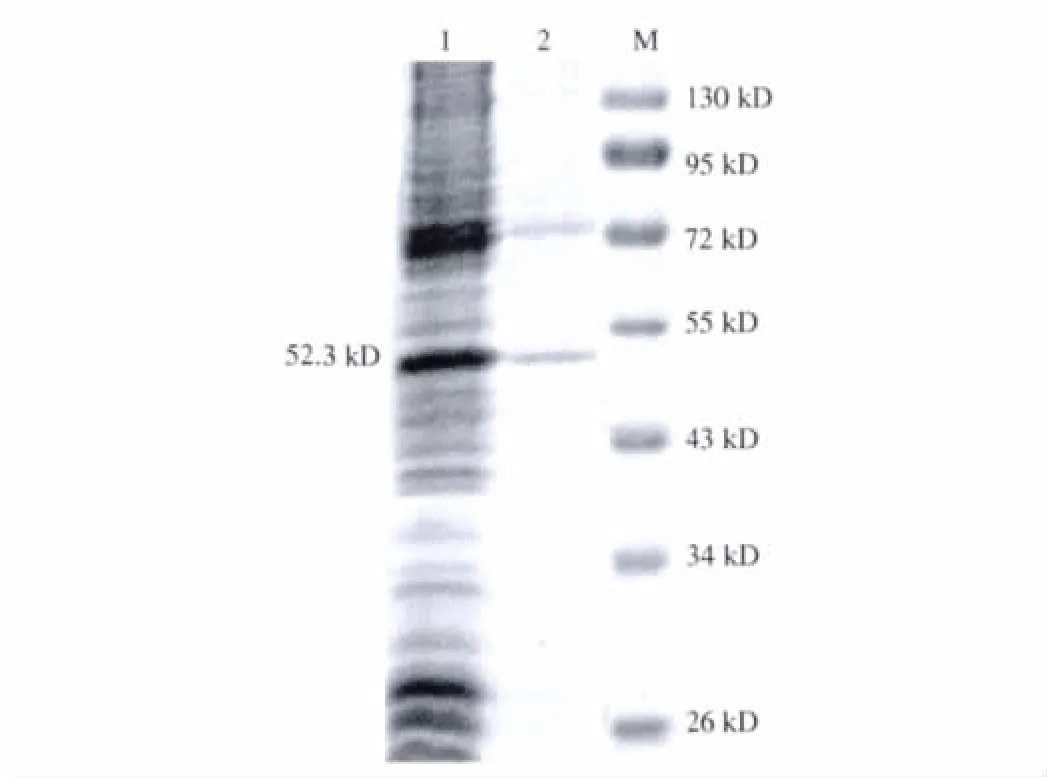
图3 CTP-HBcAg18-27-Tapasin融合蛋白的纯化 1:裂菌后的沉淀;2:经镍柱亲和层析纯化后;M:蛋白分子量标记Fig 3 The purification of CTP-HBcAg18-27-Tapasin fusion protein 1:The precipitation of the lysed bacteria;2:After of purification by Ni2+-chelating column;M:Marker
2.3 CTP-HBcAg18-27-Tapasin融合蛋白的 Western blotting鉴定 pREST-B-CTP-HBcAg18-27-Tapsin融合表达质粒转化DE3,经IPTG诱导后的表达产物及其超声破壁后沉淀和经镍柱亲和层析纯化后产物SDSPAGE电泳后电转后至NC膜,与Tapasin抗体杂交孵育,Western blotting显示诱导后表达产物及其超声破壁后沉淀和纯化后产物与Tapasin抗体反应(见图4)。证实pREST-B-CTP-HBcAg18-27-Tapasin表达质粒可在BL21(DE3)中正确表达,镍柱亲和层析纯化后得到52.3 kD融合蛋白。
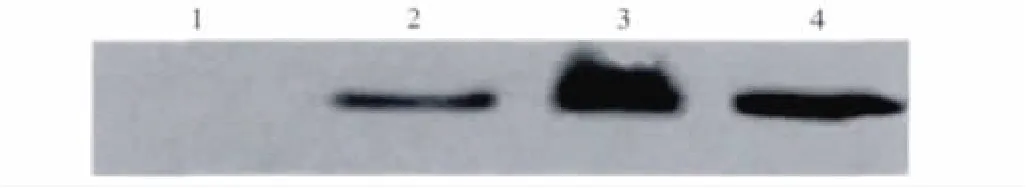
图4 融合蛋白的Western blotting鉴定 1:诱导前;2:经IPTG诱导后;3:裂菌后的沉淀;4:经镍柱亲和层析纯化后Fig 4 Western blotting analysis of fusion proteins 1:Before induction;2:After induction of IPTG;3:The precipitation of the lysed bacteria;4:After purification by Ni2+-chelating column
3 讨论
CTP是一种去除了核定位信号而能携带蛋白类大分子穿越细胞膜并专一性定位于胞浆中的新型转导肽系统[3],由于CTP序列内去除了核定位信号而使该转导系统不再具有定位于核内的倾向,从而对核内遗传物质没有影响[4],并且CTP转导融合蛋白的效率远优于传统 PTD的抗原携带功能[5]。HBcAg18-27在90%HLA-A2阳性的急性自限性HBV感染中能诱发强大的CTL反应,而慢性患者此类反应则大多较弱甚至检测不出,由此推断较弱的CTL反应对HBV清除不彻底是导致HBV感染慢性化的主要原因[6]。近期有研究提示,HBcAg18-27末端的缬氨酸和慢性重症乙型肝炎存在相关性[7]。Tapasin在形成抗原肽MHC复合物中有重要作用,如稳定TAP1/TAP2异二聚体,增强转运肽的功能[8];促进抗原提呈细胞表面MHC/多肽复合物的表达[9]。近年来一些研究提示某些肿瘤、病毒及自身免疫性疾病等发生与Tapasin的表达下降相关[10]。
本实验通过构建pREST-B-CTP-HBcAg18-27-Tapasin融合基因表达质粒,探讨了CTP-HBcAg18-27-Tapasin融合蛋白原核表达的可行性,并为进一步研究其体内外功能提供了实验基础。我们从Open Biosystems公司购买到pCMV-SPORT6质粒,其中有已插入鼠源性的Tapasin基因。由于CTP和HBcAg18-27基因序列较小(分别为33 bp、30 bp),为使实验步骤简单化,我们将其直接合成在PCR上游引物中,然后利用PCR技术从质粒pCMV-SPORT6中扩增得到CTP-HBcAg18-27-Tapasin全长序列,实验中得到的PCR产物我们通过回收后纯化以提高其纯度和反应特异性。因为Tapasin基因序列较大,我们又挑取了其中酶切鉴定阳性的表达质粒从双向进行测序,测序结果显示碱基序列与pCMV-SPORT6中插入的 Tapasin序列及 CTP、HB-cAg18-27序列一致,表明表达载体构建成功。表达载体pREST-B-CTP-HBcAg18-27-Tapasin转化大肠埃希菌BL21(DE3)后得到了表达,因为本实验选用的表达载体pREST-B表达的目的蛋白带有由6个组氨酸组成的标签(6His),所以表达的目的蛋白可以通过Ni2+-金属螯合亲和层析法来纯化,纯化后的蛋白可以用特异性抗组氨酸标签抗体进行检测。最后经Western blotting鉴定,证实为52.3 kD的 CTP-HBcAg18-27-Tapasin融合蛋白。
本文构建了pREST-B-CTP-HBcAg18-27-Tapasin融合基因表达载体,并成功表达了CTP-HBcAg18-27-Tapasin融合蛋白,旨在借助CTP的特性,把外源性的HB-cAg18-27和Tapasin表位肽带入抗原提呈细胞胞质,从而转化为内源性抗原,在Tapasin蛋白的协同修饰作用下促进MHC/多肽复合物的装配并进入MHC-Ⅰ类分子抗原提呈途径,诱导HBV特异性CTL反应,为慢乙肝提供新的治疗思路。
[1]Penna A,Chisari FV,Bertoletti A,et al.Cyotoxic T lymphocytes recognize an HLA-A2 restricted epitope within the hepatitis B virus nucleocapsid antigen[J].J Exp Med,1991,174(6):1565-1570.
[2]Morón G,Dadaglio G,Leclerc C,et al.New tools for antigen delivery to the MHC class I pathway [J].Trends inmmunol,2004,25(2):92-97.
[3]Kim D,Jeon C,Kim JH,et al.Cytoplasmic transduction peptide(CTP):New approach for the delivery of biomolecules into cytoplasm in vitro and in vivo[J].Exp Cell Res,2006,312(8):1277-1288.
[4]Huang SF,Liu DB,Zeng JM,et al.Cloning,expression,purification and functional characterization of the oligomerization domain of Bcr-Abl oncoprotein fused to the cytoplasmic transduction peptide[J].Protein Expr Purif,2009,64(2):167-178.
[5]Chauhan A,Tikoo A,Kapur AK,et al.The taming of the cell penetrating domain of the HIV Tat:myths and realities[J].J Control Release,2007,117(2):148-162.
[6]Thio CL,Thomas DL,Carrington M.Chronic viral hepatitis and the human genome[J].Hepatology,2000,31(4):819-827.
[7]Yang L,Ma S,Hu X,et al.Presence of valine at position 27 of the hepatitis B virus core gene is associated with severe liver inflammation in Chinese patients[J].J Med Virol,2011,83(2):218-224.
[8]Momburg F,Tan P.Tapasin-the keystone of the loading complex optimizing peptide binding by MHC class I molecules in the endoplasmic reticulum[J].Mol Immunol,2002,39(3-4):217-233.
[9]Sadegh-Nasseri S,Chen M,Narayan K,et al.The convergent roles of tapasin and HLA-DM in antigen presentation [J].Trends Immunol,2008,29(3):141-147.
[10]Boulanger DS,Oliveira R,Ayers L,et al.Absence of tapasin alters immunodominance against a lymphocytic choriomeningitis virus polytope[J].J Immunol,2010,184(1):73-83.

