差异基因功能在酒精性肝硬化发病机制中的研究
刘 颖,王文多,陈 颖,张沛怡
黑龙江省医院消化内科,黑龙江 哈尔滨 150036
酒精性肝硬化(alcoholic liver cirrhosis,ALC)是长期大量饮酒导致的肝功能严重受损而引发的一组疾病的终末阶段。此阶段肝功能损伤不可逆并出现较多合并症,治疗效果不佳,死亡率高。故探讨ALC的发病机制,研究ALC患者与正常人之间存在的差异基因及其在发病过程中发挥的生物学作用,对该病的基因治疗具有深远的意义。
本文研究2010年12月-2011年5月应用ALC患者及健康对照者外周血总RNA样本及基因芯片技术,寻找ALC患者和健康对照者之间存在的差异基因,研究差异基因共表达网络中的节点基因,并进一步探讨它们的生物学功能。
1 材料与方法
1.1 资料来源 收集ALC(诊断标准按中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的酒精性肝病的诊疗指南)和同期门诊健康对照者两组(均签署知情同意书),每组10例,人体外周血10 ml,并提取单核细胞。
1.2 样本RNA的提取与标记 (1)总RNA抽提及纯化:采用Invitrogen®Trizol提取组织中的总RNA,纯化好的RNA溶于DEPC水中并于-80℃冰箱保存。(2)样品RNA质量检测:使用琼脂糖凝胶电泳或Agilent2100 Bioanalyzer系统对样品总RNA质量进行完整性检测分析。(3)双链cDNA合成与纯化:取500 ng总RNA,以T7-Oligo(dT)为引物,体外合成并纯化双链cDNA;纯化的双链cDNA于-20℃冰箱保存。(4)体外转录合成cRNA与标记生物素:将双链cDNA进行体外转录合成(扩增)cRNA并同时标记生物素,而后将其纯化,纯化的cRNA于-20℃冰箱保存。(5)合成cRNA质量检测。
1.3 探针定量 体外转录合成的生物素标记 cRNA用Molecular Probes’RiboGreen®kit进行定量检测。
1.4 芯片杂交 (1)芯片杂交:取1.5 μg纯化的生物素标记 cRNA溶于10 μl水中并加入缓冲液 GEXHYB,而后将其加到芯片中,将GEX-HCB放入蓄液槽后将芯片杂交盒放入58℃杂交炉中进行杂交。(2)杂交后处理:按Sentrix®BeadChip实验手册操作,将芯片温育(EIBC溶液)、高温漂洗、乙醇洗涤(100%乙醇)、封闭(E1 buffer)、Cy3染色、干燥等。
1.5 图像扫描 用高精度激光共聚焦扫描仪(Illumina scanner:0.8 μm)对杂交后的芯片进行扫描及信号提取。
1.6 生物信息学数据处理 以正常样品作对照,采用Illumina custom Error Model进行差异基因分析,然后选出P≤0.01的基因,系统化全基因组水平分析以识别出不同组之间的差异表达基因,结合Gene Ontology数据库和KEGG数据库(Kyoto Encyclopedia of Genes and Genomes)进行相关差异表达基因的功能分类和显著路径的分析。
2 结果
2.1 差异基因的筛选 因每组样本在进行芯片扫描时分别有10个生物学重复,所以在筛选差异基因时,我们选择适合小样本数据的筛选方法—随机方差模型进行两组样本间差异的筛选,利用随机方差模型计算每个基因的显著性水平(P value)和误判率(FDR),按照P<0.05进行筛选,获得差异表达的基因。两组共发现1008个差异表达的基因。
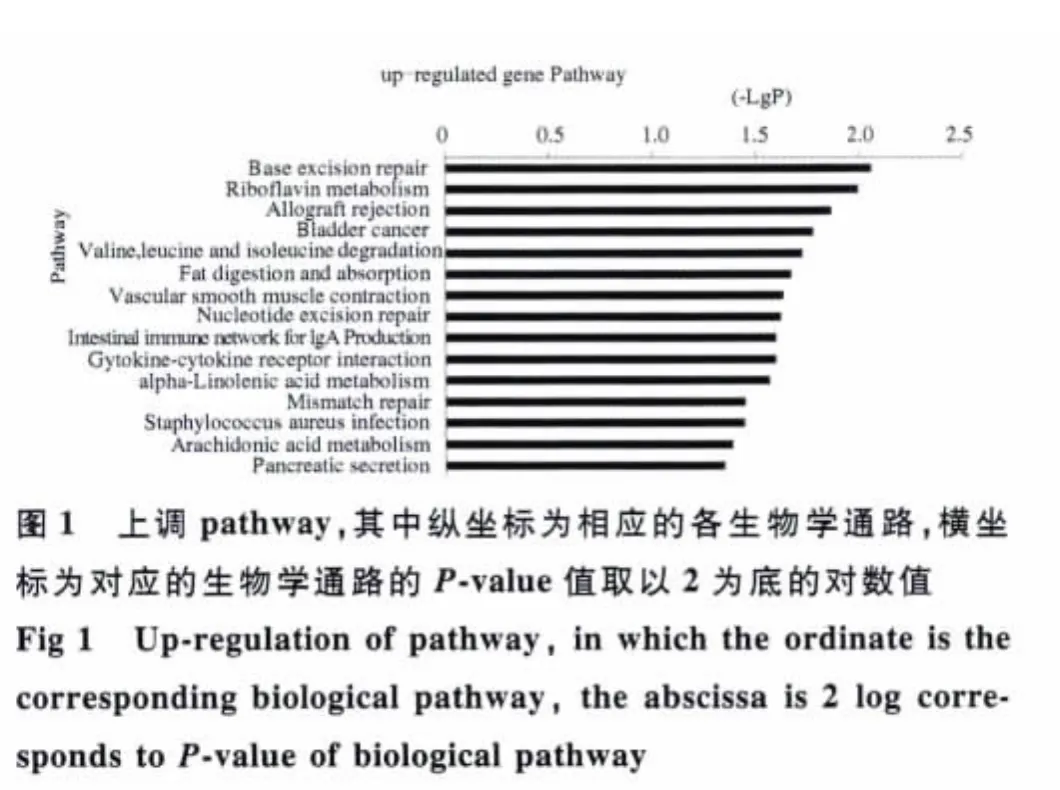
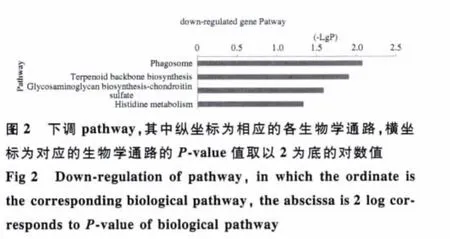
2.2 差异基因功能的显著性分析 虽然两组间有1008个差异基因被发现,但并不是所有差异基因均参与疾病的发生发展过程。基于Gene Ontology数据库,得到差异基因的所有GO注释。利用Fisher精确检验和卡方检验对每个GO进行显著性分析,得到每个GO的显著性水平(P value),按照P<0.05进行筛选,得到差异基因的显著性功能。发现显著性差异表达上调基因188个;下调基因210个。同理基于KEGG数据库对差异基因进行Pathway的功能分析,按照P<0.05筛选,得到显著性表达差异基因参与的显著性意义的pathway。其中上调pathway 14个,对应的基因47个(见图 1);下调 pathway 4个,对应基因 12个(见图2)。
2.3 基因间的相互作用关系网络 通过以上分析得到了差异基因在功能和信号通路上的调控机制,我们针对每个基因间的相互作用进行分析,构建得到基因间的调控网络(见图3),基于差异基因间的相互作用网络,通过对基因调控网络中基因的Betweenness Centrality筛选,得到网络中的节点基因。节点基因前4位是:mapk8、cxcr3、pdgfrb、calml5。下调基因为:mapk8、calml5;上调基因为:cxcr3、pdgfrb。

3 讨论
虽然ALC的发病机制一直是消化内科医生研究的热点,但具体机制不明确。前期研究发现该病的发生与细胞凋亡、免疫应答、脂质过氧化物反应、乙醇代谢酶的基因多态性等因素有关[1-2],但参与这些病理生理过程的具体基因未予以阐明。前期工作中,我们运用大鼠酒精性肝病的模型,研究了酒精性脂肪肝和肝纤维化阶段差异表达的基因,但由于大鼠基因与人类存在着较大差异,这些结果并不能完全阐述人类酒精性肝病过程中各个阶段致病作用的差异基因。
通过我们的研究,发现了ALC患者与健康对照者之间存在1008个差异表达的基因。其中显著性差异表达的基因中上调基因188个,下调基因210个。其所参与的显著性意义pathway中,上调pathway 14个,对应的基因47个;下调pathway 4个,对应基因12个。根据网络中介中间性,差异基因共表达网络中的节点基因前四位是:mapk8、cxcr3、pdgfrb、calml5。下调基因为:mapk8、calml5;上调基因为:cxcr3、pdgfrb。
其中mapk8—丝裂原激活的蛋白激酶8(mitogenactivated protein kinase 8)是差异基因共表达网络中最重要的节点基因,其中介中间性最大,为0.449932,是下调基因。该基因编码蛋白是蛋白激酶家族的一个成员,此激酶为多个生化信号传导的结合点,并参与多种细胞过程,如增殖、分化、转录调控和发展[3-4]。通过其自身磷酸化及复杂的信号转导,激活Ras蛋白,后者活化丝裂原活化蛋白激酶(MAPK),MAPK是一类广泛存在于真核细胞中具有丝氨酸和酪氨酸双重磷酸化能力的蛋白激酶,被活化后可显著增强c-fos和cjun基因的表达[5],而两者结合后的基因表达产物对DNA修复和细胞增生起积极作用并进一步在细胞凋亡的信号通路上发挥调控作用[6-7]。而细胞凋亡作用已经在ALC的发病机制中得到了广泛证实,MAPK8的持续下调,很可能使c-fos和c-jun结合受抑制,不利于DNA修复和细胞的正常增生,并使细胞凋亡过程失去正常的调控从而加速了肝细胞的凋亡。
趋化因子受体CXCR3是G蛋白偶连的跨膜受体,主要表达在T细胞、自然杀伤细胞活性上[8],有的上皮细胞和一些内皮细胞也表达CXCR3。CXCR3与配体结合后在诱导Ⅰ型辅助T细胞(Th1)迁移的同时又阻止Ⅱ型辅助T细胞(Th2)的迁徙。从而增强T细胞的分化效应。CXCR3与其配体CXCL9、CXCL10、CXCL11的结合,能引起细胞钙离子的内流,启动肌醇磷脂3-激酶和丝裂原活化蛋白激酶(MAPK)。CXCR3调节白细胞迁徙,CXCR3与配体相互作用引起Ⅰ型辅助T细胞(Th1)的迁移,并促进Ⅰ型辅助T细胞(Th1)成熟。CXCR3可能在下列疾病中起作用,包括动脉粥样硬化、多发性硬化、肝纤维化。
其他差异表达的节点基因参与的生物学通路包括:细胞凋亡、生物信号传导、碱基切除修补、核糖核酸酶代谢、结氨酸亮氨酸异亮氨酸降解、脂质代谢吸收、免疫应答等。可见在ALC的发病是一个众多显著性表达的差异基因参与诸多生物学反应独立或关联发生的极其复杂的病理生理过程。
我们的研究首次应用了ALC患者的外周血RNA,在前期大鼠的研究基础上,揭示了ALC患者与健康对照者之间存在的显著性表达的差异基因,并分析了其在酒精性肝硬化发病过程中的生物学作用,其结果还需更大的样本来进一步的证实和比对。希望我们的工作为下一步的研究提供一个有效切入点,成为ALC的发病机制和基因治疗新的分子生物学靶点。
[1]Yang S,Zhu H,Li Y,et al.Mitochondrial adaptations to obesity related-oxidant stress[J].Arch Biochem Biophys,2000,378(2):259-268.
[2]Watanabe J,Hayashi S,Kawajiri K.Different regulation and expression of the human CYP2E1 gene due to the RsaI polymorphism in the 5'-flanking region[J].J Biochem,1994,116(2):321-326.
[3]Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci U S A,2004,101(9):2999-3004.
[4]Yoo KH,Park YK,Kim HS,et al.Identification of MAPK10 as a novel epigenetic marker for chromophobe kidney cancer[J].Pathol Int,2011,61(1):52-54.
[5]Ying J,Li H,Cui Y,et al.Epigenetic disruption of two proapoptotic genes MAPK10/JNK3 and PTPN13/FAP-1 in multiple lymphomas and carcinomas through hypermethylation of a common bidirectional promoter[J].Leukemia,2006,20(6):1173-1175.
[6]Barnat M,Enslen H,Propst F,et al.Distinct roles of c-Jun N-terminal kinase isoforms in neurite initiation and elongation during axonal regeneration [J].J Neurosci,2010,30(23):7804-7816.
[7]Bandyopadhyay S,Chiang CY,Srivastava J,et al.A human MAP kinase interactome[J].Nat Methods,2010,7(10):801-805.
[8]Qin S,Rottman JB,Myers P,et al.The chemokine receptors CXCR3 and CCR5 mark subsets of T cells associated with certain inflammatory reactions[J].J Clin Invest,1998,101(4):746-754.

