ABR发酵系统运行特性及产氢效能研究
郑国臣,李建政,昌 盛,张照韩,官 涤,金 羽,郭静波,卢海凤 (1.松辽水资源保护科学研究所,吉林 长春 1001;.哈尔滨工业大学,城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 10090;.哈尔滨工程大学航天与建筑学院,黑龙江 哈尔滨 10001;.东北电力大学建筑工程学院,吉林 长春 101;.中国农业大学水利与土木工程学院,北京 10008)
随着能源危机的加剧,氢气作为清洁能源受到了广泛关注,特别是利用生物质进行发酵制氢研究发展迅速[1-2].发酵法生物制氢的基本原理是基于产酸发酵菌群对糖类的降解同时产生氢气,根据代谢产物的不同,发酵类型可以分为丙酸型发酵、丁酸型发酵,乙醇型发酵,其中乙醇型发酵类型产氢效能最高[3-4].因此,通过调控生物制氢系统,使发酵菌群达到乙醇型发酵是系统高效稳定运行的基础.
连续流搅拌槽式反应器(CSTR)是发酵法生物制氢所采用最广泛的反应器,具有传质效率高、活性污泥持有量大、反应速度快等优点;但也存在基质降解程度有限、基质氢气转化率低,成为制氢成本降低的限制因素[5-6].为提高基质氢气转化率,进一步降低制氢成本,关于高效、新型反应器的研发与运行调控等方面较多研究[7-10].目前,厌氧生物处理系统应用最普遍的是上流式厌氧污泥床反应器(UASB),在此基础上,又相继开发出厌氧膨胀床、厌氧流化床、厌氧生物转盘和厌氧折流板反应器(ABR)等近年来研究较多[11-13].由于ABR通过生物相的有效分离,系统达到高效处理,使生物质得到梯级利用.但 ABR在连续流发酵制氢系统中的应用并不多见[14].
为降低发酵产氢系统的动力消耗,同时提高基质的氢气转化率和反应器的产氢能力,本研究以ABR作为发酵制氢反应器,研究其运行特性及调控技术.
1 材料与方法
1.1 试验装置
CSTR(图 1)有效容积 9.6L,沉淀区 5.4L[15].3格室 ABR(图 2)有效容积 27.8L,单格有效容积9.2L[16].2种反应器通过温控仪控制温度均为35℃左右.
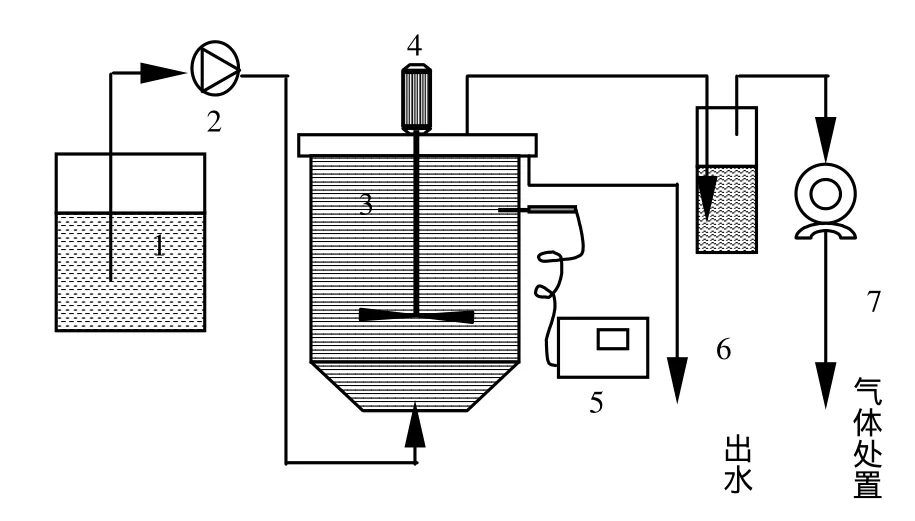
图1 CSTR反应系统及流程示意Fig.1 CSTR system Schematic diagram
1.2 接种污泥
接种污泥为哈尔滨太平污水处理厂的剩余污泥.CSTR接种污泥的 MLVSS 为 19.26g/L,ABR3格室MLVSS依次为6.41,6.62,6.54g/L.
1.3 试验废水
采用甜菜制糖厂的废糖蜜加水稀释配制实验用水,投加少量尿素和 K2HPO4,使废水 COD:N:P=200~500:5:1.
1.4 分析项目及测定方法
COD、pH 值、碱度(ALK,以 CaCO3计)、MLSS、MLVSS等常规分析项目,均采用国家标准方法测定[17];产气量采用湿式气体流量计计量;气体成份及含量、挥发性脂肪酸(VFAs)和乙醇采用气相色谱测定[18].
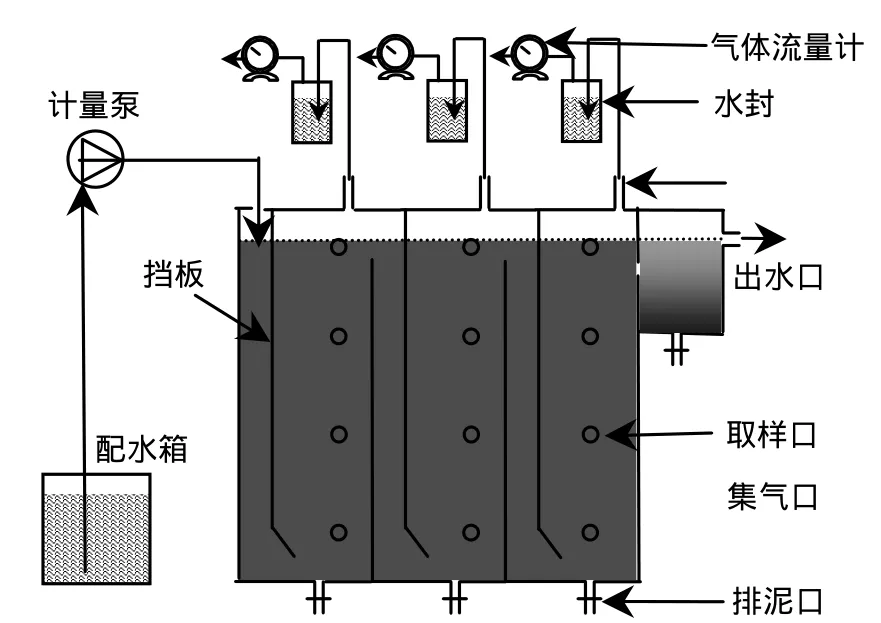
图2 ABRⅠ反应器结构示意Fig.2 Schematic diagram of ABR
2 试验结果
2.1 ABR系统的产氢特性
由图3可见,第1格室,系统启动初期,产气量和氢气产量波动较大;第14d,产气量迅速上升,第25d,产气量达到14.0L/d,并在运行中保持稳定.经过13d的驯化,活性污泥适应了系统内环境,产气量从2.4L/d(第 14d)迅速攀升至 14.0L/d(第 25d),氢气含量也随之从22%(第14d)增加至51%(第25d),并基本保持稳定.在第26~55d的稳定期,第1格室的产气量14.1L/d,产氢量7.2L/d,氢气含量51%.
ABR第2格室和第3格室的产气量和产氢量也有相似的变化规律,停滞期阶段与第 1格室不同,系统运行至第 6d,产气量和产氢量开始上升.由于第1格室的缓冲作用为第2、3格室微生物创造了适宜的条件.在 ABR运行的稳定期(第26~55d),第 2格室的产气量 25.1L/d、产氢量15.1L/d,氢气含量 60%;第 3格室的产气量20.1L/d、产氢量10.2L/d,氢气含量51%.
2.2 ABR产氢系统的液相末端发酵产物
由图4可见,ABR启动后,前20d,第1格室的液相末端发酵产物总量为 725~930mg/L,第 20d开始迅速增加,第26 d后达到稳定,液相末端发酵产物总量为 1255.0mg/L.液相末端发酵产物各组分含量发生着显著的变化.第 10d,乙醇、乙酸、丙酸和丁酸分别为 159.2,311.2,176.5,262.6mg/L,乙酸和丁酸含量之和为总量的 63%,呈现丁酸性发酵特征.在第 11~20d的运行中,丁酸含量逐渐下降,而乙醇和丙酸的含量逐渐上升,第 20d时,乙醇、乙酸、丙酸和丁酸含量分别为170.2,367.3,288.8,118.9mg/L.第26d,第1格室达到稳定阶段,此阶段乙醇、乙酸、丙酸、丁酸和戊酸分别为443.4,432.5,244.8,107.7,26.6mg/L,其中乙醇和乙酸含量之和占总量70%,为典型的乙醇型发酵.液相末端发酵产物的变化规律,反映了活性污泥微生物代谢特征的改变,也揭示了活性污泥在驯化过程中的微生物群落结构的变化.
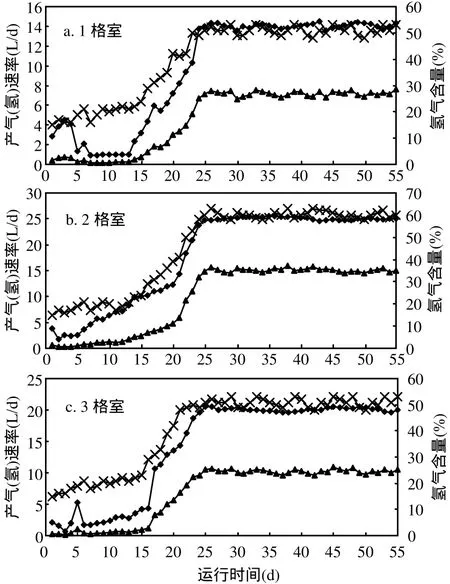
图3 ABR型制氢反应系统生物气体及氢气含量的变化Fig.3 Biogas and hydrogen yields of each compartment in the ABR system
第2、3格室的代谢特征也发生相似的演变过程.第2格室的前5d,呈现混合酸发酵类型;第6~16d,丁酸发酵类型占优势;从第 17d开始,乙醇、乙酸和丙酸含量显著增加,而丁酸含量则明显下降;第 24d开始,丙酸含量开始下降,而乙醇和乙酸含量逐渐增加;第 26~55d,液相末端发酵产物保持相对稳定,此时,乙醇、乙酸、丙酸、丁酸和戊酸平均含量分别为 633.6,767.5,387.7,181.1,83.6mg/L,其中乙醇与乙酸含量之和为总量的68.23%,呈现出乙醇型发酵特征.第3格室液相末端发酵产物达到稳定期(第 26~55d),乙醇、乙酸、丙酸、丁酸和戊酸含量分别为908.1,1093.9,323.7,268.8,166.5mg/L,其中乙醇与乙酸含量之和为总量 73%,呈现乙醇型发酵特征.
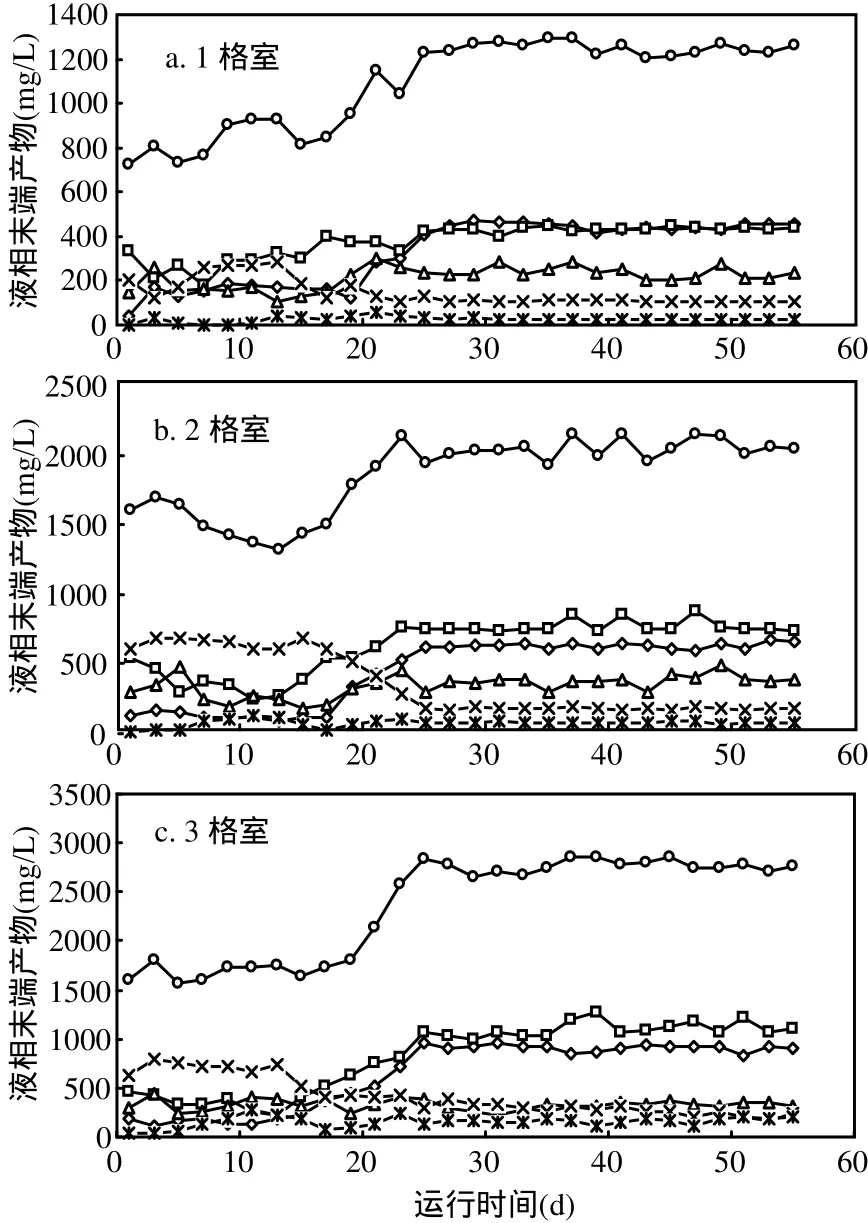
图4 系统各个格室VFAs及乙醇的变化Fig.4 The variation of VFAs and ethanol of the ABR system
2.3 ABR产氢系统的影响因子
pH值、ALK和ORP是产氢发酵菌群的重要生态影响因子[19].前25d,产氢系统的3格室pH值、ALK和ORP发生了明显的变化(表1).第1格室,pH 4.8(第 1d)降低到 pH 3.5(第 15d).而第 2、3格室则在运行的第10d即达到最低值,pH值分别为3.7和3.9.各格室ORP的变化规律差异较大,第 1格室从启动时 ORP-510mV逐渐上升到-190mV(第20d),之后又有所下降,第25d的ORP为-230mV;第2、3格室,在运行的前25d,ORP分别为-490~-210mV 和-440~-250mV,波动较大,直到 25d之后才稳定(-250mV).系统运行 25d后,3格室的分别稳定在pH为4.3~4.4、ALK为306~334mg/L和ORP为-240~-250mV.
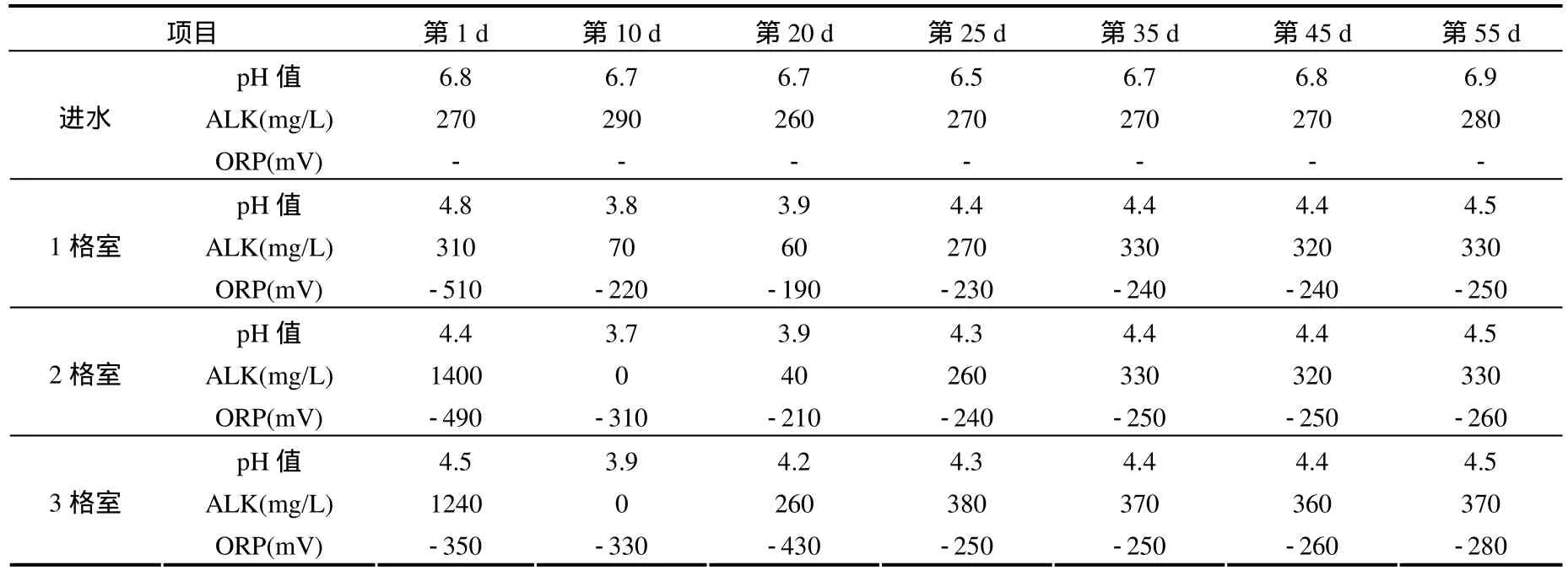
表1 系统运行55d pH值、ALK和ORP的变化Table 1 The variation of pH, alkalinity and ORP in the ABR during 55 days operation
ABR的前15d,3格室的VFAs总量分别为832.0、1521.0和1688.0mg/L.pH值在4.7以下,pH值主要取决于ALK,即HCO3-浓度,而 HCO3-浓度与系统产生的CO2直接相关,ABR 3格室的产气量很少,HCO3-浓度较低,VFAs浓度变化不大,pH值和 ALK 呈现了下降趋势.运行 15d后,随着ABR 3格室的产气量和VFAs浓度迅速增加,产生更多的CO2,由HCO3-浓度的增加导致ALK的提高,使系统的 pH值更加稳定.系统运行到 15d后,3格室的pH值仍稳定在4.4左右.对于ABR系统,ORP会受到pH的影响.如表1所示,pH低时ORP高,而pH值高时ORP则低.
2.4 ABR产氢系统COD的去除情况
厌氧处理系统去除废水中有机物,主要通过产甲烷菌群作用实现的[20].而 ABR生物制氢系统以产酸发酵菌群代谢为主,对废水 COD的去除主要是通过微生物细胞合成、CO2和H2释放实现,大多数量的 COD 被转化为挥发酸,仍然停留在ABR系统中,所以COD去除率相对较低.
由表2可见,ABR 3格室COD浓度均随着进水COD的变化而波动.在运行初期, 发酵菌群可以利用大分子碳水化合物、脂肪酸及蛋白质等,增长速率快;而产乙酸菌群仅能利用简单的有机物如挥发性脂肪酸、乙醇、CO2和H2等,增长速度较慢.ABR的第1格室,由于进水提供了充足的底物,使产酸发酵菌群迅速增长,第18d达到稳定,而pH值、ALK和ORP在运行到第26d时才达到稳定.第18d后,第1格室的的优势菌群为产酸发酵菌群.由于糖类在第1格室的降解,ABR系统的第 2、3格室,发酵中间产物(如乙醇、丙酸、丁酸等)逐渐升高,为产乙酸菌的增长提供了良好的生态条件.第2、3格室的生物量在运行到第33d后趋于稳定,而发酵类型和其他的运行参数已经在第 26d达到稳定,这是由于产乙酸细菌的增长速率低于产酸发酵菌群,它需要在比较长的时间内达到稳定运行状态.
根据ABR从第33~55d的运行数据,3格室的生物量为 7.31,10.44,10.02gMLVSS/L,产氢量为 7.2,15.1,10.2L/d,各格室比产氢速率分别为0.11,0.16,0.11L/(gMLVSS·d),系统比产氢速率为0.13L/(gMLVSS·d).
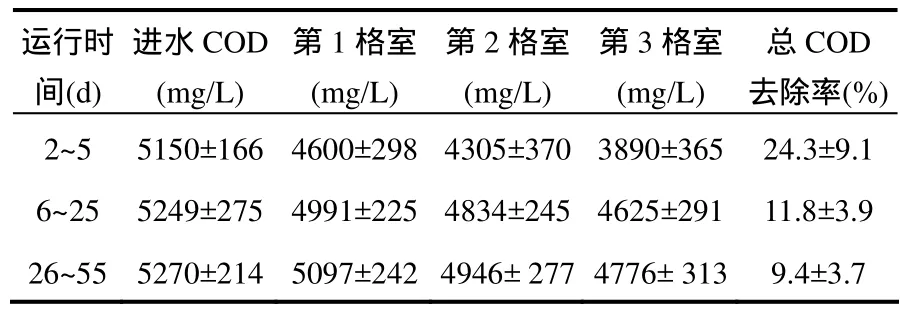
表2 ABR系统运行过程中各个格室COD变化Table 2 COD in each compartment of the ABR during 55 days operation
由于接种污泥自身的代谢作用和污泥絮体的吸附作用,各格室对COD有一定的去除.第26~55d,ABR对COD的去除率相对稳定,进水COD浓度为5270mg/L,第1、2、3格室出水COD浓度分别为5097,4946,4776mg/L,产氢量为32.5L/d,由此可计算出ABR系统单位COD的比产氢率为0.13L/gCOD,其中第1、2、3格室的平均单位COD比产氢速率分别为0.03,0.06,0.04L/gCOD.
2.5 ABR产氢系统生物量变化情况
在ABR运行的初期,各格室的生物量呈现下降趋势,在第 6d达到最低,分别为 5.40,5.47,5.36gMLVSS/L,之后逐渐上升,第 1格室在达到7.30gMLVSS/L(第 18d),并在以后保持稳定运行.从液相末端产物的结果分析,第 1格室运行至第26d才达到稳定状态;第2、3格室的生物量,第33d才达到稳定,分别为 8.9,9.4gMLVSS/L.可见,生物量的增长和群落演替可以同时发生,但步调并不一致,这是由于系统中菌群的增殖速率不同而造成的.
2.6 ABR与CSTR运行特性比较
如表 3所示,在进水 COD 5000mg/L,温度35℃等相同条件下,考察了乙醇型产氢系统CSTR、ABR的最大产氢能力.
当进水 COD浓度、进水流量发生变化时,都会对发酵产氢系统造成冲击.由于 CSTR的混合液是均匀的,其抵抗能力基本来自混合液对进水的稀释作用,而这种稀释作用为系统抗冲击负荷能力的贡献是一定的,很容易引起系统内 pH值、ALK和ORP等环境条件的变化,因而会影响产氢系统的污泥的代谢活性,从而造成产氢速率的变化.研究中发现,在稳定的乙醇型发酵阶段,CSTR反应系统的产氢速率也会在 9.75~14.99L/d较大范围内波动.而 ABR系统,即便是受水质变化影响最大的第 1格室,在稳定运行阶段(第 26~55d),其产氢速率的波动范围仅为6.65~7.61L/d.ABR第 1格室产氢速率稳定的主要原因是格室中的污泥床可能起到了重要作用.在污泥床中,聚集了悬浮的高密度的微生物絮体,它们与格室内环境相互作用,构成了稳定的生态系统,当水质发生变化时,该系统可以通过内平衡机制维持其稳定性.ABR第 1格室的缓冲作用,保障第2、3格室的稳定运行起,它们在稳定期的产氢速率维持在15.7~16.0L/d和9.6~10.9L/d.
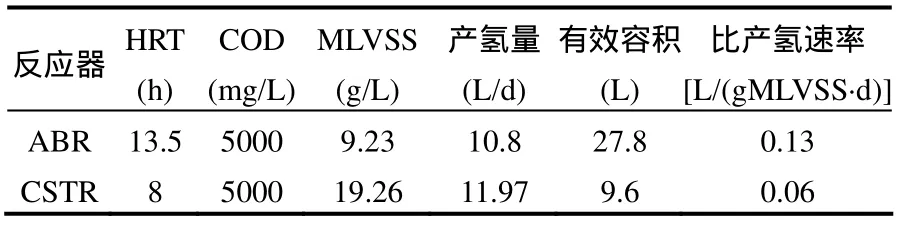
表3 两种产氢系统乙醇型发酵的运行特性比较结果Table 3 Comparison of the CSTR and ABR hydrogen-producing capability
葡萄糖在厌氧条件下,可以通过产酸发酵细菌和产氢产乙酸菌这两类菌群的先后作用产生氢气.第1步,葡萄糖在产酸发酵类细菌的作用下,通过EMP途径产生乙酸、丙酸、丁酸和乙醇等,同时释放H2;第2步,丙酸、丁酸和乙醇在一类被称作产氢产乙酸菌的微生物作用下,转化为乙酸,同时释放H2[13].在CSTR系统中,混合液均匀混合的特性使产酸发酵细菌在厌氧活性污泥中占有绝对优势,而代谢速率相对慢和代时相对长的产氢产乙酸菌无法被选择而被淘汰,因此,其对葡萄糖的代谢产氢主要是通过产酸发酵反应实现,其代谢产生的乙醇、丙酸和丁酸几乎不能通过产氢产乙酸作用而进一步产氢.ABR的各格室均能形成与其内环境相适应的微生物群落,即实现了生物相的分离.分析认为,基质和环境的选择作用是改变微生物群落的主要原因.因此,在 ABR 系统中,葡萄糖不仅可以通过生化反应产生氢气(第 1格室),而且产酸发酵细菌产生的乙醇、丙酸和丁酸还可在产氢产乙酸菌的代谢作用下,进一步转化并产氢(第 2、3格室).CSTR系统达到稳定的乙醇型发酵后获得的最大产氢能力为0.06L/(gMLVSS·d),而 ABR 系统,在稳定的乙醇型发酵时,单位生物量的比产氢率为0.13L/(gMLVSS·d),表明ABR对底物的转化产氢能力要高于CSTR.这是ABR比CSTR比产氢速率高的主要原因.
研究表明,通过糖酵解途径,1mol葡萄糖在降解转化为乙酸,或丁酸,或乙醇的过程中,理论上只能产生2 mol的氢气,通过辅酶Ⅰ的氧化与还原也能产生一部分氢气,而丙酸发酵途径根本就没有氢气的产生,这就是产酸发细菌很难突破4 molH2/molG的原因[21-22].HPA可将产酸发酵菌群产生的丙酸、丁酸等VFAs和醇类进一步转化为乙酸,同时释放分子氢.因此,将产酸发酵菌群的产酸发酵作用与HPA的产氢产乙酸作用联合起来,就能实现生物质的梯度发酵产氢,大幅提高基质的氢气转化率.而这也正是ABR产氢效能高于CSTR的主要原因.
3 结论
3.1 采用 ABR作为有机废水发酵制氢反应设备,在35℃和进水COD 5000mg/L条件下,系统可在26d达到运行的稳定状态.ABR系统产氢系统运行稳定期,第 1格室的产气量 14.1L/d,产氢量7.2L/d,氢气含量 51%,均为最重要产氢格室.第 2格室和第 3格室的产气量和产氢量也有相似的变化规律,产气量和产氢量开始上升.
3.2 ABR产氢系统的相末端发酵产物,3格室达到稳定阶段,均为典型的乙醇型发酵.液相末端发酵产物的变化规律,反映了活性污泥微生物代谢特征的改变,也揭示了活性污泥在驯化过程中的微生物群落结构的变化.
3.3 pH值、ALK和ORP是ABR产氢系统发酵菌群的重要生态影响因子.
3.4 ABR系统单位 COD的比产氢率为0.13L/gCOD,3格室的平均单位COD比产氢速率分别为 0.03,0.06,0.04L/gCOD.而在同样条件下,CSTR的比产氢速率仅为0.06L/(gMLVSS·d).
3.5 在 ABR运行的初期,各格室的生物量呈现下降趋势,在第 6d达到最低,分别为 5.40,5.47,5.36gMLVSS/L,之后逐渐上升,第 1格室在达到7.30gMLVSS/L(第 18d),并在以后保持稳定运行.从液相末端产物的结果分析,第 1格室运行至第26d才达到稳定状态;第2、3格室的生物量,第33d才达到稳定,分别为 8.9,9.4gMLVSS/L.可见,生物量的增长和群落演替可以同时发生,但步调并不一致,这是由于系统中菌群的增殖速率不同而造成的.
3.6 与CSTR相比,ABR具有较高产氢效能、较低能源消耗等优点.将产酸发酵菌群的产酸发酵作用与HPA的产氢产乙酸作用联合起来,就能实现生物质的梯度发酵产氢,大幅提高基质的氢气转化率.而这也正是ABR产氢效能高于CSTR的主要原因.
[1]Das D, Veziroglu T N. Advances in biological hydrogen production processes [J]. International Journal of Hydrogen Energy, 2008,33:6046-6057.
[2]宗文明,于瑞嵩,樊美珍,等.一株利用生物柴油废水产氢的光合菌的筛选、鉴定 [J]. 中国环境科学, 2009,29(10):1076-1081.
[3]姜 潇,王毅力,张 桐,等.厌氧折流板反应器(ABR)中成熟颗粒污泥的分形分析 [J]. 环境科学学报, 2008,28(4):649-658.
[4]Zhu G F, Li J Z, Wu P, et al. The performance and phase separated characteristics of an anaerobic baffled reactor treating soybean protein processing wastewater [J]. Bioresource Technology, 2008,99:8027-8033.
[5]Li Jianzheng, Li Baikun, Zhu Gefu, et al.Hydrogen production from diluted molasses by fermentative mixed microbe flora culture in an anaerobic baffled reactor (ABR) [J]. International Journal of Hydrogen Energy, 2007,28(6):1-10.
[6]鲍立新,李建政,昌 盛,等. ABR处理大都蛋白废水的效能及微生物群落动态分析 [J]. 环境科学, 2008,29(8):2206-2213.
[7]杜接弟,王毅力,李 炯,等. HRT对ABR处理低浓度废水的效果和颗粒污泥特征的影响 [J]. 环境科学, 2009,7(10):2022-2029.
[8]Li Jianzheng, Zheng Guochen, He Junguo, et al. Hydrogenproducing capability of anaerobic activated sludge in three types of fermentations in a continuous stirred-tank reactor [J].Biotechnology Advances, 2009,27(5):573-577.
[9]潘朝智,刘 敏,陈 滢,等.酸性条件下模拟高浓度有机废水厌氧水解酸化试验研究 [J]. 水处理技术, 2009,35(12):94-97.
[10]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版. 北京:中国环境科学出版社, 2002:27-30.
[11]Li J Z, Ren N Q, Li B K, et al. Anaerobic biohydrogen production from monosaccharides by a mixed microbial community culture[J]. Bioresource Technology, 2008;99:6528-6531.
[12]昌 盛,李建政,李伟光,等.厌氧活性污泥发酵制氢系统中的同型产乙酸作用及其控制 [J]. 太阳能学报, 2011,4(32):439-445.
[13]郑国臣,李建政,赵 峰,等.微量元素对厌氧折流板反应器(ABR)发酵产氢产甲烷的影响 [J]. 中国给水排水, 2012,3(28):20-23.
[14]Li Jianzheng, Li Baikun, Zhu Gefu, et al. Hydrogen Production from diluted molasses by fermentative mixed microbe flora culture in an Anaerobic Baffled Reactor (ABR) [J]. International Journal of Hydrogen Energy, 2007,28(6):3274-328.
[15]ZHENG Guochen, ZHAO Feng, YANG Hang, et al. Comparison between INT and TTC assay to determine the dehydrogenase activity of flocs [J]. Water Resource and Environmental Protection, 2011,5:1690-1693.
[16]赵云飞,刘晓玲,李十中,等.有机成分比例对高固体浓度厌氧发酵产甲烷的影响 [J]. 中国环境科学, 2012,32(6):1110-1117.
[17]Wang C H, Chang J S. Continuous biohydrogen production from starch with granulated mixed bacterial microflora [J]. Energy Fuels, 2008,22:93-97.
[18]Luo G, Xie L, Zou Z H, et al. Evaluation of pretreatment methods on mixed inoculum for both batch and continuous thermophilic biohydrogen production from cassava stillage [J]. Bioresource Technology, 2010,101:959-964.
[19]Alfons J M Stams, Caroline M Plugge. Electron transfer in syntrophic communities of anaerobic bacteria and archaea [J].Nature Reviews Microbiology, 2009,7:568-577.
[20]陈广银,郑 正,常志州,等.不同氮源对麦秆厌氧消化过程的影响 [J]. 中国环境科学, 2011,31(1):73-77.
[21]ZHENG Guochen, LI Jianzheng, ZHAO Feng,et al.Effect of illumination on the hydrogen -production capability of anaerobic activated sludge [J]. Frontiers of Environmental Science and Engineering, 2012,1(6):125-130
[22]McInerney M J, Struchtemeyer C G, Sieber J. Physiology, ecology,phylogeny, and genomics of microorganisms capable of syntrophic metabolism [J]. Ann. N. Y. Acad. Sci., 2008,1125(3):58-72.

