克百威光催化降解动力学的研究
阳 海 ,周硕林 ,尹明亮 ,皮露露 ,曾 健 ,易 兵 (.湖南工程学院化学化工学院,湖南 湘潭404;2.湖南师范大学化学化工学院,湖南 长沙 4008)
克百威,又名呋喃丹,虫螨威,大扶农,它是一种常用的高效广谱氨基甲酸酯类杀虫剂和杀螨剂,其主要具有触杀,内吸及胃毒作用,并且兼有杀虫,杀螨和杀线虫的生物活性,对多种害虫有效[1].自 1983年有机氯农药开始停用后,克百威曾经被广泛使用[2].目前,虽然我国已经对克百威在蔬菜、水果、茶叶、药材等农作物的使用上限做了一些规定,但是其使用量还相当大,并且还存在着一些不当的使用方法.由于在农业生产生活中的广泛运用,克百威进入并广泛地存在于环境中[3].存在于环境中的克百威,由于使用量大、水溶性相对较好,极易通过土壤进入地下水和地表水等饮用水源,对人类的生存环境造成了极大的威胁[4];由于克百威的高毒性、难以降解等性质,其一旦进入环境水体后,能通过生物链富集放大,对水生生态系统和人类的健康造成了极大危害[5-6].因此,研究广泛存在于环境水体中克百威的去除方式具有重要意义.然而残留在水体环境中克百威由于浓度相对较低,并且不易于生物降解[7-8],其污染治理相对困难.而 TiO2/hv光催化作为典型的深度氧化技术之一,已经广泛的运用于持久性有机污染物的治理中[9-15].尽管有部分科研工作者已经开展了克百威的光催化降解研究工作[16-18],但是目前的研究工作主要集中在克百威的降解动力学及其可行性方面,对广泛存在于环境水体中的阴阳离子、活性物种等对其降解动力学影响并没有做深入的研究.
因此,本文以克百威为研究目标,运用多相光催化降解技术系统地探讨克百威在不同催化剂用量,不同溶液初始 pH值,不同底物浓度以及不同阴阳离子对其降解动力学的影响,并着重考察了h+、·OH等一系列活性物种(ROSs)对克百威光催化降解的贡献,来阐述二氧化钛光催化降解克百威的机制,为光催化技术在实际中应用提供依据.
1 实验部分
1.1 仪器与试剂
高效液相色谱(CoMetro 6000),高压汞灯(GGZ-125,上海亚明灯泡厂有限公司,Emax=365nm), PHS-3B精密酸度计(上海雷磁仪器厂).克百威(湖南化工研究院提供,纯度≥99%);盐酸和氢氧化钠均为AR级;乙腈和甲醇为GR级;光催化剂TiO2(Degussa P25).
1.2 试验方法
取150mL含0.5%(体积比)乙腈的克百威溶液于自制的光催化反应器中,加入一定量的粉末TiO2,蔽光搅拌30min,使TiO2粉末在溶液中分散均匀,达到吸附-脱附平衡.然后开启紫外灯进行光催化降解实验,在规定的时间间隔取样约3mL,0.2μm 的过滤膜过滤,用高效液相色谱进行定量分析.
1.3 分析方法
克百威的定量分析用 CoMetro 6000高效液相色谱分析,紫外检测器的波长为 280nm,分析柱为 Diamonsil C18反相柱(150mm×4.6mm,5μm),柱温为25℃.流动相组成为20%水和80%甲醇,流动相流速为 1.0mL/min.克百威的浓度可由工作曲线得到;溶液pH值用PHS-3B精密酸度计测定.
2 结果与讨论
2.1 克百威光催化降解动力学分析
在反应体系中加入0.5%的乙腈,达到模拟水体环境中天然有机质对克百威的光催化降解动力学影响的目的[19].首先对其光催化降解动力学进行了探讨,结果如图1.

图1 克百威光催化降解动力学曲线Fig.1 Photocatalytic degradation kinetic of carbofuran
从图1可以看出,底物浓度(C)为 100μmol/L的克百威溶液,在催化剂用量为 1.0g/L,光催化降解 90min,克百威的去除率约为 95%左右.用Langmuir-Hinshelwood (L-H)动力学模型来描述克百威的光催化降解,

当KC<<1,式(1)可以简化为假一级动力学模式

式中:k为内反应速率,μmol/(L·min);K是克百威在光催化剂表面的 L-H吸附常数, (μmol/L)-1;k1为假一级动力学常数.利用 ln(C/C0)对反应时间作图,得到方程:

研究结果表明,克百威的光催化降解符合假一级动力学,其降解速率常数为0.0273min-1,半衰期为25.4min.
2.2 催化剂用量对克百威降解动力学的影响
考察了在催化剂用量为 0.25,0.50,1.00,2.00,3.00g/L条件下,对克百威降解动力学的影响,结果见图 2.从图 2中的内图可以看出随着催化剂用量的增加,克百威的降解速率增加,当催化剂用量为 1.0g/L的时候,其降解速率达到最大值为0.0273min-1.然而进一步增加催化剂的用量,其降解速率降低.这主要是因为增加催化剂的量,也就增加了 TiO2光催化的活性位点,降解加快.然而,随着催化剂用量的进一步增加,溶液的透光性变差,部分催化剂被遮盖以至于接触不到紫外光,在光催化降解过程中部分催化剂未被完全激活[10],从而克百威催化降解速率体现下降趋势.因此,催化剂用量为1.0g/L时,克百威的降解速率最大.
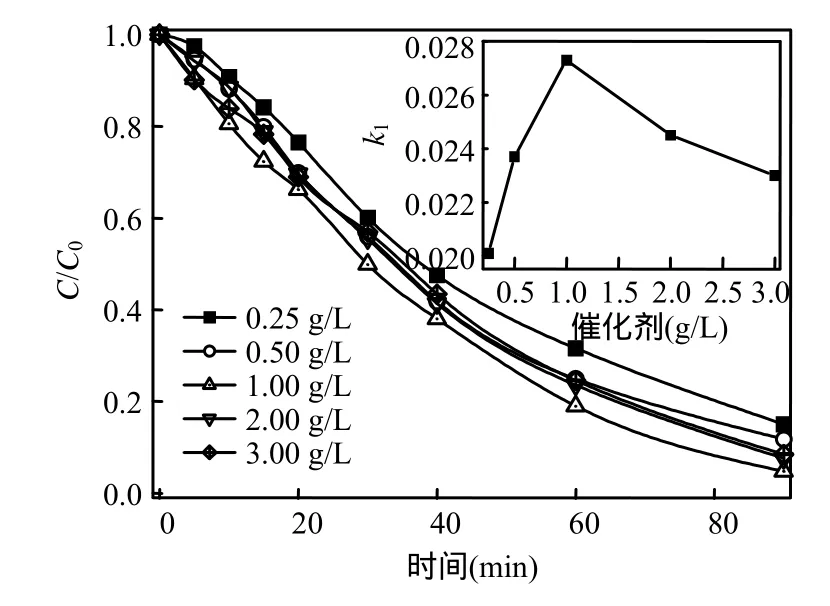
图2 催化剂用量对克百威光催化降解速率的影响Fig.2 Effect of TiO2 dosage on the photocatalytic degradation rate constant of carbofuran
2.3 溶液初始 pH值对克百威降解动力学的影响
克百威分子含有 N、O等杂原子,而杂原子上的孤对电子容易吸收质子显碱性.因此,探讨溶液不同初始pH值对克百威光催化降解动力学的影响具有十分重要的意义.本论文考察了克百威浓度为 100μmol/L,催化剂用量为 1.0g/L,溶液初始pH值在3.0,5.0,7.0,9.0和11.0时,对降解速率常数的影响,结果如图3.从图3可以看出随着溶液初始 pH值的增加,克百威的降解速率增加,当溶液的初始pH值为9.0时,其降解速率达到最大为 0.0409min-1.然而当溶液的初始 pH值上升到11.0时,其降解速率则降为0.0317min-1.结果表明,弱碱性条件下克百威的降解速率最大,而酸性和碱性条件下均不利于克百威的光催化降解.这可能是由于在酸性条件下,克百威分子中杂原子上的孤对电子容易吸收溶液中的质子而带正电荷,容易和同样带正电荷的光催化剂 TiO2表面相互排斥,从而影响克百威在光催化剂表面的吸附,导致了相对较低的降解速率[20];另一方面,在碱性条件下,较高浓度 OH-在阻碍 UV光线达到光催化剂表面的同时还能产生活性氧物种淬灭剂CO32-,从而降低了克百威的降解速率[21].

图3 不同溶液初始pH值对克百威光催化降解速率的影响Fig.3 Effect of pH values on the photocatalytic degradation rate constant of carbofuran
2.4 底物浓度对克百威降解动力学的影响
固定催化剂用量为 1.0g/L,分别考察了底物初始浓度为 50,80,150,200μmol/L对克百威降解动力学的影响,结果如图4.从图4可以看出克百威初始浓度由50μmol/L增至200μmol/L时,其降解速率由0.0309下降至0.0239min-1.接着,用L-H模型对克百威光催化吸附和降解过程进行了描述.通过式(1)和(2),
得到

并进一步转化为其线性形式

式中:k1为假一级动力学常数,min-1;k是内反应速率,μmol(L·min);K是克百威在光催化剂表面的L-H吸附常数,(μmol/L)-1[20,22].
由1/k1对底物浓度C作图,如图4B中内图.可以看出1/k1与初始浓度C之间有很好的线性关系,并且从该直线的斜率和截距通过计算得出k为 14.79μmol(L·min),K为 0.0026 (μmol/L)-1.尽管克百威在光催化剂表面的吸附量并不大,但发生在光催化剂 TiO2表面的氧化反应,如 h+和·OH自由基对克百威的氧化降解在其降解中起主导作用.
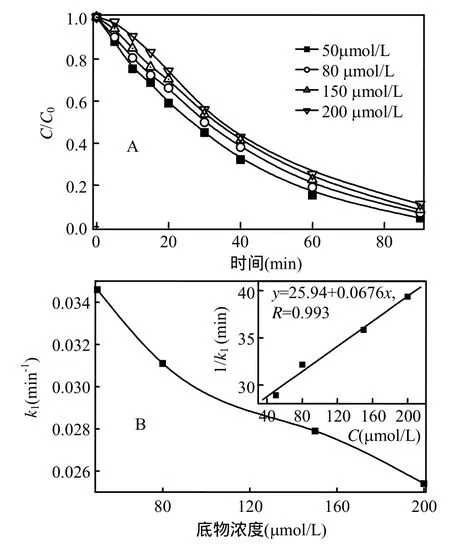
图4 不同底物浓度对克百威光催化降解速率的影响Fig.4 Effect of initial concentration on the photocatalytic degradation rate constant of carbofuran
2.5 不同活性物种对克百威降解动力学的贡献
为进一步区分光生空穴(h+)和一系列ROSs对克百威光催化降解过程中贡献的大小,在光催化过程中加入了一系列的ROSs淬灭剂进行对比研究.在溶液中加入异丙醇(0.1mol/L)用来淬灭·OH,而甲醇(0.1mol/L)则用来对h+和·OH的淬灭[23].
图5给出了克百威及其加入ROSs淬灭剂后的降解曲线,加入不同淬灭剂后对应的光催化降解速率常数见表 1.当加入异丙醇时,溶液中·OH淬灭,降解速率由原来的 0.0273min-1降为0.0018min-1,这说明·OH 对克百威的降解贡献比为93.4%,而当反应体系加入甲醇时,溶液中h+和·OH均被淬灭,降解速率则降为0.0009min-1,这说明 h+和·OH 对克百威的降解贡献比为 96.7%.扣除·OH的降解贡献比,得h+的降解贡献比为3.3%,其他 ROSs在光催化过程中对克百威的降解贡献仅为3.3%.研究表明,光催化过程中·OH对克百威的降解起主导作用.
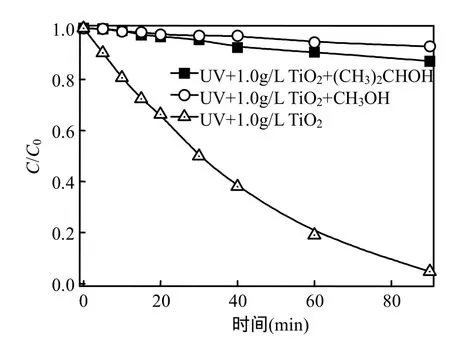
图5 光催化过程中不同活性氧物种对克百威降解速率的贡献Fig.5 The contribution of different ROSs during photocatalytic degradation process

表1 活性氧物种被淬灭后的降解速率Table 1 Scavengers used, reactive species quenched and k1 for carbofuran after quenched ROSs
2.6 不同阴离子对克百威降解动力学的影响
水体环境中含有各种无机阴离子,这些无机离子能改变溶液中离子的强度,从而影响光催化剂的催化活性和有机污染物的降解效率.因此,以K+为阳离子,考察了 0.1mol/L Cl-, BrO3-, NO3-,I-,CO32-, SO42-和S2O82-等阴离子对克百威光催化降解动力学的影响,如图 6.当光催化反应体系加入Cl-, BrO3-, NO3-, I-, CO32-, SO42-和 S2O82-时,其降解速率由原来 0.0273min-1变为相对应的0.0269, 0.1038, 0.0213, 0.0040, 0.0243, 0.0231,0.0329min-1.
结果表明,BrO3-和 S2O82-促进克百威光催化降解; I-则明显抑制克百威的光催化降.另外, Cl-,NO3-, CO32-和SO42-对克百威的光催化降解也均有不同程度的抑制作用. BrO3-和 S2O82-对克百威光催化降解的促进作用,可能是归结于 2种阴离子在溶液中能充当电子接受体[20],从而减少光催化剂表面导带电子和价带空穴结合,如式(6)~式(11),促进了·OH自由基的生成.而BrO3-对克百威光催化降解的促进作用明显大于 S2O82-则是由于式(7)和式(8)中产生的 SO42-在光生空穴(h+)和·OH 自由基的作用下,转化为SO4·-,而 SO4·-的反应活性要低于·OH 自由基,如应式(10)和(11).因此, S2O82-和 BrO3-相比较,其对克百威降解的促进作用相对较弱.I-对克百威的光催化降解的抑制作用,是因为 I-能够淬灭光催化降解过程中的光生空穴和·OH 自由基,很大程度上抑制了光催化反应过程中克百威的降解[10,20].另外, Cl-,NO3-,CO32-和 SO42-能充当活性物种淬灭剂,所以它们对克百威的光催化降解均体现一定程度的抑制作用.

图6 不同阴离子对克百威光催化降解速率的影响Fig.6 Effect of different anions on degradation rate constant of carbofuran

2.7 不同阳离子对克百威降解动力学的影响
无机金属离子在水体环境中普遍存在,能够影响有机污染物的光催化降解速率.因此,以 Cl-离子为阴离子,探讨了 0.1mol/L K+, Ca2+, Na+,Mg2+和Cu2+对克百威光催化降解动力学的影响.从图7中可以看出,当加入反应体系加入K+, Ca2+,Na+, Mg2+和Cu2+后,克百威的降解速率有原来的0.0273min-1降为相对应的 0.0269,0.0264,0.0266,0.0213,0.0253min-1.
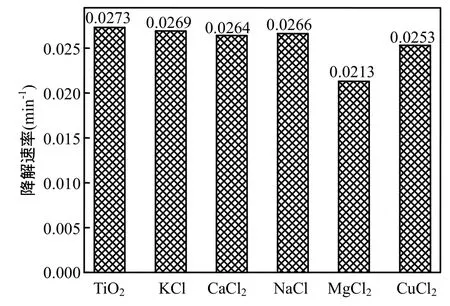
图7 不同阳离子对克百威光催化降解速率的影响Fig.7 Effect of different cations on degradation rate constant of carbofuran
结果表明,5种金属阳离子对克百威的光催化降解速率均有不同程度的抑制作用,并且Ca2+,Mg2+和Cu2+的抑制作用相对较强.这可能是由于Ca2+和 Mg2+等阳离子能和有机污染物形成络合物[24].和原来化合物相比,络合物的光解速率大大降低;另一方面,含 Cu2+溶液中, Cu2+/Cu+和标准氢电极(NHE)相比,其具有相对较低的还原电势,它们能参与水中溶解氧与电子的竞争反应[21],
从而一定程度上抑制了 ROSs的产生,导致了相对较低的光催化降解速率.
3 结论
3.1 克百威的光催化降解动力学通过L-H模型描述得到方程式y= 0.0676-0.0273x.
3.2 克百威在弱碱性条件下降解速率相对较大,而酸性条件不利于克百威的光催化降解.
3.3 克百威在光催化剂表面的吸附相对较弱,但是其发生在光催化剂表面的反应在光催化降解过程占主导作用,并且·OH 对克百威的光催化降解贡献占93.4%,而h+和其他ROSs的贡献仅占6.6%.
3.4 水溶液中BrO3-和S2O82-对克百威的光催化降解有促进作用,其他阴离子均呈现不同程度的抑制作用,并且 I-对克百威的光催化降解的抑制作用最大,而水溶液中的 K+, Ca2+, Na+, Mg2+和Cu2+等阳离子对克百威光催化降解的抑制作用则相对较弱.
[1]Chelinho S, Lopes I, Natal-da-Luz T, et al. Integrated ecological risk assessment of pesticidesin tropical ecosystems: A case study with carbofuran in Brazil [J]. Environ. Toxicol. Chem., 2012,31(2):437-445.
[2]徐剑宏,洪 青,严秋香,等.降解菌 CDS-1 产呋喃丹水解酶的条件及酶学特征 [J]. 中国环境科学, 2006,26(2):210-213.
[3]Rana S M, Asi M R, Niazi F, et al. Determination of organochlorine and nitrogen containing pesticide residues in Labeo rohita [J]. Toxicol. Environ. Chem., 2011,93(10):1851-1855.
[4]Moreno-Gonzalez D, Huertas-Perez J F, Gamiz-Gracia L, et al.Determination of carbamates at trace levels in water and cucumber by capillary liquid chromatography [J]. Int. J. Environ.Anal. Chem., 2011,91(14):1329-1340.
[5]Saxena P N, Gupta S K, Murthy R C. Carbofuran induced cytogenetic effects in root meristem cells of Allium cepa and Allium sativum: A spectroscopic approach for chromosome damage [J]. Pestic. Biochem. Physiol., 2010,96(2):93-100.
[6]Upham B L, Boddy B, Xing X S, et al. Non-genotoxic effects of selected pesticides and their disinfection by-products on gap junctional intercellular communication [J]. Ozone: Sci. Eng.,1997,19(4):351-369.
[7]Kadakol J C, Kamanavalli C M, Shouche Y. Biodegradation of Carbofuran phenol by free and immobilized cells of Klebsiella pneumoniae ATCC13883T [J]. World J. Microbiol. Biotechnol.,2011,27(1):25-29.
[8]王际方.克百威的微生物降解研究进展 [J]. 河北农业科学,2010,14(4):85-87.
[9]阳 海,安太成,李桂英,等.光催化技术降解水中环境药物的研究进展 [J]. 生态环境学报, 2010,19(4):991-999.
[10]安继斌,冯辉霞,阳 海,等.不同活性物种对光催化降解水中邻苯甲酸二甲酯动力学的贡献研究 [J]. 生态环境学报, 2010,19(6):1369-1373.
[11]An T C, Yang H, Li G Y, et al. Kinetics and mechanism of advanced oxidation processes (AOPs) in degradation of cipro fl oxacin in water [J]. Appl. Catal. B: Environ., 2010,94:288-294.
[12]An T C, Yang H, Song W, et al. Mechanistic Considerations for the advanced oxidation treatment of fluoroquinolone pharmaceutical compounds using TiO2heterogeneous catalysis [J].J. Phys. Chem. A, 2010,114,2569-2575.
[13]袁 敏,徐仁扣,封亚辉.微波辅助光催化降解兽药环丙氨嗪 [J].中国环境科学, 2012,32(4):603-608.
[14]魏 红,李克斌,赵 锋,等.磷钨酸光催化降解直接大红4BE 溶液的研究 [J]. 中国环境科学, 2011,31(6):921-926.
[15]王春英,单国强,陈 鹏, 等.光催化剂 Bi3.84W0.16O6.24在模拟太阳光下对双酚 A的降解 [J]. 中国环境科学, 2011,31(12):1977-1982.
[16]Mahalakshmi A, Arabindoo B, Palanichamy A, et al.Photocatalytic degradation of carbofuran using semiconductor oxides [J]. J. Hazard. Mater., 2007,143(1-2):240-245.
[17]Katsumata H, Matsuba K, Kaneco S, et al. Degradation of carbofuran in aqueous solution by Fe(III) aquacomplexes as effective photocatalysts [J]. J. Photochem. Photobiol. A-Chem.,2005,170 (3):239-245.
[18]Tennakone K, Tilakaratne C T K, Kottegoda I R M.Photomineralization of carbofuran by TiO2-supported catalyst [J].Water Res., 1997,31(8):1909-1912.
[19]Zhu X, Feng X, Yuan C, et al. Photocatalytic degradation of pesticide pyridaben in suspension of TiO2: identification of intermediates and degradation pathway [J]J. Mol. Catal. A:Chem., 2004,214:293-300.
[20]Yang H, Li G Y, An T C, et al. Photocatalytic degradation kinetics and mechanism of environmental pharmaceuticals in aqueous suspension of TiO2: A case of sulfa drugs [J]. Catal. Today,2010,153:200-207.
[21]Kashif N, Ouyang F. Parameterse effect on heterogeneous photocatalysed degradation of phenol in aqueous dispersion of TiO2[J]. J. Environ.Sci., 2009,21:527-533.
[22]Yang H, An T C, Li G Y, et al. Photocatalytic degradation kinetics and mechanism of environmental pharmaceuticals in aqueous suspension of TiO2: A case of blockers [J]. J. Hazard. Mater.,2010,179:834-839.
[23]Chung M C H M, Choi W Y, Yoon J Y. Different inactivation behaviors of MS-2 phage and Escherichia coli in TiO2photocatalytic disinfection [J]. Appl. Environ. Microbiol., 2005;71:270-275.
[24]Zainal Z, Lee C Y, Hussein M Z, et al. Effect of supporting electrolytes in electrochemically-assisted photodegradation of anazodye [J]. J. Photochem. Photobiol. A: Chem., 2005,172:316-321.

