BNIP3在细胞凋亡与自噬中的作用
徐 冉,魏珑珑,李志强,李晓锋,韩丽辉
(1 山东大学医学院,济南 250012;2 安丘市立医院)
BNIP3属于Bcl-2家族蛋白中的BH3-only亚家族,其结构、细胞内定位、对细胞生存的调控与BH3-only亚家族的其他蛋白不尽相同。近年来研究发现,BNIP3不仅参与细胞的凋亡,同时调控细胞自噬和坏死等过程。在不同的外界环境下,其调控方式和作用效应也不尽相同,其调控方式的复杂性预示着其生物学活性的多样性。阐明其作用机制对于理解和控制多种病理、生理过程具有重要意义。本文就BNIP3在细胞凋亡与自噬中的作用作一综述。
1 BNIP3的结构与定位
1.1 BNIP3的结构 BNIP3是一种能与腺病毒E1B19kD蛋白相互作用的蛋白质,BNIP3基因定位于10号染色体10q26.3,包含6个外显子,基因序列全长585 bp,编码194个氨基酸,分子量约21 kD[2]。Bcl-2家族蛋白是参与调节细胞凋亡的主要蛋白之一,所有成员的蛋白结构中包含至少1个Bcl-2同源结构域(BH1~BH4);而作为仅含BH3同源结构域的BNIP3,主要包含以下功能结构域[4,5](图1):①PEST结构域:位于54~81位氨基酸,可被胞质内的蛋白酶迅速降解,是BNIP3蛋白降解的靶位点,调节细胞内BNIP3蛋白的含量。②BH3结构域:位于104~119位氨基酸,绝大多数促凋亡蛋白通过此结构域与抗凋亡蛋白(Bcl-2、Bcl-XL)形成异二聚体后发挥促细胞凋亡功能[1],而BNIP3的此序列与其他Bcl-2家族也有所不同,BNIP3不通过此途径形成异源二聚体,此结构域参与BNIP3介导的Caspase依赖性线粒体凋亡途径。③氨基端结构域(NH2结构域):位于1~49位氨基酸,与BH3结构域具有相似的功能,BNIP3此结构域与TM结构域在形成二聚体促进细胞凋亡中有着重要作用[1]。④C-末端跨膜区(TM):位于164~194位氨基酸,是BNIP3行使其促凋亡功能的最重要的结构域。对促进细胞凋亡、同源二聚化、介导BNIP3定位到线粒体、活化BNIP3至关重要[1]。但也有相关研究提示,C末端TM的同源氨基酸序列可能不是凋亡所必需的,该结构介导细胞非Caspase依赖性的线粒体凋亡途径[3]。
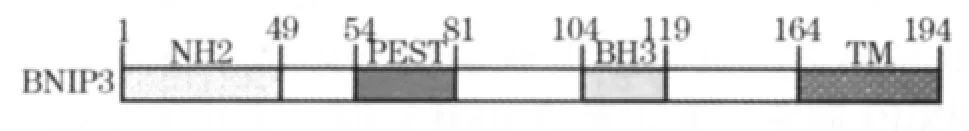
图1 BNIP3的结构简图
1.2 BNIP3的定位 正常生理条件下,人类多种正常组织中均有BNIP3的表达,但表达量很低,仅能从人脑细胞和骨骼肌细胞中检测到BNIP3的表达[2,5~7],但也有部分细胞不表达 BNIP3,如神经元细胞[8];而在缺氧条件下,BNIP3的表达上调。研究证实,正常脑组织细胞中BNIP3的表达定位于细胞核;在外界压力如缺氧的诱导下,BNIP3的表达则由核转位至胞质[5]。
在多种细胞中,BNIP3核内表达之后,绝大多数存在于胞液或松散地结合在线粒体外膜上,当凋亡信号被激活时,BNIP3从胞液转移到线粒体外膜引起线粒体功能障碍,最终引起细胞死亡[1,7]。而当BNIP3与E1B19K共表达时,其表达定位于细胞核,这在多种肿瘤细胞中得到证实[5]。但当细胞核中BNIP3表达增加时,细胞死亡的数量却没有增加,这可能与BNIP3和凋亡诱导因子(AIF)的相互作用有关[10]。AIF是一种线粒体黄素蛋白,在外界刺激下,AIF从线粒体转移到细胞核,介导非Caspase途径的细胞死亡;当抑制AIF表达时,细胞凋亡的数量会有所减少;同时,在许多肿瘤细胞中也发现AIF的表达水平下降。位于核内的BNIP3能够与AIF启动子结合,招募多蛋白复合物HDAC1/PSF抑制AIF的转录和翻译,减少AIF介导的DNA裂解;这可以从一定程度上解释核内BNIP3表达增加却并未增加细胞死亡这一现象[10]。
2 BNIP3与细胞凋亡
Bcl-2家族作为细胞凋亡的中心调控环节,在整合细胞内外各种生存与死亡信号后,决定细胞是否存活,而BNIP3作为Bcl-2家族的一员,也在细胞凋亡的过程中发挥独特作用。免疫印迹研究结果显示,BNIP3蛋白存在30 kD单体和60 kD二聚体两种形式[2];相应的研究证实,BNIP3形成同源二聚体对其发挥促凋亡功能非常重要。
2.1 BNIP3的作用方式 与其他Bcl-2家族蛋白不同,BNIP3及其同系物Nix/BNIP3L第64位氨基酸为半胱氨酸,对氧化应激压力敏感;生理条件下,因胞液处于高度还原状态,半胱氨酸始终保持着硫醇或硫醇盐的形式,因此,内源性BNIP3主要以单体分子的形式存在;而当心肌缺血—再灌注(I/R)发生时,由于产生大量活性氧,第64位半胱氨酸残基发生氧化,BNIP3蛋白之间通过二硫键形成同源二聚体;同时,BNIP3也通过COOH末端的172位丝氨酸与173位组氨酸形成氢键而形成二聚体[11]。BNIP3同源二聚体激活BNIP3,而过表达的BNIP3在线粒体外膜上形成质子通道,促进离子转导,降低线粒体膜电位和增加细胞膜通透性,引起细胞死亡。
BNIP3与其他BH3-only蛋白作用方式有很大的不同。生理情况下,BH3-only蛋白通过BH3结构域与Bcl-2家族的抗凋亡蛋白结合而促进细胞凋亡,而BNIP3则通过TM、NH2结构域与Bcl-2、Bcl-XL相互作用,通过线粒体位点和非线粒体位点发挥促凋亡功能[1]。Bcl-2、Bcl-XL竞争结合TM结构域而阻断BNIP3同源二聚体的形成,也阻断其诱导的细胞死亡的过程。Bcl-2、Bcl-XL作为抗凋亡蛋白,过表达能延缓BNIP3介导的细胞死亡[1]。
BNIP3主要分布于内质网(ER)和线粒体,其在细胞内的位置决定细胞死亡的方式[12]。位于ER的BNIP3使ER内储备的Ca2+释放,Ca2+随后在线粒体里聚集,开放MPT通道并产生大量的ROS,导致膜电位丢失,引起Caspase依赖型的细胞凋亡;而Bcl-2与三磷酸肌醇受体(IP3R)结合,阻止ER释放Ca2+及随后的细胞死亡。位于线粒体的BNIP3则引起不依赖于Ca2+的凋亡途径,BNIP3 TM结构域包含1个右手螺旋结构,并富含组氨酸—丝氨酸氢键,该结构在线粒体膜上形成一个质子通道,使胞质中的质子流入线粒体内,引起MPT开放。但Bcl-2的过表达仅能阻止定位于ER的BNIP3引起的MPT开放,而不能阻止定位于线粒体的BNIP3引起的MPT 开放[12],具体作用机制见图2。
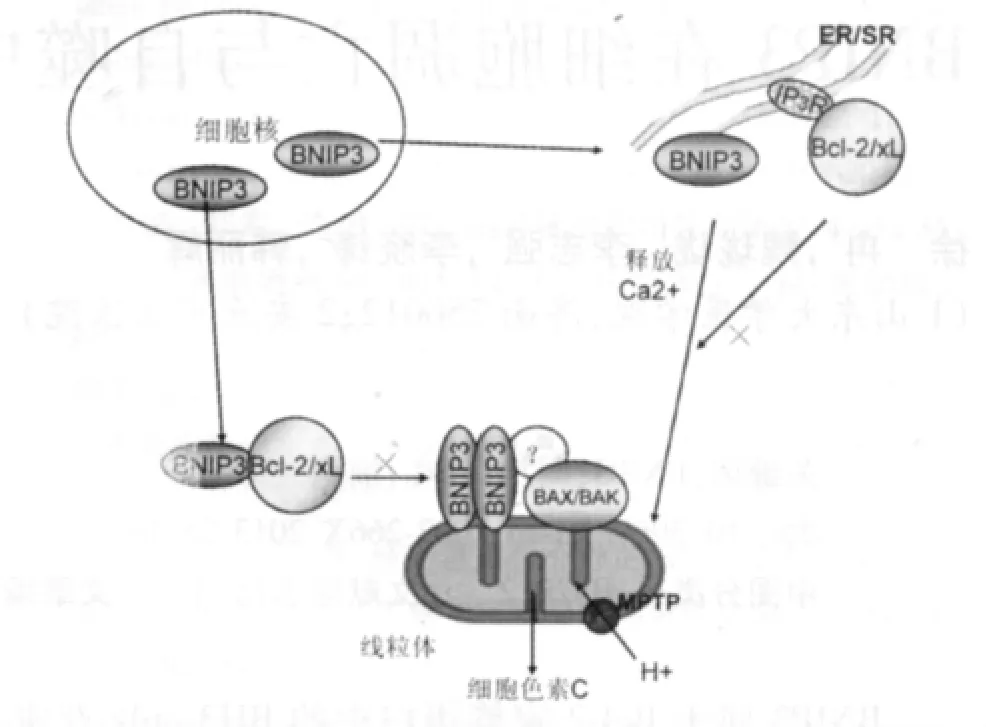
图2 BNIP3细胞内定位及与分子Bcl-2/Bcl-XL的作用机制图
线粒体的动态变化与凋亡需要线粒体内外膜的协调作用,而BNIP3作为定位于线粒体的蛋白质,在调控线粒体裂变这一过程中发挥重要作用。BNIP3也可以通过解离Bcl-2、Bcl-XL来间接活化Bax、Bak,调节 Ca2+浓度,促进 MPT开放,诱导细胞死亡。研究发现,当心肌细胞I/R损伤时,如果细胞缺乏Bax/Bak,即使BNIP3过表达,细胞对缺氧仍然表现为耐受,细胞死亡数量并未增加;说明BNIP3能够通过活化促凋亡蛋白Bax/Bak引起线粒体功能障碍,发挥促凋亡功能。
2.2 BNIP3的凋亡调控机制 正常组织细胞中,BNIP3的表达受到严格的控制,过表达会引起细胞死亡,细胞内存在很多机制可以调控BNIP3的作用效应,如通过抑制转录来抑制BNIP3的表达或抑制BNIP3的同源二聚化以抑制其活化等。
2.2.1 p53与BNIP3介导凋亡的关系 近期研究发现,p53能够通过抑制BNIP3的表达以抵抗缺氧引起的细胞死亡,这与以往p53促凋亡作用是不同的[14]。实验证实,在正常氧含量和缺氧情况下,p53均能抑制BNIP3的表达,这个过程是通过p53的DNA结合区直接抑制BNIP3的启动子实现的[6]。BNIP3是低氧应答基因,其表达受缺氧诱导因子-1(HIF-1)调控。Hela细胞实验证实,HIF-1α过表达引起BNIP3表达升高。而在缺氧或 HIF-1α诱导BNIP3表达的过程中,p53并未参与,说明BNIP3是由缺氧或HIF-1α直接诱导表达的。BNIP3的过表达会引起不同寻常的凋亡过程,没有细胞色素C从线粒体释放,而Caspases抑制剂的使用也不能阻止细胞死亡,因此,HIF-1诱导的BNIP3的表达上调在低氧引起的细胞凋亡中起重要作用。
2.2.2 Rb与BNIP3介导凋亡的关系 研究表明,缺氧条件下在幼鼠的肝细胞、胚胎成纤维细胞、肿瘤细胞系中,视网膜母细胞瘤抑制基因(Rb)的缺失能够导致BNIP3的表达恢复,即Rb通过抑制BNIP3的表达抵抗缺氧引起的细胞死亡[13]。BNIP3启动子附近存在两个保守位点:HIF反应元件(HRE)和E2F结合位点。E2F转录因子作为细胞周期调控因子,通过结合到靶基因启动子中的特殊DNA序列来调节基因的表达,目前发现有5个不同的E2F家族成员,E2F-1到E2F-5。正常氧含量下,大量E2F-4和少量E2F-1结合在 E2F处,而 E2F-3、pRB、HIF-1α不结合BNIP3启动子序列,此时BNIP3的转录受到抑制;缺氧条件下,E2F-1取代E2F-4结合在E2F位点,HIF-1α结合在HRE,pRB/E2F-1复合物限制了 HIF-1α介导的 BNIP3的表达,HIF-1α与HRE结合也限制了E2F-1过量表达时的应答反应,但HIF-1α与pRB、E2F-1之间的作用机制尚不清楚;在缺失pRB的细胞中,缺氧时BNIP3的表达未受抑制[13];BNIP3在常氧和乏氧条件下的表达调控见图3。
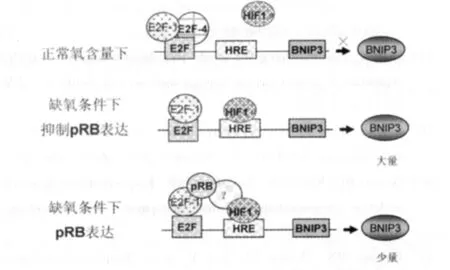
图3 BNIP3在常氧和缺氧条件下的表达调控模式图
2.2.3 其他因子与 BNIP3介导凋亡的关系 在A549肺泡上皮细胞中发现,肿瘤坏死因子(TNF)能够促进 BNIP3表达引起的细胞死亡,包括依赖Caspase-8/Bid的凋亡途径或不依赖Caspase级联反应的坏死途径[15];当TNF与TNF受体结合后,Bid/Bax/Bik插入到线粒体外膜,信号通路活化,BNIP3转录或翻译上调,但BNIP3却不参与Caspase-8/Bid介导的细胞死亡,而主要通过产生ROS、活化溶酶体引发细胞死亡。在巨噬细胞和小肠细胞中,NO也能够通过激活RAS信号途径诱导BNIP3的表达;用三氧化二砷、氰化物等毒素处理细胞,能够通过激活HIF-1因子引起BNIP3的表达[9]。这些研究表明,很多细胞间的应激反应都会引起BNIP3表达的增加,并通过BNIP3的效应介导细胞死亡。
3 BNIP3与细胞自噬
自噬是许多细胞发生的基本现象,但当细胞间营养减少或氧气压力增加时,这种现象会增加;但自噬通过清除蛋白质和线粒体来维持细胞存活的同时,对细胞也是不利的;线粒体数量的恒定对细胞有重要作用,清除受损的线粒体对细胞的生存是必要的,抑制自噬将引起坏死样的细胞死亡[18]。
3.1 BNIP3与自噬的关系 许多研究表明,在多种不同的细胞中,BNIP3能够促进自噬[17],具体机制尚不清楚;在缺氧等外界压力情况下,细胞通过BNIP3介导的自噬来对抗外界压力,维持生存;但部分细胞能够发生自噬性死亡。
近期研究发现,BNIP3可以激活线粒体自噬,在不改变线粒体通透性和不依赖于凋亡的前提下,BNIP3介导线粒体的氧化磷酸化而破坏线粒体,且BNIP3减少了线粒体氧化呼吸过程中必需蛋白质的含量,因而减少线粒体磷酸化和细胞ATP水平,促进线粒体翻转,可引起自噬[8~16]。
细胞质Ca2+浓度的升高、氧化压力的增加、mPTP的开放均被认为是细胞诱导自噬的原因,促凋亡蛋白Bcl-2也曾被报道通过扰乱内质网来增加细胞内Ca2+的浓度。对成人心肌细胞的研究发现,营养匮乏引起的自噬不能被透膜的Ca2+螯合剂BAPTA-AM、mPTP的抑制剂环孢霉素 A(CsA)、抗氧化剂N-乙酰半胱氨酸(NAC)所抑制,BNIP3引起的自噬并未被这些阻断剂所阻断,说明BNIP3引起的线粒体自噬和细胞死亡是不依赖于mPTP途径的。
3.2 轻链蛋白3(LC3)与BNIP3介导的自噬之间的关系 BNIP3与其他BH3-only的Bcl-2家族成员不同,尽管BNIP3介导的细胞死亡依赖于Bax/Bak途径,但BNIP3介导的自噬不依赖于Bax/Bak途径[18];同时,免疫沉淀反应显示,BNIP3与自噬蛋白LC3蛋白相互作用。近期研究表明,BNIP3的同系物Nix(也称作 BNIP3L)直接与自噬蛋白 LC3、GABARAP相互作用,并招募GABARAP而使线粒体去极化,同时Nix结合在自噬小体上的LC3能将线粒体绑定在自噬小体上;对于BNIP3是如何将线粒体定位到自噬小体、BNIP3是否也是自噬的受体目前尚不清楚[19]。在 BNIP3过表达的细胞中,Western blot结果显示,内源性LC3-Ⅱ含量增多;同时在心肌细胞中的研究显示,BNIP3诱导的自噬呈剂量依赖性,表明BNIP3在自噬小体—溶酶体途径中是一种有效活化剂。在电镜下可观察到自噬小体、LC3的定位过程;当阻断BNIP3的表达而阻断缺氧引起的自噬和细胞死亡时,LC3在自噬小体的定位并未受影响,这表明BNIP3参与自噬小体—溶酶体的融合。相反,阻断BNIP3的表达能够阻断LC3的转化和减少自噬性的细胞死亡[21]。
3.3 mTOR通路与BNIP3介导的自噬之间的关系 研究显示,BNIP3介导的自噬能够通过mTOR通路介导。mTOR调节许多生物过程,包括蛋白质的翻译、核糖体的合成、自噬和代谢,并可协调细胞内外信号。在mTOR途径中,BNIP3直接结合Rheb,引起Rheb GTP减少,进而抑制mTORC2的功能,其中BNIP3的TM结构域与Rheb的Cys181相互作用。进一步研究发现,在缺氧微环境下,BNIP3的BH3结构域作为HIF-1的作用靶位,能与Beclin-1-Bcl-2或Beclin1-Bcl-XL复合物相互作用,通过破坏复合物释放Beclin-1引发自噬,而不引起细胞死亡,由BNIP3/BNIP3L介导的缺氧下的自噬是一种保护机制,可以促进肿瘤转移[20]。常氧状态下,BNIP3和BNIP3L的BH3结构域足以启动自噬;缺氧环境下,BNIP3和BNIP3L(作为HIF的两个作用靶位)表达同时受抑制时,缺氧引起的自噬才会受到抑制。
综上所述,BNIP3作为促凋亡蛋白,在正常生理条件下不同细胞内其表达水平有所差异,并适度调控细胞的生存与死亡;在各种外界压力下,尤其是在缺氧条件下,细胞内高表达的BNIP3通过不同的途径来调节细胞活动,不仅促进细胞凋亡,同时也可通过增加细胞自噬使细胞存活,表明BNIP3很可能在肿瘤的转移过程中发挥重要作用。BNIP3在细胞内的作用效应和作用机制还需进一步探讨,相关研究的深入将为肿瘤的靶向治疗提供新途径。
[1]Ray R,Chen G,Vande VC,et al.BNIP3 heterodimerizes with Bcl-2/Bcl-X(L)and induces cell death independent of a Bcl-2 homology 3(BH3)domain at both mitochondrial and nonmitochondrial sites[J].J Biol Chem,2000,275(2):1439-1448.
[2]谢晋予,郑长黎.BNIP3基因及其与肿瘤的关系[J].国际病理科学与临床杂志,2006,26(4):298-301.
[3]曾浩,黄颖,陈铌,等.促凋亡线粒体蛋白BNIP3的表达调控与功能[J].现代泌尿生殖肿瘤杂志,2010,2(2):117-120.
[4]Burton TR,Gibson SB.The role of Bcl-2 family member BNIP3 in cell death and disease:NIPping at the heels of cell death[J].Cell Death Differ,2009,16(4):515-523.
[5]Burton TR,Henson ES,Baijal P,et al.The pro-cell death Bcl-2 family member,BNIP3,is localized to the nucleus of Human glial cells:Implications for glioblastoma multiforme tumor cell survival under hypoxia[J].Int J Cancer,2006,118(7):1660-1669.
[6]Campbell PD,Weinberg A,Chee J,et al.Expression of pro-and anti-apoptotic molecules of the Bcl-2 family in human islets post-isolation[J].Cell Transplant,2012,21(1):49-60.
[7]Luo L,Xiong ZB,Zeng H,et al.Expression of BNIP3 and its correlations to HIF-1 alpha and VEGF in clear cell renal cell carcinoma[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2012,43(1):79-82.
[8]Cho B,Choi SY,Park OH,et al.Differential expression of BNIP family members of BH3-only proteins during the development and after axotomy in the rat[J].Mol Cells,2012,33(6):605-610.
[9]Lu Zhang,Li L,Leavesley HW,et al.Cyanide-Induced Apoptosis of Dopaminergic Cells Is Promoted by BNIP3 and Bax Modulation of Endoplasmic Reticulum-Mitochondrial Ca2+Levels[J].J Pharmacol Exp Ther,2010,332(1):97-105.
[10]Burton TR,Eisenstat DD,Gibson SB.Bcl-2 Nineteen kilodalton Interacting Protein(BNIP3)acts as transcriptional repressor of Apoptosis Inducing Factor(AIF)expression preventing cell death in human malignant gliomas[J].J Neurosci,2009,29(13):4189-4199.
[11]Lawrie CM,Sulistijo ES,Mackenzie KR.Intermonomer hydrogen bonds enhance GxxxG-driven dimerization of the BNIP3 transmembrane domain:roles for sequence context in helix-helix association in membranes[J].J Mol Biol,2010,396(4):924-936.
[12]Zhang L,Li L,Liu H,et al.BNIP3 mediates cell death by different pathways following localization to endoplasmic reticulum and mitochondrion[J].FASEB J,2009,23(10):3405-3414.
[13]Tracy K,Dibling BC,Spike BT,et al.BNIP3 is an RB/E2F target gene required for hypoxia-induced autophagy[J].Mol Cell Biol,2007,27(17):6229-6242.
[14]Feng X,Liu X,Zhang W,et al.p53 directly suppresses BNIP3 expression to protect against hypoxia-induced cell death[J].EMBO J,2011,30(16):3397-3415.
[15]Kim JY,Kim YJ,Lee S,et al.BNip3 is a mediator of TNF-induced necrotic cell death[J].Aoptosis,2011,16(2):114-126.
[16]Thomas RL,Kubli DA,Gustafsson AB.Bnip3-mediated defects in oxidative phosphorylation promote mitophagy[J].Autophagy,2011,7(7):775-777.
[17]Quinsay MN,Thomas RL,Lee Y,et al.Bnip3-mediated mitochondrial autophagy is independent of the mitochondrial permeability transition pore[J].Autophagy,2010,6(7):855-862.
[18]Rikka S,Quinsay MN,Thomas RL,et al.Bnip3 impairs mitochondrial bioenergetics and stimulates mitochondrial turnover[J].Cell Death Differ,2011,18(4):721-731.
[19]Novak I,Kirkin V,McEwan DG,et al.Nix is a selective autophagy receptor for mitochondrial clearance[J].EMBO Rep,2010,11(1):45-51.
[20]Mazure NM,Pouysségur J.Atypical BH3-domains of BNIP3 and BNIP3L lead to autophagy in hypoxia[J].Autophagy,2009,5(6):868-869.
[21]Zhang H,Bosch-Marce M,Shimoda LA,et al.Mitochondrial autophagy is a HIF-1-dependent adaptive metabolic response to hypoxia[J].J Biol Chem,2008,283(16):10892-10903.

