α-半乳糖苷酶水解底物的特异性及其在保育猪日粮中的应用
北京市营养源研究所 张 波 王继强 张宝彤*
α-半乳糖苷是由一个蔗糖单位和1~4个α-半乳糖残基通过α-1,6-糖苷键连接构成的小分子低聚糖,分别生成棉子糖、水苏糖、毛蕊花糖和筋骨草糖,通称为棉子糖。通常,大豆籽实、脱脂大豆(Kuo 等,1988)及豆粕(Grieshop 等,2003)中含有52.4~74.4 mg/kg的α-半乳糖苷。Kuriyama和Mendel(1917)首次研究报道了α-半乳糖苷的抗营养作用。单胃动物肠道黏膜缺乏降解棉子糖的酶,这些寡糖在大肠被寄居在大肠内的微生物发酵, 引起胃肠胀气 (Karr-Lilienthal等,2005)。α-半乳糖苷酶主要参与棉子糖、水苏糖、蜜二糖和半乳甘露聚糖等半乳糖苷的降解 (Brouns等,2006)。不同来源的α-半乳糖苷酶其酶学性质不同,降解α-半乳糖苷的能力也不同。因此,研究其水解底物的特异性具有重要的意义。α-半乳糖苷酶在猪上的研究报道较少,并且日粮中添加α-半乳糖苷酶对动物生长性能影响研究结果不尽相同。因此,本试验研究了青霉来源α-半乳糖苷酶水解棉子糖类寡糖的特异性,并在此基础上验证在保育猪上的应用效果。
1 材料与方法
1.1 水解底物特异性试验
1.1.1 底物及试验用酶 蜜二糖、棉子糖和水苏糖均购于Sigma公司。α-半乳糖苷酶由重组青霉α-半乳糖苷酶菌株液态发酵所得,每毫升发酵上清液活性600 U。
酶活定义:在40℃、pH 5.2的条件下,每分钟从浓度为10 mmol/L的对硝基苯基-α-D-吡喃半乳糖苷(pNPG)溶液中降解释放1 μmol的对硝基酚所需要的酶量为1个酶活单位(U)。
1.1.2 水解反应及产物的测定 1 mL浓度为1.0 mg/mL的蜜二糖、棉子糖和水苏糖(柠檬酸-磷酸缓冲液,pH 5.2)分别与3 U的α-半乳糖苷酶液于37℃孵育16 h,同时3 U的酶液煮沸5 min灭活作为负对照。水解低聚糖释放的半乳糖通过离子色谱(DIONEX,ICS-3000)CARBOPAC PA10高效阴离子交换柱(4 mm×250 mm)和安培计进行检测。流动相是23 mmol/L NaOH,流速是1.0 mL/min。
1.2 动物试验
1.2.1 试验设计 72头平均体重(12.5±0.2)kg的杜×长×大公猪随机分到12个猪圈中,每圈6头。日粮参照《中华人民共和国农业行业标准——猪饲养标准》(2004)推荐的营养需要进行配制,日粮组成及营养水平见表1。试验期为3周。日粮不添加任何抗生素,以粉料饲喂。所有猪自由采食、饮水。试验共设两个处理,空白对照组饲喂基础日粮,加酶组在基础日粮基础上添加300 U/kg的α-Gal。所用的酶是液态发酵,发酵液于4℃离心,分离得到的上清液用稻糠壳吸附,自然风干,酶活为1200 U/g。
1.2.2 测定指标 在试验第21天,所有猪以圈为单位称重,记录采食量,计算日增重(ADG),料重比及日采食量(ADFI)。
1.2.3 统计分析 试验数据以圈为单位进行统计,采用SAS(8.0)单因子方差分析,以P<0.05为差异显著水平。
2 结果与分析
2.1 α-半乳糖苷酶水解底物的特异性 由表2和图1可知,α-Gal对蜜二糖的降解效率最高,棉子糖以及水苏糖也可不同程度被降解。水解反应2 h时,蜜二糖水解释放出的D-半乳糖占总量的60%;水解反应4 h,蜜二糖、棉子糖和水苏糖水解释放的D-半乳糖量占总释放量的80%以上。由表2可见,在实验室条件下,蜜二糖、棉子糖和水苏糖水解率分别为95.7%、72.5%和32.9%。
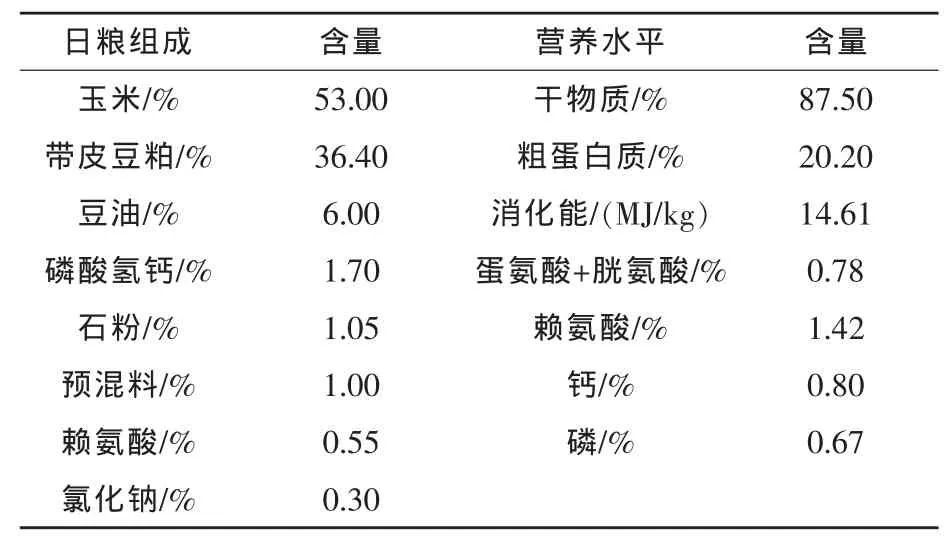
表1 保育猪日粮组成及营养水平

表2 α-半乳糖苷酶的底物特异性

图1 寡糖水解曲线
2.2 α-半乳糖苷酶对保育猪生长性能的影响由表3可知,整个试验期猪生长良好。日粮中添加300 U/kg的α-半乳糖苷酶显著提高了保育猪平均日增重(ADG),与对照组相比,加酶组ADG提高9.76%(P=0.015);加酶组料重比较对照组降低9.21%(P=0.020);平均日采食量两组间无显著性差异。
3 讨论
棉子糖和水苏糖是豆粕中含α-半乳糖苷的主要抗营养因子,底物特异性试验结果表明,青霉来源的α-半乳糖苷酶对于天然的寡糖底物有特异性的水解作用,可以水解绝大多数蜜二糖及大部分的棉子糖,而水解水苏糖的能力最差,其趋势是随着寡糖链长度的增加水解能力逐渐减弱,这与Somiari和Balogh(1995)的报道相一致。而Manzanares等(1998)研究报道,Aniger产生的 α-半乳糖苷酶可以降解人工合成的底物 (pNPG)和天然的底物,如棉子糖、水苏糖和蜜二糖,且随着寡糖链长度的增加,水解释放半乳糖的能力增强。重组α-半乳糖苷酶水解底物的差异,其原因可能是产生酶的菌株不同,酶的最适pH、温度也不同,因而降解底物的能力也有差异。不难看出,不同来源的α-半乳糖苷酶水解底物的能力不同,水解底物有选择性。

表3 α-半乳糖苷酶对保育猪生长性能的影响
通常,豆粕中α-半乳糖苷的含量为52.4~74.4 mg/g(Grieshop 等,2003)。 本试验中豆粕的添加量为36.4%,折合α-半乳糖苷的量约22 g/kg日粮。结合水解试验的结果可知,3 U的α-半乳糖苷酶经过4 h的水解,浓度分别是1 mg/kg的蜜二糖、棉子糖和水苏糖D-半乳糖的释放量占总释放量的80%以上。从理论上讲,降解这3种糖最多需要66 U的α-半乳糖苷酶,但是α-半乳糖苷是一类物质,还有痕量的毛蕊花糖(五碳糖)、六碳糖等,这些痕量的糖类的降解也会消耗一定量的酶。该酶的pH耐受性是值得考虑的问题,由于胃是酸性环境,胃内低pH以及胆酸盐的存在,对酶的活性有影响,部分酶活性丧失,因此,本试验酶的添加量为300 U/kg。
Baucells等(2000)试验结果表明,生长猪日粮(含豆粕)中添加α-半乳糖苷酶(0.08 U/kg饲料)提高了料重比,但对增重和养分利用率无影响。Kim等(2003)研究证实,保育猪日粮中添加0.1%CS (混合酶,α-半乳糖苷酶活性 7 U/g、β-1,4-甘露聚糖酶活性22 U/g及微量的其他酶)饲料转化率显著提高9%(P<0.05)。本试验发现,保育猪日粮中添加加α-半乳糖苷酶显著提高了日增重和饲料转化效率,这可能与添加α-半乳糖苷酶后食糜中的α-1,6-半乳糖苷的含量减少有关。Gdala等(1997)研究报道,保育猪日粮中添加α-半乳糖苷酶,食糜中α-1,6-半乳糖苷的含量均减少,干物质和能量消化率分别提高2.8%和2.3%。本试验结果表明,对于保育猪来说,每千克日粮中添加300 U的α-半乳糖苷酶对于水解22 g的α-半乳糖苷具有积极的正效果,可以显著提高平均日增重和饲料转化效率。
4 结论
α-Gal可有效降解棉子糖,玉米-豆粕基础日粮中添加300 U/kg的α-Gal可显著提高保育猪平均日增重,显著降低料重比。
[1]中华人民共和国农业部.NY/T 65-2004[S].中华人民共和国农业行业标准——猪饲养标准.北京:中国农业出版社,2004-09-01.
[2]Baucells F,Pérez J F,Morales J.Effect of α-galactosidase supplementation of cereal-soya-bean-pea diets on the productive performances,digestibility and lower gut fermentation in growing and finishing pigs[J].Br Soc Anim Sci,2000,71:157 ~ 164.
[3]Brouns S J J,Smits N,Wu H,et al.Identification of a novel α-galactosidase from the hypertgermophilic archaeon Sulfolobus solfataricus[J].J Bacteriol,2006,188:2392 ~ 2399.
[4]Gdala J,Jansman A J M,Buraczewska L,et al.The influence of α -galactosidase on the ileal digestibility of lupin seed carbohydrates and dietary protein in young pigs[J].Anim Feed Sci Technol,1997,67:115 ~ 125.
[5]Grieshop C M,Kadzere C T,Clapper G M,et al.Chemical and nutritional characteristics of United States soybeans and soybean meals[J].J Agric Food Chem,2003,51:7684 ~ 7691.
[6]Karr-Lilienthal L K,Kadzere C T,Grieshop C M,et al.Chemical and nutritional properties of soybean carbohydrates as related to nonruminants:a review[J].Livest Prod Sci,2005,97:1 ~ 12.
[7]Kim S W,Knabe D A,Hong K J.Use of carbohydrates in corn-soybean meal-based nursery diets[J].J Anim Sci,2003,81:2496 ~ 2504.
[8]Kuo T M,Van Middlesworth J F,Wolf W J.Content of raffinose oligosaccharides and sucrose in various plant seeds[J].J Agric Food Chem,1988,36:32 ~ 36.
[9]Kuriyama S,Mendel L B.The physiological behavior of raffinose[J].J Biol Chem,1917,31:125 ~ 147.
[10]Manzanares P,de Graaff L H,Visser J.Characterization of galactosidases from Aspergillus niger:Purification of a novel α -galactosidase activity[J].Enzyme Microb Technol,1998,22:383 ~ 390.
[11]Somiari R I,Balogh E.Properties of an extracellular glycosidase of Aspergillus niger suitable for removal of oligosaccharides from cowpea meal[J].Enzyme Microb Technol,1995,17:311 ~ 316.
[12]Veldman A,Veen W A G,Barug D,et al.Effect of α-galactosides and α-galactosidase in feed on ileal piglet digestive physiology[J].J Anim Physiol Anim Nutr,1993,69:57 ~ 65.

