兔海水浸泡脊髓损伤的病理变化观察
张迪,裴少保,王海峰,蒋传海,朱捷,吴成如,吴健,程迅生,方健
脊髓损伤(spinal cord injury,SCI)分为原发性损伤和继发性损伤[1]。原发损伤后继发的脊髓缺血﹑水肿﹑炎症﹑出血﹑中心性坏死等,特别是水肿和能量代谢障碍可引发一系列级联放大效应,使脊髓损伤进一步加重。海水具有低温﹑高渗﹑低碱性的特点,作为一种特殊的环境因素,研究海水浸泡后脊髓损伤的病理变化特点有一定的现实意义。为此本研究建立脊髓损伤海水浸泡模型,探讨海水浸泡对脊髓损伤后神经功能﹑病理学及细胞凋亡的影响,以期为海水浸泡脊髓损伤的早期救治提供理论依据。
1 材料与方法
1.1 人工海水制作 根据国家海洋局第三研究所提供的配方配制人工海水,主要指标如下:渗透浓度为1250±12mmol/L,pH值8.2,Na+浓度630.0±5.0mmol/L,Cl–浓度658.80±5.25mmol/L,K+浓度10.88±0.68mmol/L,温度为21±2℃。具体配方为:氯化钠26.518g/L﹑硫酸镁3.305g/L﹑氯化镁2.447g/L﹑氯化钙1.141g/L﹑氯化钾0.725g/L。
1.2 动物分组 健康大耳白兔96只,雌雄不限,体重2.5~3.0kg,购自安徽医科大学实验动物中心,采用随机数字表法随机分为4组:A组,即假手术组,仅切除椎板不损伤脊髓(n=6);B组,切除椎板并建立脊髓损伤模型,但不浸泡(n=30);C组,切除椎板并建立脊髓损伤模型,生理盐水浸泡60min(n=30);D组,切除椎板并建立脊髓损伤模型,海水浸泡60min(n=30)。除A组外,其他3组分别于处理后1﹑6﹑12﹑24﹑48h时间点随机选取6只动物进行取材观察。
1.3 脊髓损伤动物模型的制备 采用改良Allen's打击器制作兔脊髓损伤模型。动物以3mg/kg戊巴比妥钠静脉麻醉后俯卧位固定,颈背部备皮﹑碘附消毒。以第10胸椎(T10)为中心做后正中纵行切口,长约5cm,逐层切开,暴露T10段脊髓,在暴露的硬膜表面放置5mm×3mm大小的弧形垫片以保证打击均匀。将质量为20g的圆柱状金属棒从固定高度(5cm)自由落下制作脊髓打击模型,以术中见兔尾出现痉挛性摆动,双下肢及躯体回缩扑动作为打击成功的标准。脊髓损伤模型制作成功后仔细止血,C﹑D组兔不缝合切口,固定在平板上并直立浸泡于温度为21±2℃的生理盐水(C组)或人工海水(D组)中,水面与胸骨柄上缘平齐,浸泡时间为60min。
1.4 神经功能评分 在1﹑6﹑12﹑24﹑48h时间点,于A组中随机选取1只动物,B﹑C﹑D各组随机选取6只动物,采用Tarlov评分法进行脊髓损伤后神经功能评分[2]。0级:后肢无活动,不能负重;1级:后肢可见活动,但不能负重;2级:后肢活动频繁或有力,不能负重;3级:后肢可支持体重,能走1~2步;4级:可行走,仅有轻度障碍;5级:行走功能正常。
1.5 取材及标本制作 各组于相应的神经功能评分后麻醉动物,仰卧位固定,剪开胸腔,升主动脉插管,先用生理盐水灌注至无血液流出,再用浓度为4%的多聚甲醛2000ml灌注固定,然后从兔背部原手术切口进入,取脊髓损伤段及其上下部分(长约3cm),先肉眼观察大体病理形态,然后在距离打击区0.3cm处取材[3],4%多聚甲醛固定24h,洗涤﹑脱水﹑透明﹑浸蜡,石蜡包埋固定,切片机切片(厚5μm),取材的每个脊髓组织切片4张,烘干后4℃保存备用。
1.6 病理组织学观察 切片二甲苯脱蜡,梯度乙醇脱水,流水冲洗后行HE染色,光镜下观察。
1.7 免疫组织化学染色 采用免疫组化SABC法。Bcl-2和Bax免疫组化试剂盒均购自武汉博士德生物工程有限公司。操作方法:贴片脱蜡﹑抗原修复,3%H2O2去离子水消除内源性过氧化物酶活性,滴加封闭血清阻断非特异性抗原,添加一抗(Bcl-2,1:200稀释;Bax,1:150稀释)4℃过夜,然后分别滴加生物素标记的二抗工作液﹑辣根酶标记的链霉卵白素工作液,DAB显色,苏木素复染后脱水﹑透明﹑树脂封固,光镜下观察。400×视野下,每张切片选取3个典型Bcl-2和Bax阳性染色区域,计算机病理图像分析系统测定其吸光度(A)值,结果以平均值表示。
1.8 脊髓神经细胞凋亡检测 采用TUNEL法,试剂盒购自武汉博士德生物工程有限公司,具体操作按说明书进行,最后经DAB显色。细胞核被染成棕黄色为阳性细胞(凋亡细胞)。400×光镜下计数每张切片中脊髓左右前角和后角各1个视野(共4个视野)的阳性细胞数,并计算每张切片阳性细胞数的平均值。
1.9 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以±s表示,多组间比较采用方差分析,进一步两两比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结 果
2.1 动物一般情况 实验过程中,C组48h取材死亡动物1只,D组24h取材死亡1只,48h取材死亡2只,均及时予以补充。
2.2 神经功能评分 B﹑C﹑D组动物在造模后Tarlov评分均明显下降,1h时间点3组差异不明显,6h时间点D组明显高于B﹑C两组(P<0.05),但12﹑24﹑48h时间点D组明显低于B﹑C组(P<0.05)。B组和C组各时间点Tarlov评分无明显差异(P>0.05)。A组仅于造模后1h出现后肢运动功能障碍,其后各时间点神经功能均完好,评分为5分(表1)。
2.3 病理组织学变化 大体观察B﹑C组可见明显脊髓肿胀﹑充血;D组6h时间点肿胀较B﹑C组轻,12h时间点则明显加重;24﹑48h时间点各组脊髓肿胀﹑充血程度减轻。HE染色光镜下观察见A组脊髓组织结构完整,神经细胞形态正常,无出血现象。与A组比较,B组1h时间点神经细胞轻度水肿,细胞结构完整,未见破坏,白质基本正常;6h时间点脊髓组织结构开始出现破坏,神经细胞进一步肿胀,白质轻度水肿;12h各种情况进一步恶化,部分神经细胞出现浓染现象,整个胞体及胞膜皱缩,并有炎症细胞浸润;24﹑48h灰质中神经细胞减少,多数神经细胞出现胞质空泡及核固缩,白质出现轴突水肿﹑空泡变性。C组各时间点脊髓病理变化与B组类似。D组在1h时间点脊髓病理变化与B组类似,6h时间点脊髓组织肿胀较轻,出血较少,白质轴突水肿﹑空泡变性较轻,但12h后脊髓组织肿胀明显加重,出血增多,神经细胞胞质空泡化及核固缩现象加重,白质轴突水肿及空泡变性加重,48h灰质和白质中出现多量空泡,零星可见神经细胞(图1)。
表1 兔脊髓损伤后不同时间点各组Tarlov评分(±s,n=6)Tab. 1 Tarlov score at different time points in rabbits of each group after spinal cord injury (±s, n=6)
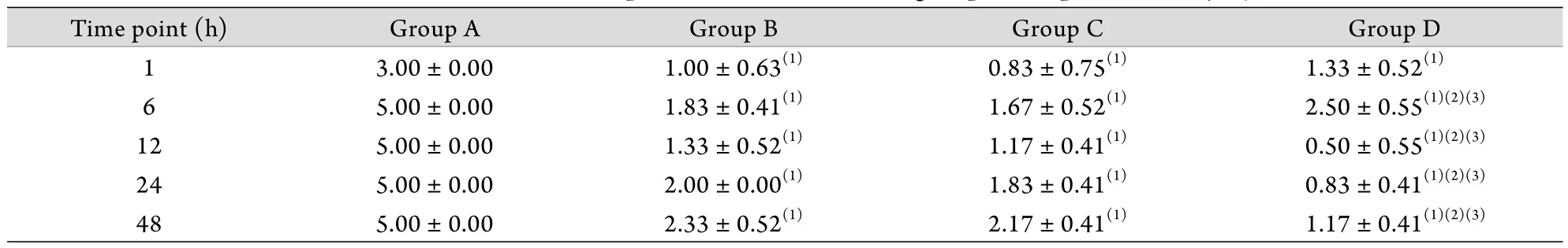
表1 兔脊髓损伤后不同时间点各组Tarlov评分(±s,n=6)Tab. 1 Tarlov score at different time points in rabbits of each group after spinal cord injury (±s, n=6)
(1)P<0.05 compared with group A; (2)P<0.05 compared with group B; (3)P<0.05 compared with group C
Time point (h) Group A Group B Group C Group D 1 3.00±0.00 1.00±0.63(1) 0.83±0.75(1) 1.33±0.52(1)5.00±0.00 1.83±0.41(1) 1.67±0.52(1) 2.50±0.55(1)(2)(3)12 5.00±0.00 1.33±0.52(1) 1.17±0.41(1) 0.50±0.55(1)(2)(3)24 5.00±0.00 2.00±0.00(1) 1.83±0.41(1) 0.83±0.41(1)(2)(3)48 5.00±0.00 2.33±0.52(1) 2.17±0.41(1) 1.17±0.41(1)(2)(3)6
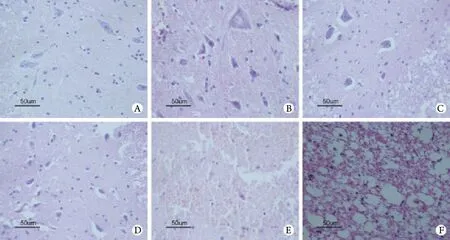
图1 海水浸泡后(D组)各时间点脊髓病理组织学变化(HE ×400)Fig. 1 Histopathological changes of spinal cord at each time point after seawater immersion (group D, HE ×400)
2.4 免疫组化染色结果 光镜下见脊髓灰质中Bcl-2表达阳性的多角细胞形态基本正常,而Bax表达阳性的多角细胞形态不一,细胞核固缩。A组脊髓灰质中的多角细胞各时间点形态正常,未见Bcl-2﹑Bax阳性表达。D组Bcl-2 A值在24h最高,之后下降,48h只见到零星阳性细胞,Bax A值于12h时间点达高峰,之后下降,48h只见到零星阳性细胞(图2)。B﹑C组Bax﹑Bcl-2 A值呈上升趋势,分别于12﹑24h时间点达高峰,但各时间点两组间比较差异无统计学意义(P>0.05)。在1h时间点3组Bcl-2﹑Bax A值差异无统计学意义(P>0.05)。D组Bax A值在6h低于B﹑C组,12﹑24﹑48h高于B﹑C组,而Bcl-2 A值在6﹑12﹑24﹑48h均低于B﹑C组,差异有统计学意义(P<0.05,表2)。
2.5 TUNEL染色结果 A组各时间点可见零星TUNEL阳性细胞。B﹑C﹑D组1h时间点TUNEL阳性细胞较为稀疏,此后阳性细胞明显增多,灰质和白质中均可见(图3)。由表3可见,3组TUNEL阳性细胞数均于12h达高峰,D组于12h达高峰后迅速下降,48h只有少量阳性细胞,B﹑C组阳性细胞数达高峰后下降幅度较低,至48h仍有较多阳性细胞。统计学分析显示,D组TUNEL阳性细胞数在6h时间点明显低于B﹑C组,在12h时间点明显增高,显著高于B﹑C组,此后迅速下降,在24﹑48h明显低于B﹑C组,差异有统计学意义(P<0.01)。B﹑C两组各时间点TUNEL阳性细胞数差异均无统计学意义(P>0.05)。
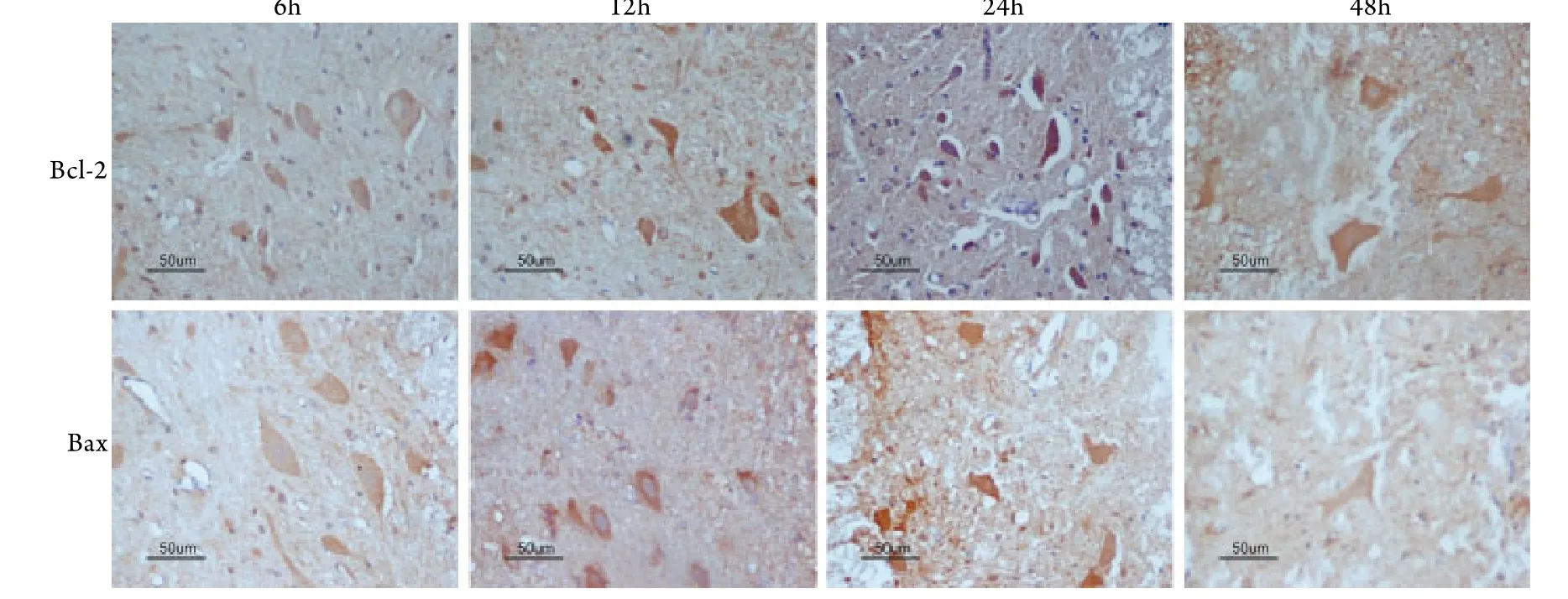
图2 海水浸泡后(D组)各时间点Bcl-2及Bax表达情况(免疫组化 ×400)Fig. 2 Bcl-2 and Bax expression at different time points after seawater immersion (group D) (Immunohistochemical ×400)
表2 各组脊髓损伤后不同时间点Bcl-2﹑Bax A值比较(±s,n=6)Tab. 2 Comparison of optical density value of Bcl-2 and Bax at different time points after spinal cord injury (±s, n=6)
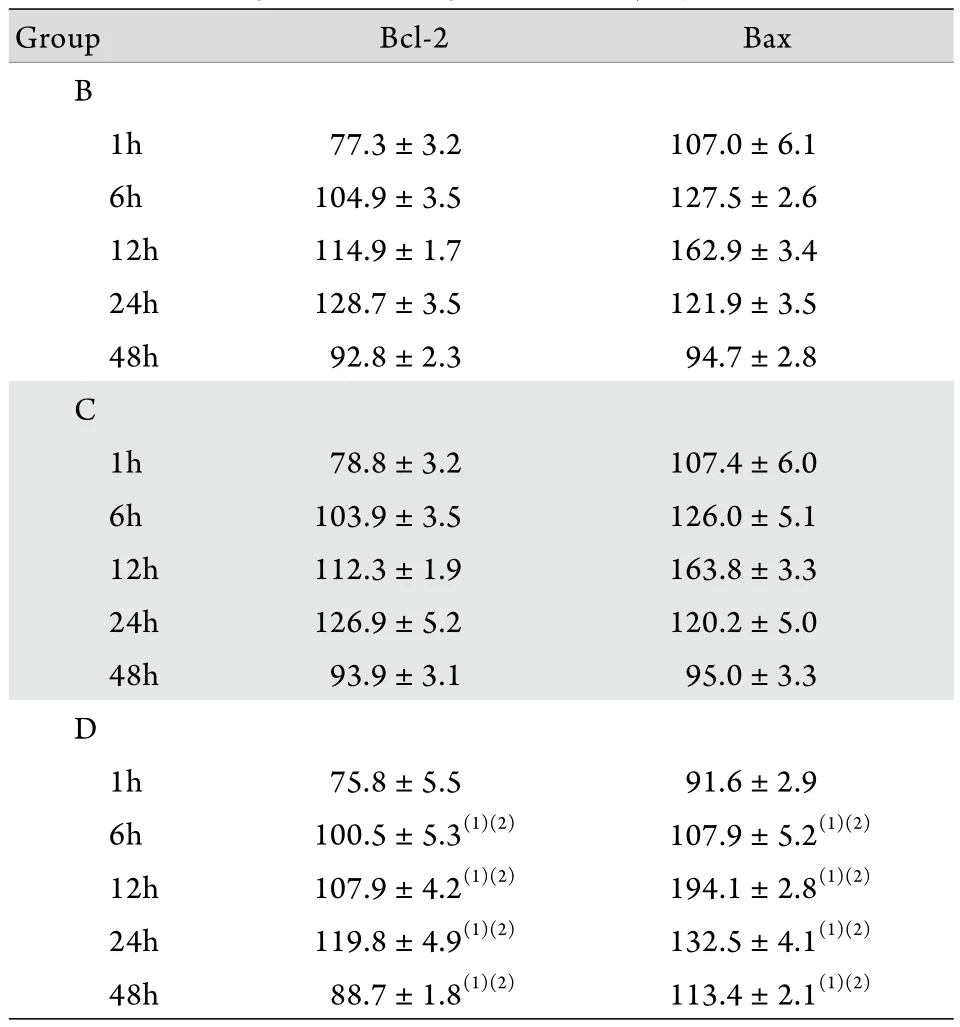
表2 各组脊髓损伤后不同时间点Bcl-2﹑Bax A值比较(±s,n=6)Tab. 2 Comparison of optical density value of Bcl-2 and Bax at different time points after spinal cord injury (±s, n=6)
(1)P<0.05 compared with group B; (2)P<0.05 compared with group C
Group Bcl-2 Bax B 1h 77.3±3.2 107.0±6.1 6h 104.9±3.5 127.5±2.6 12h 114.9±1.7 162.9±3.4 24h 128.7±3.5 121.9±3.5 48h 92.8±2.3 94.7±2.8 C 1h 78.8±3.2 107.4±6.0 6h 103.9±3.5 126.0±5.1 12h 112.3±1.9 163.8±3.3 24h 126.9±5.2 120.2±5.0 48h 93.9±3.1 95.0±3.3 D 1h 75.8±5.5 91.6±2.9 6h 100.5±5.3(1)(2) 107.9±5.2(1)(2)12h 107.9±4.2(1)(2) 194.1±2.8(1)(2)24h 119.8±4.9(1)(2) 132.5±4.1(1)(2)48h 88.7±1.8(1)(2) 113.4±2.1(1)(2)
表3 各组脊髓损伤后不同时间点TUNEL阳性细胞数比较(±s, n=6)Tab. 3 Comparison of the number of TUNEL positive cells in each group at different time points after spinal cord injury (±s,n=6)
表3 各组脊髓损伤后不同时间点TUNEL阳性细胞数比较(±s, n=6)Tab. 3 Comparison of the number of TUNEL positive cells in each group at different time points after spinal cord injury (±s,n=6)
(1)P<0.05 compared with group B; (2)P<0.05 compared with group C
Time point (h) Group B Group C Group D 1 4.7±1.6 4.7±1.2 2.3±1.2 6 14.2±1.2 13.5±1.4 8.2±1.2(1)(2)12 20.3±3.1 21.2±1.6 27.8±1.2(1)(2)24 19.5±2.1 18.7±2.7 15.8±1.2(1)(2)48 9.7±2.2 10.5±1.9 4.8±1.5(1)(2)
3 讨 论
脊髓损伤时除了初始物理打击造成的脊髓神经细胞直接死亡外,还包括损伤区及临近部位的继发损伤,主要表现为细胞凋亡,而细胞凋亡可在原发损伤的基础上进一步加重脊髓损害。本研究采用改良Allen's打击器制作脊髓损伤模型,使用人工海水模拟天然海水低温﹑高渗﹑低碱性的特点,制作海水浸泡脊髓损伤动物模型,并对模型动物进行神经功能评分。结果显示,除A组外,其余3组动物Tarlov评分均明显下降,D组仅于6h时间点评分高于B﹑C组,6h后评分明显恶化。HE染色显示海水浸泡早期(6h)D组脊髓神经细胞变性﹑水肿程度较B﹑C组轻,但12h后脊髓神经细胞肿胀﹑胞质空泡化及核固缩等现象明显加重,白质轴突水肿﹑空泡变性加重,脊髓组织破坏较B﹑C组更严重,这也解释了海水浸泡后模型动物不同时间点神经功能评分变化的规律。免疫组化染色显示,D组Bax表达量在12h前低于B﹑C组,12h后明显增加,显著高于B﹑C组,而Bcl-2的表达量始终呈上升趋势,但在各时间点均低于B﹑C组,表明海水浸泡对凋亡相关蛋白的表达具有一定影响,可促进Bax的表达,抑制Bcl-2表达。本研究通过TUNEL法检测发现各组均有阳性细胞,但D组海水浸泡早期(6h)脊髓阳性细胞数低于B﹑C组,至12h明显增多,显著高于B﹑C组,此后则迅速下降,24﹑48h阳性细胞数明显低于B﹑C组,这是由于24﹑48h脊髓中神经细胞大量消失,导致阳性细胞数量明显下降,这也进一步说明海水浸泡在原有创伤的基础上促进了神经细胞的凋亡。
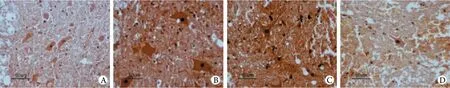
图3 海水浸泡后(D组)各时间点细胞凋亡情况(TUNEL ×400)Fig. 3 Cell apoptosis at different time points after seawater immersion (group D) (TUNEL ×400)
本研究结果提示海水浸泡可能延迟了脊髓神经细胞水肿﹑凋亡的发生,但最终却是进一步加重了神经细胞的水肿和凋亡,与相关报道相一致[4]。这种不同于身体其他组织如骨骼肌﹑肺等经海水浸泡后的病理变化特点[5],可能与海水的低温﹑高渗特性有关。海水浸泡早期低温减缓了细胞的能量代谢,延迟了酸中毒的发生,减轻了脊髓损伤后的病理损害程度[6],高渗状态则抑制水分向细胞内转移,减轻了神经细胞的水肿,但后期海水的高离子浓度加重了神经细胞内外的离子浓度紊乱,大量水分进入神经细胞,同时兴奋性氨基酸等有害神经递质大量释放[7],这些因素则加重了神经细胞的损害。
本实验仅模拟了自然海水的低温﹑高渗﹑低碱性等理化性质,对天然海水中含有大量的微生物因素未予考虑,故该结果虽可确定海水理化性质对脊髓神经细胞病理变化的影响,但尚不能完全展示自然海水浸泡后脊髓神经细胞病理变化的特点,此外,海水浸泡后脊髓神经细胞病理学改变的具体机制仍有待进一步研究探讨。
[1] Yang YP, Lin JK, Feng H. Study progress of pathophysiological changes in experimental spinal cord injury[J]. Southwest Mil Med J, 2006, (4): 69-72.[杨永平, 林江凯, 冯华. 实验性脊髓损伤病理生理变化研究进展[J]. 西南军医, 2006, (4): 69-72.]
[2] Rivlin AS, Tator CH.Objectiveclinical assessment of motor function after experimental spinal cord injury in rat[J]. J Neurosurg, 1977, 47(4): 577-581.
[3] Xu J, Kim GM, Ahmed SH, et al. Glucocorticoid receptormediated suppression of activator protein-1 activation and matric metalloproteinase expression after spinal cord injury[J]. J Neurosci, 2001, 21(1): 92-97.
[4] Nin YZ, Guo SZ, Wang Y. et al. Variation characteristics of skin soft tissue pathology with seawater immersion and wound repair with tissue grafting[J]. Chin J Clin Rehab, 2005, 9(10): 160-161, 284.[倪云志, 郭树忠, 王岩, 等. 海水浸泡创伤皮肤软组织病理变化特点及对组织移植修复伤口的研究[J]. 中国临床康复, 2005, 9(10): 160-161, 284.]
[5] Li Y, Duan YY, Hu XH, et al. Variation characteristics of dogs SP-A and SP-B in open chest injury with seawater immersion[J].Med J Chin PLA, 2010, 35(4): 459-462.[李毅, 段蕴铀, 胡晓红,等. 胸部开放伤海水浸泡ALI犬体内SP-A﹑B的变化[J]. 解放军医学杂志, 2010, 35(4): 459-462.]
[6] Yu YL, Ma TW, Ding GH, et al. Study on pathological and motor evoked after spinal cord injury in rabbits with transcutaneous local hypothermia therapy[J]. Chin J Clin Neurosci, 2004,12(1): 23-25.[余永林, 马天文, 丁光宏, 等. 经皮局部低温治疗兔脊髓损伤后病理与运动诱发电位的研究[J]. 中国临床神经科学, 2004, 12(1): 23-25.]
[7] Kimelberg HK. Current concepts of brain edema. Review of laboratory investigations[J]. J Neurosurg, 1995, 83(6): 1051-1059.

