体外上调淋巴细胞HO-1表达对CD4+CD25+Treg细胞分化的影响
陈瑞,张磊,宋少华,邹游,倪之嘉,郭闻渊
如何诱导宿主对移植物的免疫耐受一直是器官移植后的难题。最近研究表明,调节性T细胞(regulatory T cell,Treg)作为T细胞的一个亚类,在免疫耐受中发挥着重要作用,如果Treg细胞功能发生紊乱,就可能导致自身免疫性疾病和免疫排斥[1]。血红素加氧酶-1(heme oxygenases-1,HO-1)是血红素分解的限速酶,通过抗炎﹑抗凋亡﹑抗增殖等在多种疾病中发挥作用[2]。有研究表明HO-1在器官移植中是一种保护性基因,移植后可发挥免疫耐受作用[3],但机制尚不明确。本研究探讨了HO-1对淋巴细胞向CD4+CD25+Treg分化的影响及其可能机制。
1 材料与方法
1.1 实验动物及主要试剂 清洁级C57BL/6小鼠,6~8周龄,体重15~20g,购自上海斯莱克实验动物有限责任公司。HO-1诱导剂钴原卟啉(Copp)﹑HO-1抑制剂锌原卟啉(Znpp)﹑二甲基亚砜(DMSO)﹑刀豆素A(ConA)﹑聚蔗糖-泛影葡胺淋巴细胞分离液购于Sigma公司,RPMI 1640﹑胎牛血清购于Gibco公司,抗小鼠CD25-FITC和CD4-PE流式荧光抗体购于Ebioscience公司,ELISA试剂盒购于BD公司,Western blotting试剂盒购于碧云天公司,反转录试剂盒和实时荧光定量PCR试剂盒购于TaKaRa公司。
1.2 方法
1.2.1 小鼠脾脏淋巴细胞制备 无菌条件下取出C57BL/6小鼠脾脏,取70μm细胞滤网置于6cm培养皿中央,加入适量PBS溶液,将脾脏置于细胞滤网中,用2ml注射器针芯研磨,并以2ml或5ml注射器抽吸吹打成单细胞悬液,调整体积至6ml或8ml。取3ml或4ml分离液置于离心管中,将上述脾脏细胞悬液缓慢加于分离液上,形成清晰界面。细胞悬液与分层液的体积比以2:1~3:1为宜。将离心管置于水平离心机中,2000r/min﹑20℃离心20min,将加减速均调整为0。离心后从离心管底部到液面共分为4层,依次为红细胞和粒细胞层﹑分层液层﹑单个核细胞层﹑血浆层(含血小板和破碎细胞)。小心吸出界面处白膜层单个核细胞,置于另一离心管中,加入5倍量以上PBS液,充分混匀,1300r/min离心6min。弃上清,重复洗涤两遍,重悬于含10%胎牛血清的RPMI 1640培养液中,调整细胞密度为1×107/ml,37℃﹑5%CO2培养箱培养。
1.2.2 实时荧光定量PCR检测淋巴细胞HO-1和Foxp3 mRNA表达 收集离心重悬后细胞,按1×106/ml接种至6孔板,分为3组,即PBS组﹑Copp组和Znpp组,分别加入10μl PBS﹑Copp(50μmol/L)﹑Znpp(50μmol/L)处理12h,采用Trizol法提取细胞总mRNA,进行反转录和实时荧光定量PCR反应,引物由上海生工生物有限公司合成。使用QuantityOne软件进行定量分析,以GAPDH作为内参,计算HO-1和Foxp3的相对表达量。
1.2.3 Western blotting检测HO-1蛋白的表达 收集上述3组细胞,提取总蛋白。各取50μg总蛋白样品,行SDS-PAGE凝胶电泳(300mA,60min),将蛋白转至PVDF膜上,5%脱脂奶粉常温下封闭2h,加入HO-1一抗(1:1000)和内参β-tubulin抗体(1:3000)过夜,加入二抗(1:1000)室温孵育2h,ECL发光。采用QuantityOne软件行定量分析。
1.2.4 流式细胞仪检测CD4+/CD25+T细胞比例收集各组小鼠脾脏淋巴细胞,用ConA孵育48h,调整每管细胞数为2×105个;分别加入抗小鼠CD25+-FITC荧光抗体﹑抗小鼠CD4+-PE荧光抗体及相应同型对照;冰上孵育30min,加入2% FBS-PBS液洗涤去除未结合抗体,1300r/min离心6min,洗两次;将细胞重悬至200μl,采用BD LSRⅡ流式细胞仪检测。
1.2.5 Th1﹑Th2类细胞因子表达的ELISA检测 收集各组细胞上清,采用ELISA法检测Th1类细胞因子IL-2和IFN-γ﹑Th2类细胞因子IL-10和TGF-β的表达水平。操作严格按照说明书进行。
1.3 统计学处理 应用SAS 9.13软件进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 淋巴细胞HO-1 mRNA和蛋白表达情况 与PBS组比较,加入Copp诱导剂后,HO-1 mRNA和蛋白表达水平明显增加,而加入Znpp后,HO-1mRNA和蛋白表达水平明显降低(P<0.05,图1)。
2.2 流式细胞仪检测淋巴细胞向CD4+CD25+T细胞分化比例 与PBS组(3.5%)比较,Copp组向CD4+CD25+T细胞分化的比例(13.5%)明显增高(P<0.05),Znpp组(2.5%)则有所下降,差异均有统计学意义(P<0.05,图2)。
2.3 Foxp3 mRNA表达检测 由图3可见,与PBS组相比,Znpp组Foxp3 mRNA表达下降,Copp组Foxp3mRNA表达增加(P<0.05)。由于Foxp3是Treg的特异性标记[4],所以可以确定上述CD4+CD25+T细胞是CD4+CD25+Treg细胞,提示HO-1可以促进T淋巴细胞向CD4+CD25+Treg的分化。
2.4 Th1/Th2类细胞因子表达的ELISA检测结果与PBS组比较,Copp组Th1类细胞因子IL-2和IFN-γ表达水平明显降低(P<0.05),Th2类细胞因子IL-10和TGF-β表达水平明显升高(P<0.05)。与之相反,Znpp组的Th1类细胞因子表达水平明显上升,Th2类细胞因子表达水平明显降低(图4,P<0.05)。
3 讨 论
HO-1是血红素分解的限速酶,具有抗炎﹑抗凋亡﹑抗增殖等作用[5]。目前研究发现HO-1是一种保护性基因,在自身免疫性疾病﹑器官移植中有抑制免疫反应的作用,可减轻移植后的慢性排斥反应,延长移植物生存时间[3]。有研究表明,在肝移植术后,HO-1可以减轻缺血再灌注损伤及移植物的免疫排斥反应,但这种保护作用尤其是在免疫耐受方面的作用机制仍然不明确[6-7]。在炎症性疾病中HO-1可通过促进巨噬细胞高表达Th2类细胞因子IL-10来发挥抗炎作用[8],而IL-10是参与免疫耐受的重要的细胞因子。因此推测HO-1可能会通过调节Th1和Th2类细胞因子的平衡来发挥免疫耐受作用。
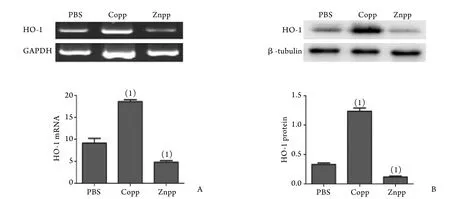
图1 HO-1 mRNA(A)和蛋白(B)表达情况Fig.1 HO-1 mRNA (A) and protein (B) expression
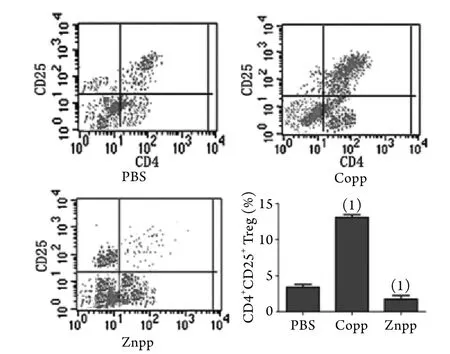
图2 各组细胞诱导分化为CD4+CD25+T细胞的比例Fig.2 The ratio of differentiated CD4+CD25+ T cells in each group
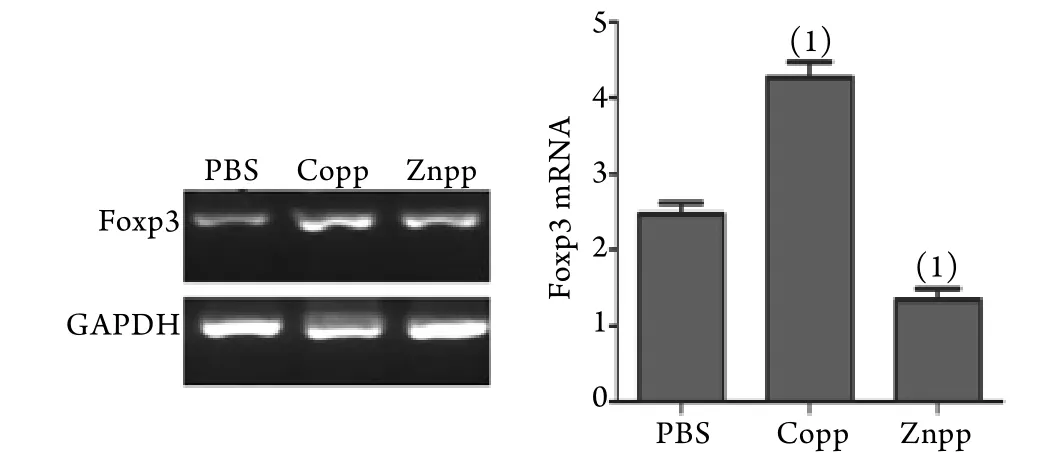
图3 各组细胞Foxp3 mRNA表达情况Fig.3 Foxp3 mRNA expression in each group
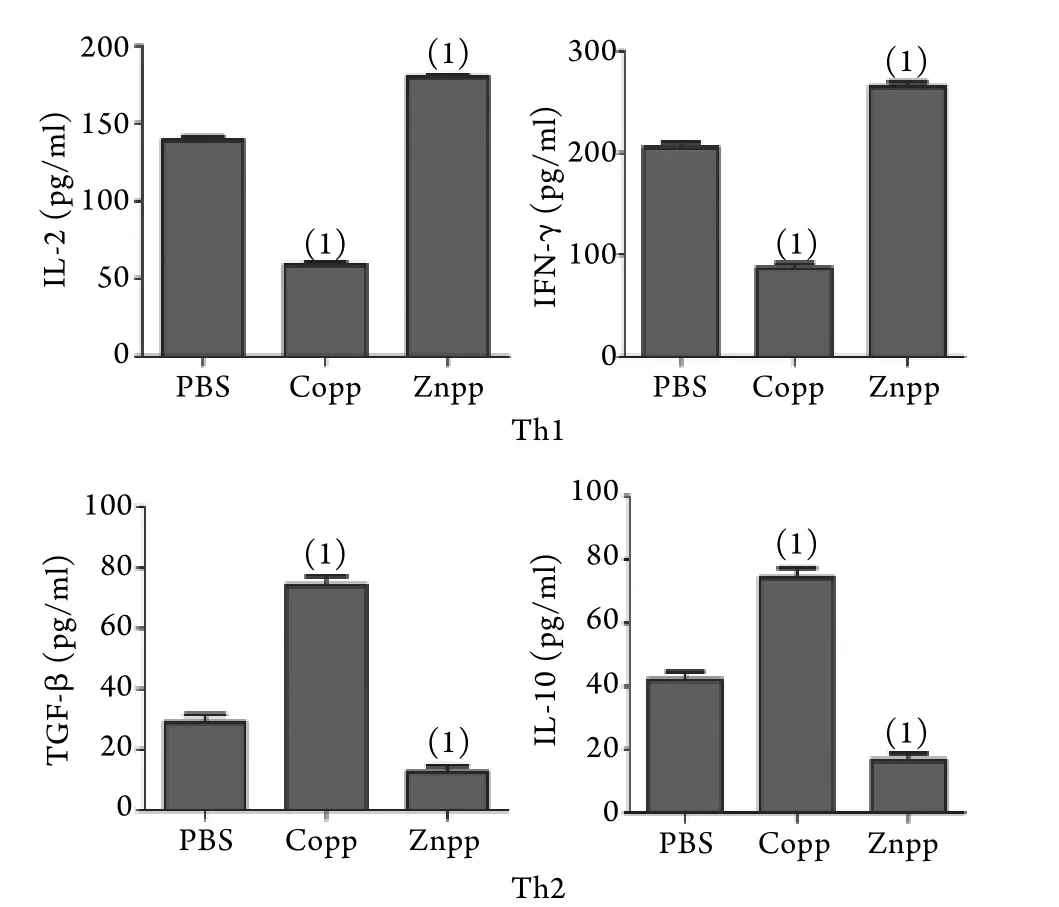
图4 细胞因子IL-2﹑IFN-γ﹑TGF-β﹑IL-10表达的ELISA检测结果Fig.4 Expression of IL-2, IFN-γ, TGF-β and IL-10 detected by ELISA
CD4+CD25+T细胞是CD4+T细胞的一个亚类,此细胞群高表达CD25+﹑CD4+和Foxp3。Foxp3是Treg分化和发挥功能的关键分子,被认为是Treg的特异性标记[9]。尽管Treg在T淋巴细胞中所占比例不大,但可抑制T细胞的自身免疫性反应,减轻由于后者引起的炎症性疾病,在免疫耐受中发挥着重要的作用[10-11]。研究显示,Treg可抑制细胞因子IL-2的表达,从而阻断免疫排斥反应的发生[12]。IL-10和TGF-β等抑炎细胞因子可诱导CD4+CD25+Treg的生成[13]。Th1和Th2细胞因子是两种参与不同免疫反应类型的细胞因子,Th1细胞因子IL-2和IFN-γ是促炎因子,可以促进免疫反应的发生,Th2类细胞因子IL-10和TGF-β是抑炎因子,主要在免疫耐受中起作用[14]。两种细胞因子互相平衡共同调节免疫反应,否则就会导致免疫功能的紊乱。自身免疫疾病和炎症反应使Th 1类细胞因子IL-2﹑IFN-γ表达增加,而Th2类细胞因子IL-10和TGF-β可以下调Th 1类细胞因子的表达[15-16]。
本研究结果显示,HO-1表达增加的细胞高表达Th2细胞因子,而低表达Th1类细胞因子,从而诱导小鼠脾脏淋巴细胞高表达Foxp3并向CD4+CD25+Treg分化,提示在器官移植中HO-1可能通过调节Th1/Th2的平衡诱导CD4+CD25+Treg的分化,从而发挥免疫耐受作用。
[1] De Boer OJ, van der Loos CM, Teeling P, et al. Immunohistochemical analysis of regulatory T cell markers FOXP3 and GITR on CD4+CD25+T cells in normal skin and inflammatory dermatoses[J]. J Histochem Cytochem, 2007, 55(9): 891-898.
[2] Yue LH, Zhao YL, Chen J, et al. Effect of fusion protein TAT and heme oxygenase-1 on liver sinusoidal endothelial cells apoptosis during preservation injury[J]. Chin Med J (Engl), 2010, 123(1):68-73.
[3] Wang CF, Wang ZY, Li JY. Dual protective role of HO-1 in transplanted liver grafts: A review of experimental and clinical studies[J]. World J Gastroenterol, 2011, 17(26): 3101-3108.
[4] Viguier M, Lemaitre F, Verola O, et al. Foxp3 expressing CD4+CD25 (high) regulatory T cells are overrepresented in human metastatic melanoma lymph nodes and inhibit the function of infiltrating T cells[J]. J Immunol, 2004, 173(2):1444-1453.
[5] Mai HX, Chen LJ, Chen B, et al. Kidney injury and heme oxygenase-1[J]. Med J Chin PLA, 2012, 37(2): 156-159. [麦海星, 陈立军, 陈彪, 等. 血红素加氧酶-1 与肾脏损伤[J]. 解放军医学杂志, 2012, 37(2): 156-159.]
[6] Wang CF, Wang ZY, Tao SF, et al. Preconditioning donor liver with Nodosin perfusion lessens rat ischemia reperfusion injury via heme oxygenase-1 upregulation[J]. J Gastroenterol Hepatol,2012, 27(4): 832-840.
[7] Yamashita K, Ollinger R, McDaid J, et al. Heme oxygenase-1 is essential for and promotes tolerance to transplanted organs[J].FASEB J, 2006, 20(6): 776-778.
[8] Deshane J, Wright M, Agarwal A. Heme oxygenase-1 expression in disease states[J]. Acta Biochim Pol, 2005, 52(2): 273-284.
[9] Liu Z, Fan H, Jiang S. CD4(+)T-cell subsets in transplantation[J].Immunol Rev, 2013, 252(1): 183-191.
[10] Liu J, Yang F, Zhang Y, et al. Studies on the cell-immunosuppressive mechanism of oridonin from Isodon Serra[J]. Int Immunopharmacol, 2007, 7(7): 945-954.
[11] Gong GM, Qin J, Xuan XY, et al. Effect of CD4+CD25+regulatory T cells of Rhesus macaques on proliferations of Vγ2Vδ2 T cells in vitro[J]. J Zhengzhou Univ (Med Sci), 2011, 46(4): 529-532.[龚光明, 秦洁, 轩小燕, 等. 中国猕猴CD4+CD25+调节性T细胞对Vγ2Vδ2 T 细胞体外增殖的影响[J]. 郑州大学学报(医学版), 2011, 46(4): 529-532.]
[12] Fu W, Zhu J, Qiu Y, et al. Induction of CD4(+)CD25(+) T cells and control of cardiac allograft rejection by CD40/CD40L costimulatory pathway blockade in mice[J]. Transplant Proc,2013, 45(2): 611-617.
[13] Iwasaki Y, Fujio K, Okamura T, et al. Toward therapeutic application of IL-10-producing regulatory T cells[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2013, 36(1): 40-46.
[14] Ma JJ, Lu N, Chen BL. Regulatory effect of transcription factors RORγt on the Th17/Treg balances in pregnant asthma mice[J].Med J Chin PLA, 2012, 37(6): 561-568. [马佳佳, Nick Lu, 陈必良. 转录因子RORγt对妊娠期哮喘模型小鼠Th17/Treg 平衡的调节作用[J]. 解放军医学杂志, 2012, 37(6): 561-568.]
[15] Kidd P. Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease[J]. Altern Med Rev, 2003,8(3): 223-246.
[16] Shi J, Lv J, Wu H. Th1/Th2 cytokines and its clinical significance in obstructive sleep apnea hypopnea syndrome children without allergic rhinitis and asthma[J]. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2012, 26(23): 1073-1076.

