3种小鼠肝纤维化模型的比较及凯时注射液的抗肝纤维化作用评价
金明姬,黄伟,陈卫,高钟镐
肝纤维化是威胁人类健康的常见病变,是各种慢性肝病最重要的病理特征,能够引发肝硬化,也是诱发原发性肝癌的危险因素之一[1]。肝纤维化可导致正常肝组织的结构及功能改变[2-3],其中25%~40%的患者可能发展为肝硬化乃至肝癌。选择适当的肝纤维化动物模型是深入研究肝纤维化发病机制的重要基础,也是筛选防治肝纤维化药物的有效手段。凯时注射液是一种用脂微球包裹前列腺素E1(prostaglandin E1,PGE1)的新型载体制剂,在临床上主要用于治疗慢性动脉闭塞症引起的四肢溃疡及四肢静息疼痛,并能改善心脑血管微循环障碍,因此也用于脏器移植术后抗栓治疗和小儿先天性心脏病动脉导管未闭等。笔者推测,凯时注射液很可能对肝纤维化具有一定治疗作用,而新型微球制剂可能使其发挥更好的效果。因此,本研究首先选用3种不同药物二甲基亚硝胺(DMN)﹑硫代乙酰胺(TAA)和四氯化碳(carbon tetrachloride,CCl4)[4]建立肝纤维化模型,比较筛选出一种最佳模型,再使用该模型评价凯时注射液的抗肝纤维化作用,为凯时注射液对肝纤维化疾病的治疗提供理论依据。
1 材料与方法
1.1 材料与仪器 DMN﹑TAA和CCl4购自Sigma公司,市售橄榄油,丙氨酸转氨酶(ALT)﹑天门冬氨酸转氨酶(AST)及透明质酸(HA)检测试剂盒购自南京建成科技有限公司,凯时注射液购自北京泰德制药有限公司,其他试剂均为分析纯。AL204型电子天平购自METTLER TOLEDO公司;高速离心机购自Thermo公司;倒置显微镜购自日本Olympus公司;酶标仪购自澳大利亚TECAN公司;TU1900紫外分光光度计购自上海棱谱仪器有限公司。
1.2 动物模型建立与分组 BALB/c小鼠40只,由北京维通利华实验动物技术有限公司提供,雌雄各半,体重15g左右,随机分为4组,分别为空白对照组﹑DMN组﹑TAA组﹑CCl4组。DMN和TAA用生理盐水配制,给药剂量分别为10μl/kg和200mg/kg;CCl4用橄榄油稀释4倍,给药剂量为0.1ml/kg;空白对照组注射生理盐水,剂量为15ml/kg。各组小鼠均采用腹腔注射给药,次数为3次/周,连续给药5周后观察腹腔腹水情况及小鼠生存情况。
1.3 肝组织病理学检查 各组小鼠连续给药5周后眼眶取血,脱臼处死,采集肝脏组织,迅速用10%中性甲醛固定,脱水,石蜡包埋,切片。对肝脏组织切片进行HE及Masson常规染色,光镜下观察组织病理形态及结构变化。根据肝损伤程度﹑肝组织纤维化程度和肝胆管上皮细胞增生程度对各组进行计分﹑比较。其中纤维化程度评判标准如下[5]:“-”无成纤维细胞增生,计0分;“+”汇管区扩大,有少量成纤维细胞增生,计1分;“汇管区成纤维细胞增生”汇管区成纤维细胞增生并向小叶内延伸,呈较窄较短的纤维素条,计2分;“”汇管区成纤维细胞大量增生并向小叶内明显延伸,形成纤维隔伴有小叶结构紊乱,计3分。最后以肉眼观察到肝纤维化形成及镜下纤维组织增生形成作为肝纤维化模型诱导成功的标志[6]。
1.4 血清ALT﹑AST及HA含量的测定 各组小鼠给药5周后眼眶取血,血液加入含0.38%枸橼酸钠的试管中,离心取上清,按照各项检测指标试剂盒中的规定测定血清中ALT﹑AST及HA的含量。
1.5 用凯时注射液治疗DMN诱导的肝纤维化模型小鼠 30只BALB/c小鼠,雌雄各半,体重15g左右,随机分均为3组,分别为空白对照组﹑模型组﹑治疗组。首先建立病理模型,空白对照组腹腔注射生理盐水15ml/kg,模型组和治疗组分别腹腔注射DMN 10μl/kg,3次/周,连续给药5周后,空白对照组和模型组分别静脉注射生理盐水,治疗组静脉注射凯时注射液,6ml/(kg.d)。连续给药20d后,按照1.3和1.4的方法进行疗效评价。
1.6 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以±s表示,组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结 果
2.1 一般生长情况 实验期间各实验组小鼠均出现活动减少﹑精神萎靡﹑对外界刺激反应迟钝的现象,其中DMN组小鼠死亡2只,TAA组小鼠死亡1只,其他两组均未发生死亡。各组小鼠体重变化及死亡情况见表1。
表1 各组小鼠体重变化及死亡情况(±s, n=10)Tab.1 The body weight and death of experimental mice(±s, n=10)
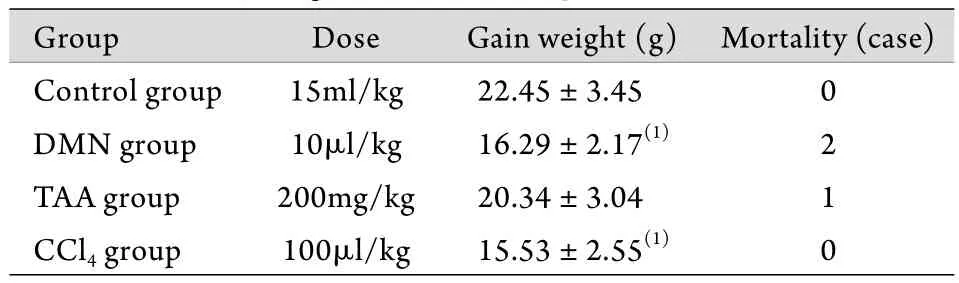
表1 各组小鼠体重变化及死亡情况(±s, n=10)Tab.1 The body weight and death of experimental mice(±s, n=10)
(1)P<0.05 compared with control group
Group Dose Gain weight (g) Mortality (case)Control group 15ml/kg 22.45±3.45 0 DMN group 10μl/kg 16.29±2.17(1) 2 TAA group 200mg/kg 20.34±3.04 1 CCl4 group 100μl/kg 15.53±2.55(1) 0
2.2 肝组织病理学检查 空白对照组HE染色后见肝小叶肝细胞索呈放射状排列,肝细胞无变性坏死,肝窦未见明显异常,Masson染色示肝脏门脉区和肝窦网状纤维呈浅绿色,肝组织间未见明显纤维增生。DMN组HE染色见肝组织形成假小叶,周围出血,纤维组织增生并出现炎性浸润,Masson染色同样见肝组织内假小叶形成,纤维组织明显增生形成包膜,肝细胞索纤维分割,周围广泛出血。TAA组HE染色见肝小叶肝细胞索呈放射状排列,肝细胞无变性坏死,未见明显纤维增生和纤维化,Masson染色见肝小叶中央静脉网状纤维着色浅绿,肝组织间未见明显纤维增生。CCl4组HE染色见个别肝细胞有变性和坏死,其他未见异常,Masson染色见轻度肝窦网状纤维肿胀,轻度纤维组织增生。以上结果表明DMN诱导的小鼠最具备典型的肝纤维化表现,模型建立成功,其他两组的肝纤维化特征并不是很明显,与DMN组相比,具有一定的差异(图1)。
2.3 各组小鼠肝纤维化程度比较 按照肝纤维化分级方法对4个组进行了评分﹑比较,DMN诱导的小鼠形成典型的肝纤维化模型,其他两组的增生﹑变性﹑坏死及细胞组织的特征性变化不明显。与空白对照组相比,3个实验组均出现显著肝纤维化(P<0.05);与TAA组和CCl4组相比,DMN组的纤维化程度更为明显(P<0.05,表2﹑3)。
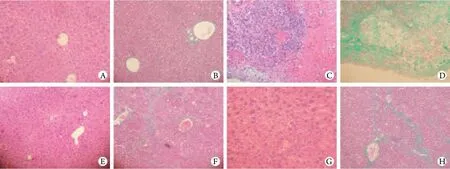
图1 各组小鼠肝组织病理学变化(×100)Fig.1 Histopathological changes of the mouse liver tissue of the different groups (×100)
2.4 各组小鼠血清ALT﹑AST及HA含量测定结果与空白对照组相比,3个实验组的血清ALT﹑AST及HA含量均有明显上升(P<0.05);而与TAA组和CCl4组相比,DMN组的ALT﹑AST及HA含量上升更为明显(P<0.05);TAA组和CCl4组之间比较差异无统计学意义(表4)。
2.5 凯时注射液治疗DMN诱导小鼠肝纤维化模型的结果 在实验过程中,模型组和治疗组各有1只动物死亡,肝组织病理学检查结果显示治疗组肝细胞变性﹑坏死﹑出血和纤维化程度明显轻于DMN模型组(图2)。与模型组比较,治疗组肝损伤﹑肝组织纤维化和肝胆管上皮细胞增生均有明显减轻(P<0.05,表5)。各组小鼠血清ALT﹑AST及HA含量,与空白对照组相比,模型组和治疗组血清ALT﹑AST及HA含量均明显上升(P<0.001);与模型组相比,治疗组ALT﹑AST及HA含量有所下降,差异有统计学意义(P<0.05,表6)。

表2 各组肝脏组织病理学病变发生情况(n=10)Tab.2 The liver histopathologic lesions of each group (n=10)
表3 各组肝损伤﹑肝组织纤维化和肝胆管上皮细胞增生计分情况(±s, n=10)Tab. 3 Scores of liver injury, fibrosis and hepatic duct epithelial hyperplasia (±s, n=10)
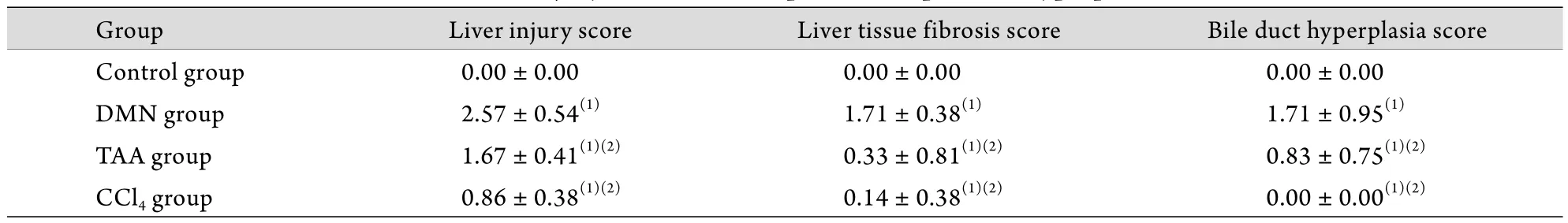
表3 各组肝损伤﹑肝组织纤维化和肝胆管上皮细胞增生计分情况(±s, n=10)Tab. 3 Scores of liver injury, fibrosis and hepatic duct epithelial hyperplasia (±s, n=10)
(1)P<0.05 compared with control group; (2)P<0.05 compared with DMN group
Group Liver injury score Liver tissue fibrosis score Bile duct hyperplasia score Control group 0.00±0.00 0.00±0.00 0.00±0.00 DMN group 2.57±0.54(1) 1.71±0.38(1) 1.71±0.95(1)TAA group 1.67±0.41(1)(2) 0.33±0.81(1)(2) 0.83±0.75(1)(2)CCl4 group 0.86±0.38(1)(2) 0.14±0.38(1)(2) 0.00±0.00(1)(2)
3 讨 论
肝纤维化动物模型是深入研究肝纤维化发病机制的重要基础,同样,进行药物抗肝纤维化的研究也必须建立合适的动物模型。理想的肝纤维化动物模型应符合
如下条件[7]:①与人类肝纤维化疾病的基本病变特征相似;②病变有一定发展过程,病程发展存在一个可逆与不可逆的阶段性演进过程;③形成率高,病死率低,重复性好;④方法简便易行;⑤动物易获得,经济实用。目前常用的各种造模方法各有优缺点,可以根据不同实验目的选择合适的造模方式。本研究分别采用3种药物建立不同的小鼠肝纤维化模型,并通过一系列评价指标进行最优模型的筛选。DMN具有肝毒性﹑基因毒性和免疫毒性,其活性代谢产物使核酸﹑蛋白质等重要的生命物质发生甲基化,进而导致肝细胞坏死,并可使细胞外基质进行性增多[8-9]。CCl4是一种经典的诱发肝纤维化的选择性肝毒性药物[10],可引起肝细胞脂质过氧化增强,从而损伤肝细胞[11-12]。本实验中,与CCl4模型相比,DMN模型中肝细胞无脂肪变性,肝纤维化形成相对稳定,模型成功率高,纤维化程度比较接近临床患者的实际情况。CCl4的肝纤维化模型在中断药物后有一定的自愈倾向,而DMN模型在中断药物后数月内还能保持较稳定的进展[13-14]。TAA与DMN的作用机制相似,都是通过影响蛋白质合成及肝细胞中酶的代谢诱导肝损伤[15],中断给药后肝纤维化仍能保持一定的时间。从本实验的结果中可以看出,TAA及CCl4诱导小鼠肝纤维化的成功率并不是很高,虽然跟正常对照组相比过半小鼠出现了肝纤维化,但是与DMN相比肝纤维化模型形成程度没有达到规定的要求,其成功率也较低。TAA组和CCl4组的小鼠肝损伤模型制备诱发病变程度较轻,多数动物未出现肝损伤病变和肝纤维化,未达到制备肝损伤和肝纤维化模型的预期结果。DMN诱导的小鼠肝纤维化模型中形成的肝纤维化,与临床病理特征相似,并且病理切片结果也很好地证明了其肝纤维化特征。但DMN组也存在一定的缺点,该组死亡率比其他组略高,可能与DMN毒性较大有关[14],因此在实验中用DMN制备动物模型时一定要控制好给药剂量,时刻观察动物的状态,以降低死亡率。
表4 各组小鼠血清ALT﹑AST及HA含量的变化(±s, n=10)Tab. 4 Serous levels of ALT, AST and HA (±s, n=10)

表4 各组小鼠血清ALT﹑AST及HA含量的变化(±s, n=10)Tab. 4 Serous levels of ALT, AST and HA (±s, n=10)
(1)P<0.05 compared with control group; (2)P<0.05 compared with DMN group
Group ALT(U/L) AST(U/L) HA(μg/L)Control group 29.8±6.5 38.4±8.9 189.2±20.8 DMN group 417.3±37.0(1) 402.3±53.0(1) 310.6±33.7(1)TAA group 265.8±30.6(1)(2) 289.1±40.4(1)(2) 208.5±32.4(1)(2)CCl4 group 272.1±26.4(1)(2) 252.8±48.2(1)(2) 225.8±40.5(1)(2)
表5 凯时注射液对DMN诱导肝纤维化模型小鼠肝损伤﹑肝组织纤维化和肝胆管上皮细胞增生的影响(±s, n=10)Tab. 5 Effects of Kaishi on liver injury, fibrosis and hepatic duct epithelial hyperplasia of mice (±s, n=10)
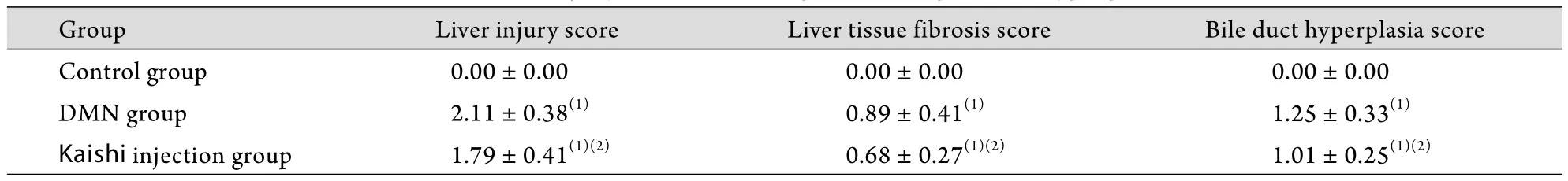
表5 凯时注射液对DMN诱导肝纤维化模型小鼠肝损伤﹑肝组织纤维化和肝胆管上皮细胞增生的影响(±s, n=10)Tab. 5 Effects of Kaishi on liver injury, fibrosis and hepatic duct epithelial hyperplasia of mice (±s, n=10)
(1)P<0.001 compared with control group; (2)P<0.05 compared with DMN group
Group Liver injury score Liver tissue fibrosis score Bile duct hyperplasia score Control group 0.00±0.00 0.00±0.00 0.00±0.00 DMN group 2.11±0.38(1) 0.89±0.41(1) 1.25±0.33(1)Kaishi injection group 1.79±0.41(1)(2) 0.68±0.27(1)(2) 1.01±0.25(1)(2)
表6 凯时注射液对DMN诱导肝纤维化模型小鼠血清ALT﹑AST及HA含量的影响(±s, n=10)Tab. 6 Effects of Kaishi on ALT, AST and HA in DMN induced mice liver fibrosis (±s, n=10)

表6 凯时注射液对DMN诱导肝纤维化模型小鼠血清ALT﹑AST及HA含量的影响(±s, n=10)Tab. 6 Effects of Kaishi on ALT, AST and HA in DMN induced mice liver fibrosis (±s, n=10)
(1)P<0.001 compared with control group; (2)P<0.05 compared with DMN group
Group ALT(U/L) AST(U/L) HA(μg/L)Control group 19.15±3.84 28.34±5.26 86.58±15.24 DMN group 256.24±41.08(1) 295.14±33.25(1) 243.52±25.24(1)Kaishi injection group 189.92±25.44(1)(2) 251.64±22.59(1)(2) 210.15±25.20(1)(2)
PGE1作用于血管PGE1受体,能够扩张血管,增加门静脉血流量,并且能够调节前列环素与血栓素A的平衡,改善肝脏微循环,从而增加肝组织供氧量,消除肝细胞代谢产物[16]。凯时注射液是PGE1包裹在脂微球中的一种新型载体制剂[17],不易在肺内失活,体内作用持续时间长,且脂微球极易集聚在炎症病灶和病变血管处,有靶向作用,因此仅用原PGE1制剂的1/5~1/10的量即可取得相同疗效且副作用小,多用于肝炎及肝纤维化的治疗[18-19]。目前认为,凯时注射液用于肝疾病的治疗,可能通过改善肝脏微循环﹑减少血小板衍生生长因子等细胞因子及内毒素水平等,减轻肝脏炎症,促进肝细胞再生及肝功能的恢复,并减少肝脏星状细胞的活化,减少细胞外基质的沉积,从而起到抗肝纤维化作用[20]。肝损伤﹑肝纤维化后,血清中多种酶如ALT﹑AST和相应物质含量发生改变且与肝损伤﹑肝纤维化的程度呈正相关,可作为辅助诊断指标。HA主要被肝内皮细胞分解摄取,当肝内皮细胞严重损害时,HA因摄取不足而显著升高。HA的增高也表明肝星状细胞较活跃,细胞外基质合成增多,这些都是肝纤维化形成的标志。本研究结果显示,凯时注射液治疗后肝组织纤维化程度﹑肝损伤以及血清中ALT﹑AST﹑HA含量均有所下降(P<0.05)。肝组织病理结果显示,凯时注射液可减轻肝脏的炎症反应,抑制肝胆管上皮细胞的增生,进一步证实凯时注射液具有抗炎﹑抗肝纤维化的作用。但是,凯时注射液改善炎症反应和纤维化程度,以及降低血清中ALT﹑AST﹑HA含量的机制尚未完全阐明,可能与改善肝脏微循环,减轻炎症反应,抑制血小板产生和聚集,减少炎症因子对肝星状细胞的刺激,减少肝内弥漫性细胞外基质的产生等有关[17]。
本研究结果表明,不同类型药物诱导的肝纤维化程度及标准不同,应该根据实验目的选择合适的动物模型。凯时注射液具有改善肝炎及肝纤维化的功效,并能降低血清中ALT﹑AST及HA的含量,这将为凯时注射液和PGE1用于肝炎和肝纤维化的治疗提供重要的参考依据。
[1] Chen YQ, Mao DW. Research progress of liver fibrosis animal model preparation[J]. J Clin Hepatol, 2007, 10(3): 205-207. [陈月桥, 毛德文. 肝纤维化动物模型制备的研究进展[J]. 实用肝脏病杂志, 2007, 10(3): 205-207.]
[2] Schenker S, Maddrey WC. Subliminal drug-drug interactions:users and their physicians take notice[J]. Hepatology, 1991,13(5): 995-998.
[3] Frezza EE, Gerunda GE, Farinati F, et al. CCl4-induced liver cirrhosis and hepatocellular carcinoma in rats:relationship to plasma zinc, copper and estradiol levels[J].Hepatogastroenterology, 1994, 41(4): 367-369.
[4]
He H, Hua HY, Ge SW, et al. Effects of Curcumin on carbon tetrachloride induced liver fibrosis in rates[J]. J Zhengzhou Univ(Med Sci), 2009, 43(5): 986-990.[何航, 华海婴, 戈士文, 等.姜黄素对四氯化碳诱导大鼠肝纤维化的影响[J]. 郑州大学学报(医学版), 2009, 43(5): 986-990.]
[5] Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment[J]. J Hepathol, 1991, 13(3):372-374.
[6] Ma YZ, Han JT, Chen W, et al. The new design of liver fibrosis model by subcutaneous injection of carbon tetrachloride[J].Sichuan J Zool, 2007, 26(3):697-698. [马玉珍, 韩景田, 陈炜,等. 四氯化碳皮下注射制备肝纤维化模型的新设计[J]. 四川动物, 2007, 26(3): 697-698.]
[7] Zhang S, Gu WL, Huang D, et al. Comparison of rat models of hepatic fibrosisinduced by carbon tetrachloride, thioacetamide and porcine serum[J]. Chin J Gen Surg, 2012, 21(1): 71-76. [张帅, 古维立, 黄迪, 等. 四氯化碳﹑硫代乙酰胺和猪血清诱导大鼠肝纤维化模型的比较[J]. 中国普通外科杂志, 2012,21(1): 71-76. ]
[8] Li SC, Li T. Principle and application of making different animal models of liver fibrosis[J]. Study J Tradit Chin Med, 2006,24(12): 2267-2269. [李生财, 李彤. 肝纤维化动物模型的造模原理及应用[J]. 中医药学刊, 2006, 24(12): 2267-2268.]
[9] Sugiyama M, Ichida T, Sato T, et al. Expression of activin A is increased in cirrhotic and fibrotic rat livers[J]. Gastroenterology,1998, 114(3): 550-558.
[10] Li J, Cao ZH. Oxidation stress effects of carbon monoxide on rats'hepatic fibrosis induced by carbon tetrachloride[J]. Med J Chin PLA, 2006, 31(3): 234-236.[李隽, 曹治宸. NO在CCl4致大鼠肝纤维化中的氧化应激作用[J]. 解放军医学杂志,2011, 36(7): 234-236.]
[11] Jaeger HJ, Kruegener GH, Donovan AG. Patellar metastasis from a malignant melanoma[J]. Int Orthop, 1992, 16(3): 282-284.
[12] Zhao ZJ, Zhang XX. Review of research on hepatic fibrosis animal model experiment[J]. Chin J Integr Tradit West Med Digest, 2007, 15(3): 201-203. [赵宗江, 张新雪. 实验性肝纤维化动物模型研究述评[J]. 中国中西医结合消化杂志, 2007,15(3): 201-203.]
[13] Bao JF, Huang JS, Zhang YS, et al. Research thought of study on sickness-syndrome combination hepatic fibrosis models[J].Chin Arch Tradit Chin Med, 2012, 30(4): 830-832. [包剑锋, 黄劲松, 张永生, 等. 肝纤维化病证结合模型的研究思路[J]. 中华中医药学刊, 2012, 30(4): 830-832.]
[14] Guo LM, Lin M, Lu S, et al. Pathological changes of hepatic stellate cells in ratliver fibrosis induced by one high-dose injection of dimethylnitrosamine[J]. J Clin Hepatol, 2009,12(4):244-247. [郭丽梅, 林梅, 陆珊, 等. 一次性大剂量二甲基亚硝胺致大鼠肝纤维化模型中肝星状细胞的病理变化[J]. 实用肝脏病杂志, 2009, 12(4): 244-247.]
[15] Huang D, Gu WL, Hu ZW, et al. Detection of the hepatic fibrosis rat model of liver fibrosis[J]. Guangzhou Med J, 2012, 43(5):56-60. [黄迪, 古维立, 胡志文, 等. 大鼠肝纤维化模型建立及肝纤维化的检测[J]. 广州医药, 2012, 43(5): 56-60.]
[16] Ma M, Hu NN, Li DK. To observe the clinical effect of prostaglandin E1injection in the treatment of severe hepatitis[J].Chin J Biochem Pharm, 1999, 20(6):311-312. [马明, 胡宁娜,李定坤. 前列腺素E1注射液治疗重症肝炎的临床疗效观察[J]. 中国生化药物杂志, 1999, 20(6): 311-312.].
[17] Zhang M, Xiang Y, Jin B, et al. Efficacy of prostaglandin E1lipid drug-loaded microcapsules for cirrhosis complicated with seroperitoneum[J]. Chin J Pract Intern Med, 2009, 29(S1): 40-42.[张敏, 向轶, 金波, 等. 前列腺素E1脂微球载体制剂治疗肝硬化腹腔积液疗效观察[J]. 中国实用内科杂志, 2009,29(S1): 40-42.]
[18] Zou WL, Yang Z, Zang YJ, et al. Inhibitory effects of prostaglandin E1on activation of hepatic stellate cells in rabbits with schistosomiasis[J]. Hepatobiliary Pancreat Dis Int, 2007,6(2): 176-181.
[19] Liu SJ, Shen SR, Wang XY, et al. Effect of prostaglandin E1on the expression of tissue inhibitor of metalloproteinase-1 in experimental liver fibrosis rats[J]. J Central South Univ, 2006,31(3): 383-386. [刘少俊, 沈守荣, 王晓艳, 等. 前列腺素E1对实验性肝纤维化大鼠T1MP-1表达的影响[J]. 中南大学学报, 2006, 31(3): 383-386.]
[20] Lu PX, Mei YY, Shu X, et al. Effect of injection on chronic hepatitis inflammation and liver fibrosis with Kaishi[J]. J China-Japan Friendship Hosp, 2001, 15(6):343-344. [卢平宣, 梅咏予,舒欣, 等. 凯时注射液对慢性肝炎炎症和肝纤维化的疗效[J]. 中日友好医院学报, 2001, 15(6): 343-344.]

