脓毒症大鼠小肠上皮PepT1的表达变化及其与Ghrelin的相关性研究
刘景全,马国光,石斌,娄晓丽,刘鸿翔,施凯,梁冬雨,万晟霞
脓毒症是ICU患者死亡的主要原因之一[1-2]。目前认为,小肠上皮短肽载体1(oligopeptide transporter,PepT1)对蛋白质分解产物短肽的转运是肠道吸收蛋白质的主要途径[3],但在脓毒症复杂病理条件如内毒素﹑缺血﹑缺氧及炎性介质等多种因素影响下,小肠上皮PepT1的生物学变化仍不明确,相关研究甚少。新近发现的激素Ghrelin是一种内源性脑肠肽,已有研究表明,脓毒症时血清Ghrelin水平显著下降,给予外源性Ghrelin可显著改善脓毒症时的急性胃肠功能损伤[4]。但脓毒症时机体自身Ghrelin分泌水平是否影响小肠上皮PepT1的表达需进一步探讨。本研究采用盲肠结扎穿孔(cecal ligation and puncture,CLP)模型,探讨脓毒症时肠上皮PepT1表达的变化及其与Ghrelin水平的关系,以期为脓毒症肠道功能障碍的防治提供理论基础。
1 材料与方法
1.1 实验动物及主要试剂 健康雄性SPF级SD大鼠48只,体重275~325g,由上海市第一人民医院实验动物中心提供,动物许可证号SYXK(沪)2009-0086。兔抗大鼠PepT1抗体(美国Santa Cruz公司),β-actin抗体﹑HRP-抗兔IgG(美国CST公司),Gly-Sar(美国Sigma公司),FQ-PCR试剂盒(美国ABI公司)。
1.2 脓毒症模型制备 参照Rittirsch等[5]的CLP法进行脓毒症模型制备。大鼠麻醉后,无菌操作,腹正中切口2cm,于盲肠盲端2/3处结扎,用18G套管针将盲肠贯通,穿2个孔,挤出少许粪便,还纳腹腔,缝合腹壁切口。动物处置方法符合动物伦理学标准。
1.3 动物分组及处理 48只大鼠按随机数字表法分为对照组(n=8)和脓毒症组(n=40),脓毒症组又根据模型建立后4﹑8﹑12﹑16﹑20h时间点随机均分为5个亚组。对照组大鼠剖腹后仅分离盲肠,不结扎和穿孔;脓毒症组大鼠剖腹后行CLP。各组术后均给予生理盐水30ml/kg皮下注射。
1.4 标本采集与处理 分别于建模4﹑8﹑12﹑16﹑20h后活杀大鼠,留取静脉血4ml待测血清Ghrelin水平。以Treitz韧带远侧6cm处为起点,留取上段空肠约20cm,一部分测黏膜Ghrelin水平;一部分保存于4%甲醛溶液中,待行病理观察;一部分于4℃下制备小肠黏膜刷状缘囊泡(BBMV),方法参照文献[6],待测小肠上皮PepT1的表达及功能。
1.5 检测指标及方法
1.5.1 小肠病理观察 取小肠组织,在多聚甲醛水溶液中固定,组织切片,HE染色,光镜下观察空肠黏膜病理学变化。
1.5.2 血清及肠黏膜Ghrelin水平检测 采用酶联免疫吸附法(ELISA)测定血清及肠黏膜Ghrelin水平,按试剂盒说明书步骤操作。
1.5.3 Real-time qPCR检测PepT1 mRNA表达 将制备好的BBMV按照Trizol说明书步骤提取细胞总RNA,经反转录得到cDNA。PepT1特异引物:正义链5'-GTATGTTCTGTTCGCCTCCTTG-3',反义链5'-GGTGAATGCTGGACTTGGTATG-3',产物长度228bp;内参GAPDH引物:正义链5'-GTCGGTGTGAACGGATTTG-3',反义链5'-TCCCATTCTCAGCCTTGAC-3',产物长度181bp。采用Taqman Probe探针法,对目的基因和管家基因分别进行定量检测,通过GAPDH校准,分析各组样品中PepT1目的基因的相对表达量。
1.5.4 Western blotting检测PepT1蛋白表达 提取50μg BBMV总蛋白,上样于10%SDS-PAGE凝胶,电泳后转膜至硝基纤维素膜;加入兔抗大鼠PepT1抗体(1:1000)室温孵育2h,TBST漂洗3~5次,每次10min;加入HRP-抗兔IgG(1:5000)室温孵育1h,TBST液洗膜;加ECL发光底物,于暗室内压片。β-actin作为加样内参照,稀释鼠抗β-actin多克隆抗体(1:1500)作为一抗,稀释HRP标记的IgG(1:1500)作为二抗。Western blotting胶片经UltroscanXL(Pharmacia LKB)光密度仪扫描,根据面积和深浅计算蛋白条带的光密度(A)值(Quantity One Version4.4软件)。
1.6 统计学处理 采用SPSS 18.0软件进行数据处理。所有连续变量通过正态性检验,呈正态分布的资料以±s表示,行多组间单因素方差分析(Oneway ANOVA)。多组间的两两比较,若方差齐用Dunnett-t检验,若方差不齐用Mann-Whitney U检验。相关性分析采用Pearson方法。P<0.05为差异有统计学意义。
2 结 果
2.1 肠黏膜病理改变 对照组小肠黏膜结构无显著变化,小肠微绒毛排列整齐;脓毒症组(4﹑8﹑12﹑20h亚组)出现不同程度肠绒毛结构紊乱﹑短缩﹑脱落,黏膜水肿,炎性细胞浸润,毛细血管出血和溃疡形成(图1)。
2.2 各组PepT1 mRNA表达水平比较 Real-time qPCR检测结果显示,与对照组比较,脓毒症8﹑12﹑16﹑20h组小肠上皮PepT1 mRNA表达水平均明显下降(P<0.05),脓毒症各亚组小肠上皮PepT1mRNA表达水平之间无明显差异(P>0.05,图2)。
2.3 各组PepT1蛋白表达水平比较 Western blotting检测结果显示,脓毒症12﹑16﹑20h组PepT1蛋白表达量较对照组及脓毒症4﹑8h组明显下降(P<0.05,图3)。
2.4 血清及肠黏膜Ghrelin水平变化 血清和肠黏膜Ghrelin水平均在建模后4h达高峰,然后逐渐下降,脓毒症组各时间点与对照组比较,差异均有统计学意义(P<0.05,图4)。
2.5 Ghrelin与PepT1蛋白表达的相关性 脓毒症时血清和肠黏膜Ghrelin水平均与肠上皮PepT1蛋白表达呈显著正相关(P<0.001,图5)。

图1 大鼠小肠黏膜病理结构变化(HE ×100)Fig.1 Pathological changes of small intestinal mucosa of rats(HE ×100)
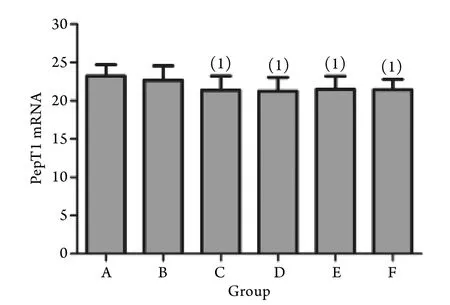
图2 脓毒症大鼠小肠上皮PepT1 mRNA表达变化Fig.2 PepT1 mRNA expression of rats with sepsis

图3 脓毒症大鼠肠上皮PepT1蛋白表达变化Fig.3 PepT1 protein expression of rats with sepsis
3 讨 论
脓毒症时可出现急性肠功能障碍,其特征是肠道吸收功能丧失,营养底物尤其是蛋白质﹑葡萄糖无法在肠道内转运吸收,机体不能维持蛋白质﹑液体﹑电解质和微量营养物质等的平衡,出现营养不良﹑免疫功能紊乱,并在此基础上引发或加重其他器官功能衰竭[7-8]。已有研究表明,小肠上皮PepT1对蛋白质分解产物短肽(二肽﹑三肽)的转运是肠道吸收蛋白质的主要途径,其表达数量及功能活性的高低直接影响机体的营养状况及疾病预后[9]。因此,研究脓毒症小肠上皮PepT1的生物学功能变化及调控,将为临床感染患者的营养支持模式及肠功能障碍改善提供理论依据。
CLP模型是目前国内外公认的脓毒症动物模型,能模拟腹腔脓肿发展到弥漫性腹膜炎﹑脓毒性休克和多器官功能障碍的临床过程[10]。在此过程中,机体处于严重应激状态,肠道组织细胞受到缺血﹑缺氧﹑内毒素和炎症的刺激,可能影响肠道上皮细胞内PepT1的正常表达及功能发挥。Shu等[11]研究表明,腹腔注射脂多糖(LPS)可降低大鼠空肠PepT1 mRNA和蛋白的表达,但此种变化并非PepT1特异的,地塞米松可通过抑制TNF-α和IL-1β释放抑制其表达下降。目前对脓毒症时小肠上皮PepT1表达及功能的改变认识仍不十分清楚。本研究结果显示,建模后8h大鼠小肠上皮PepT1 mRNA水平明显下降,建模后12h蛋白表达明显下降,在此后脓毒症的进程中,即建模后12~20h,检测到的PepT1 mRNA及蛋白表达水平持续维持在较低水平,提示脓毒症状况下,大鼠小肠上皮PepT1的基因转录及蛋白质表达均受到抑制,分析其可能机制为:①病理结果显示,脓毒症时小肠黏膜组织水肿,肠绒毛结构紊乱﹑短缩,肠黏膜组织屏障受到损伤,可能直接破坏肠上皮PepT1,致使其分布减少;②既往研究表明,脓毒症时由于大量炎性介质如TNF-α﹑IL-6等释放,抑制了肠上皮PepT1表达,引起小肠蛋白吸收障碍[12]。本研究证实了脓毒症时机体在基因和蛋白水平下调了小肠上皮PepT1的表达,致使机体对蛋白底物的转运吸收受到抑制。
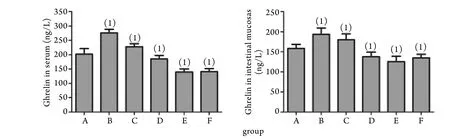
图4 脓毒症大鼠血清及肠黏膜Ghrelin水平变化Fig.4 Ghrelin levels in serum and intestinal mucosas of rats with sepsis

图5 Ghrelin与PepT1蛋白表达的相关性分析Fig.5 Correlation analysis between the expression levels of ghrelin and PepT1 protein
研究发现肠功能衰竭在很大程度上也是内分泌功能尤其是胃肠激素﹑脑肠肽类激素分泌的衰竭。Ghrelin是1999年在大鼠胃黏膜及下丘脑中发现的一种脑肠肽激素,是生长激素释放激素受体(GHSR)的内源性配体,其受体广泛分布于胃肠道组织中,在调节胃肠功能方面起着重要作用,包括促进食欲﹑增加体重﹑促进胃肠动力等[13]。同时,脓毒症时给予外源性Ghrelin可显著增加大鼠小肠等的血管松弛度并抑制NF-λB通路,从而改善组织灌注及肠道黏膜通透性,抑制炎性介质产生,减轻肠壁水肿,减少细菌移位,延缓脓毒症向休克进展,在改善脓毒症肠功能障碍中发挥重要作用[14-15]。本研究结果显示,脓毒症时血清和肠黏膜Ghrelin水平在建模后4h达高峰,随着脓毒症进展,胃肠道功能障碍加重,出现胃肠分泌功能障碍,Ghrelin水平显著下降,这与Das[4]的研究结果一致。我们推测,随着Ghrelin分泌减少,对肠道的自我保护作用随之减弱,续贯出现PepT1蛋白破坏及表达下降。进一步分析显示,血清和肠黏膜Ghrelin水平与肠上皮PepT1蛋白表达存在显著正相关(r=0.792,r=0.756,P<0.001),提示其为保护性作用,也间接说明Ghrelin在机体摄食和蛋白吸收中发挥重要作用。
上述结果显示,脓毒症时肠上皮PepT1蛋白表达显著下降,Ghrelin分泌水平与PepT1蛋白表达呈正相关,具有保护性作用,对临床脓毒症严重感染患者的救治及营养支持提供了理论支持。后续研究将进一步探讨外源性Ghrelin对脓毒症肠上皮PepT1的调控作用及相关机制。
[1] Sheng ZY, Lin HY, Yao YM. Pathogenic dissonance in sepsis[J].Med J Chin PLA, 2007, 32(8): 783-785. [盛志勇, 林洪远, 姚永明. 脓毒症中的免疫“失和谐”现象[J]. 解放军医学杂志,2007, 32(8): 783-785.]
[2] Li B, Ma GG, Liu JQ, et al. Distribution characteristics of liquid sequestration in rats with sepsis[J]. Med J Chin PLA, 2012,37(3): 217-220. [李斌, 马国光, 刘景全, 等. 脓毒症大鼠液体扣押的分布特征[J]. 解放军医学杂志, 2012, 37(3): 217-220.]
[3] Meredith D. Review. The mammalian proton-coupled peptide cotransporter PepT1: sitting on the transporter-channel fence[J]? Philos Trans R Soc Lond B Biol Sci, 2009, 364(1514):203-207.
[4] Das UN. Relationship between gut and sepsis: Role of ghrelin[J]. World J Diabetes, 2011, 2(1): 1-7.
[5] Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36.
[6] Kumaraswami NS, Maruyama T, Kurabe S, et al. Lipids of brush border membrane vesicles (BBMV) from Plutella xylostella resistant and susceptible to Cry1Ac delta-endotoxin of Bacillus thuringiensis[J]. Comp Biochem Physiol B Biochem Mol Biol,2001, 129(1): 173-183.
[7] Sheng ZY, Yao YM. Enhancement of studing and monitoring the dysfunction of the immune response in severe sepsis[J]. Med J Chin PLA, 2011, 36(1): 8-10. [盛志勇, 姚咏明. 加强对脓毒症免疫功能障碍及其监测的研究[J]. 解放军医学杂志, 2011,36(1): 8-10.]
[8] Reintam Blaser A, Malbrain ML, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3):384-394.
[9] Nässl AM, Rubio-Aliaga I, Fenselau H, et al. Amino acid absorption and homeostasis in mice lacking the intestinal peptide transporter PEPT1[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(1): G128-G137.
[10] Dejager L, Pinheiro I, Dejonckheere E, et al. Cecal ligation and puncture: the gold standard model for polymicrobial sepsis[J]?Trends Microbiol, 2011, 19(4): 198-208.
[11] Shu HJ, Takeda H, Shinzawa H, et al. Effect of lipopolysaccharide on peptide transporter 1 expression in rat small intestine and its attenuation by dexamethasone[J]. Digestion, 2002, 65(1): 21-29.
[12] Sodeyama M, Gardiner KR, Regan MC, et al. Sepsis impairs gut amino acid absorption[J]. Am J Surg, 1993, 165(1): 150-154.
[13] Kojima M, Hosoda H, Date Y, et al. Ghrelin is a growthhormone-releasing acylated peptide from stomach[J]. Nature,1999, 402(6762): 656-660.
[14] Wu R, Dong W, Zhou M, et al. Ghrelin improves tissue perfusion in severe sepsis via downregulation of endothelin-1[J].Cardiovasc Res, 2005, 68(2): 318-326.
[15] Wu R, Dong W, Qiang X, et al. Orexigenic hormone ghrelin ameliorates gut barrier dysfunction in sepsis in rats[J]. Crit Care Med, 2009, 37(8): 2421-2426.

