NF-κB 抑制剂 PDTC对大肠癌体外血管生成因子表达的影响
潘 娟,曲延刚,刘 毅
(湖北省恩施州中心医院1.病理诊断中心;2.妇产科,湖北恩施445000)
核转录因子-κB(nuclear transcription factor κB,NF-κB)信号通路属于转录因子家族成员。在静止细胞中,NF-κB 与其抑制性分子 IκB(α/β/ε)形成稳定的复合物存在于细胞质。当受到某些因子刺激后,复合物中的IκBα在IκB激酶IKK的作用下磷酸化,脱下IκBα的NF-κB转移到细胞核,进而激活它们的下游靶基因,发挥生物学作用[1]。NF-κB信号通路在炎性反应、感染、肿瘤及淋巴细胞生成中都扮演着重要角色[2]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)是广为人知的 NF-κB依赖性血管生成相关因子,它们在肿瘤细胞内表达的高低反映肿瘤细胞潜在的血管生成能力[3-6]。PDTC(pyrrolydine dithiocarbamate)作为 NF-κB 活性抑制剂,它能够通过抑制 NF-κB的活性,促进ARPE-19细胞中炎性调节因子的表达[7];打击人胰腺癌的血管生成潜能[4]。在人大肠癌中,抑制NF-κB的活性是否也可以降低血管生成因子VEGF和b-FGF的表达,进而影响大肠癌的体外血管生成能力?目前尚无文献报道。本研究拟观察NF-κB抑制剂PDTC对人大肠癌Lovo细胞系体外促HUVEC血管生成能力的影响。
1 材料与方法
1.1 材料
人大肠癌Lovo细胞系和人脐静脉内皮细胞(重庆医科大学汤唯学教授惠赠),PDTC(碧云天公司),鼠抗人NF-κB抗体、兔抗人b-FGF抗体和兔抗人 β-actin抗体(Santa Cruz公司),鼠抗人p-IκBα 抗体(Cell Signaling公司),兔抗人VEGF抗体(博士德生物工程有限公司),辣根酶标记山羊抗兔、抗鼠二抗(北京中杉金桥生物技术公司),24 Well Transwell Permeable Supports(Millipore公司),Matrigel(BD 公司),CCK-8试剂盒(Dojindo公司)。
1.2 NF-κB抑制剂PDTC处理Lovo细胞
实验组PDTC按照终浓度5 mmol/L加入到Lovo细胞培养瓶中培养1 h。未作处理Lovo细胞为对照组[8]。
1.3 Western blot
分别收集处于对数生长期的各组Lovo细胞养至1.0×106个/mL。蛋白提取液分别提取各组细胞蛋白,操作按试剂盒说明书进行。Bradford法(考马斯亮蓝法)测定各组蛋白浓度,8%SDS-PAGE凝胶电泳,转膜并封闭非特异性结合位点之后,分别用抗NF-κB、p-IκBα、VEGF、b-FGF 和 β-actin 的一抗孵育(抗体稀释浓度分别为1∶1 000、1∶1 000、1∶1 000、1∶1 000和1∶500),4 ℃ 冰箱过夜,辣根酶标记的二抗孵育2 h,ECL试剂检测膜上的免疫反应条带,凝胶成像仪下观察并进行分析。以对照组Lovo细胞各种待检蛋白分别与β-actin吸光度的相对比值计算,每项检测重复6次(n=6)。
1.4 HUVEC体外迁移能力检测
采用Transwell小室体外细胞迁移实验,参照Sanda等[9]的方法稍加修改。将处于对数生长期的各组Lovo细胞分别种植到24孔板,1.0×105个/孔,含10%胎牛血清RPMI1640培养基加入下室补齐2.0×10-4L/孔,37 ℃、5%CO2培养箱中常规培育1 d,次日将处于对数生长期的HUVEC种植到小室,1.0×105个/Transwell小室,加 DMEM 培养液入小室内补齐1×10-4L/孔,再将小室分别置于24孔板上同两组Lovo细胞共培养,8 h后PBS液清洗,棉签擦去内室细胞,95%乙醇固定15 min,HE染色,应用倒置显微镜观察HUVEC迁移情况并计数(高倍镜400倍下随机选取5个视野)。
细胞迁移抑制率=(对照组平均迁移细胞数-实验组平均迁移细胞数)/对照组平均迁移细胞数×100%。
1.5 HUVEC增殖活性检测
采用 CCK-8细胞增殖检测实验,参照 Yang等[10]的方法稍加修改。取各组Lovo细胞2×106个分别加入到0.1 L培养瓶,加含10%胎牛血清的RPMI1640培养基至每瓶总体积2×10-3L,37℃、5%CO2常规培养各组Lovo细胞,48 h后收集各组上清液。将处于对数生长期的HUVEC种植入96孔板,2×103个/孔,加含10%胎牛血清的DMEM培养液补齐1×10-4L/孔,37 ℃、5%CO2培养箱中常规培育1 d,次日吸净培养液,分别向孔内加入不同组别Lovo上清液2×10-5L,再向孔内加入含10%胎牛血清的DMEM培养液各8×10-5L使每孔总体积仍为1×10-4L,设3个复孔,置于37℃、5%CO2培养箱中常规培育72 h后加 CCK-8试剂1×10-5L/孔,37℃、5%CO2培养箱中常规孵育4 h后测450 nm处A值。
细胞增殖抑制率=(对照组平均A值-实验组平均A值)/对照组平均A值×100%。
1.6 统计学分析
2 结果
2.1 各组 Lovo 细胞 NF-κB、p-IκBα、VEGF 和b-FGF的蛋白表达
实验组细胞内 NF-κB、p-IκBα、VEGF 和b-FGF蛋白表达量显著低于对照组 (P<0.05)(图1,表1)。
2.2 PDTC对HUVEC体外迁移能力的影响
实验组HUVEC的迁移数量为65±3,显著低于对照组128±4(P<0.05)(图2)。PDTC对HUVEC的迁移抑制率为49.2%。
2.3 PDTC对HUVEC体外增殖能力的影响
实验组HUVEC的增殖数量为0.514±0.056(以450 nm处测得的A值表示),显著低于对照组的1.915±0.121(P<0.05)。PDTC对HUVEC的增殖抑制率为73.2%。
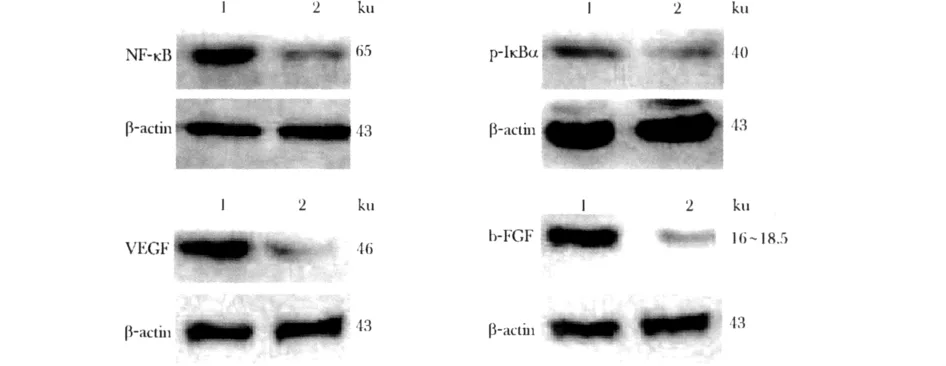
图1 各组Lovo细胞NF-κB、p-IκBα、VEGF和b-FGF蛋白表达情况Fig 1 Expressions of NF-κB,p-IκBα,VEGF and b-FGF protein in each groups Lovo cells

表1 各组 Lovo细胞 NF-κB、p-IκBα、VEGF和 b-FGF表达量Table 1 Expressions of NF-κB,p-IκBα,VEGF and b-FGF in each groups Lovo cells(x±s,n=6)

图2 各组HUVEC的迁移能力Fig 2 The migration of HUVEC in each groups(×400)
3 讨论
NF-κB是转录因子家族成员之一,这个家族共有5个成员,它们通过不同组合形成二聚体,存在于细胞质。当受到某些因子刺激后,NF-κB转移到细胞核,发挥生物学作用,NF-κB活化一个不可或缺的环节就是IκBα 的磷酸化和 NF-κB 入核[1]。本研究通过测定胞质 p-IκBα和胞核 NF-κB的表达,其结果显示PDTC处理细胞后胞质p-IκBα和胞核NF-κB的表达都明显降低,说明PDTC在作用Lovo细胞1 h后成功抑制了NF-κB活性。
VEGF和b-FGF为NF-κB依赖性促血管生成因子,它们受 NF-κB 的调节[3-6]。本研究结果显示,实验组VEGF和b-FGF的表达较对照组明显降低,说明在人大肠癌Lovo细胞中NF-κB活性受到抑制后,其血管生成相关因子VEGF和b-FGF表达是降低的,它们受到NF-κB的正向调节。同时有文献报道,在培养的骨肉瘤细胞、人神经母细胞瘤细胞的上清液中有 VEGF 存在[11-12],VEGF 以分泌形式发挥其侵袭和促血管生成作用。在培养的肥胖症患者脂母细胞的上清液中也有VEGF存在,其可能在肥胖相关的2型糖尿病中起着促炎作用[13]。b-FGF也可以分泌形式促进角膜损伤细胞修复[14],导致猪心肌缺血再灌注损伤模型的骨髓间充质干细胞向血管分化[15]。基于 VEGF和 b-FGF都属于可分泌蛋白[11-15],本研究收集各组 Lovo细胞的上清液分别培养 HUVEC,并采用 CCK-8细胞增殖实验检测HUVEC增殖能力,结果显示,实验组HUVEC的增殖能力明显降低。同时本研究采用Transwell细胞迁移实验检测HUVEC的迁移能力,结果显示,实验组HUVEC的迁移能力亦明显减弱。因此认为,Lovo细胞内NF-κB活性的抑制可以降低HUVEC体外促血管生成能力,其可能是通过降低细胞内促血管生成因子VEGF、b-FGF等的表达,进而减少它们的分泌来实现的。
综上所述,本研究结果显示,在人大肠癌Lovo细胞中,NF-κB抑制剂PDTC作用1h后能显著抑制NF-κB的活性;PDTC能降低促血管生成因子VEGF、b-FGF等的表达;PDTC能抑制HUVEC体外促血管生成能力,这可能与VEGF、b-FGF等的分泌减少有关,其详尽机制尚需进一步探讨。
[1]Ho JQ,Asagiri M,Hoffmann A,et al.NF-κB Potentiates Caspase IndependentHydrogen Peroxide Induced Cell Death[J].PloS One,2011,6:e16815.doi:10.1371/journal.pone.0016815.
[2]Klein B.Positioning NK-kappaB in multiple myeloma[J].Blood,2010,115:3422-3424.
[3]Moon SJ,Park MK,Oh HJ,et al.Engagement of toll-like receptor 3 induces vascular endothelial growth factor and interleukin-8 in human rheumatoid synovial fibroblasts[J].Korean J Intern Med,2010,25:429-435.
[4]Xiong HQ,Abbruzzese JL,Lin E,et al.NF-kappaB activity blockade impairs the angiogenic potential of human pancreatic cancer cells[J].Int J Cancer,2004,108:181 -188.
[5]Valera FCP,Queiroz R,Scrideli C,et al.Expression of transcription factors NF-κB and AP-1 in nasal polyposis[J].Clin Exp Allergy,2008,38:579-585.
[6]Pandey Mk,Sandur SK,Sung B,et al.Butein,a Tetrahydtoxychalcone,inhibits nuclear factor(NF)-κB and NF-κB-regulated gene expression through direct Inhibition of IB kinase on Cysteine179 Residue[J].J Biol Chem,2007,282:17340-17350.
[7]Chen Y,Kijlstra A,Chen Y,et al.IL-17A stimulates the production of inflammatory mediators via Erk1/2,p38 MAPK,PI3K/Akt,and NF-κB pathways in ARPE-19 cells[J].Molvis,2011,17:3072-3077.
[8]Su J,Ruan XC,Zhang YH,et al.Effects of morphine and pethidine on the expression of P-glycoprotein in mouse brain microvascular endothelial cells[J].Nan Fang Yi Ke Da Xue Xue Bao,2010,30:1824-1826.
[9]Sanda T,Kuwano T,Nakao S,et al.Antimyeloma effects of a novel synthetic retinoid Am80(Tamibarotene)through inhibition of angiogenesis[J].Leukemia,2005,19:901 -909.
[10]Yang LP,Cheng P,Peng XC,et al.Anti-tumor effect of adenovirus-mediated gene transfer of pigment transfer of pigment epithelium-derived factor on mouse B16-F10 melanoma[J].J Exp Clin Cancer Res,2009,28:75.doi:10.1186/1756-9966-28-75.
[11]Fossey SL,Bear MD,Kisseberth WC,et al.Oncostatin M promotes STAT3 activation,VEGF production,and invasion in osteosarcoma cell lines[J].BMC Cancer,2011,11:125.doi:10.1186/1471-2407-11-125.
[12]Li KX,Li AM,Zhang JH.Effects of TrkB-BDNF signal pathway on synthesis and secretion of vascular endothelial growth factor in human neuroblastoma cells[J].Zhongguo Dang Dai Er Ke Za Zhi,2011,13:240 -243.
[13]Meijer K,de Vries M,Al-Lahham S,et al.Human primary adipocytes exhibit immune cell function:adipocytes prime inflammation independent of macrophages[J].PLoS One,2011,6:e17154.doi:10.1371/journal.pone.0017154.
[14]Choi JA,Jin HJ,Jung S,et al.Effects of amniotic membrane suspension in human corneal wound healing in vitro[J].Mol Vis,2009,5:2230-2238.
[15]Jiang YB,Zhang XL,Tang YL,et al.Effects of heme oxygenase-1 gene modulated mesenchymal stem cells on vasculogenesis in ischemic swine hearts[J].Chin Med J(Engl),2011,124:401-407.

