乙醇抑制大鼠原代肝细胞中P70S6K和ERK1/2活性
焦 杨,班克臣,孔晓龙*,冯娴婧
(1.广西医科大学药理学教研室,广西南宁530021;2.Dept.of Surgery,University of Texas Medical School at Houston,Houston,Texas 77030,USA)
长期大剂量饮酒可致酒精性肝病,发生不同程度的肝脂肪变性、炎性和坏死,继而形成肝纤维化和肝硬化。酗酒还被认为是肝癌的高危因素。mTOR (mammalian target of rapamycin)信号通路是调控细胞生长与增殖的一条关键通路,调控细胞凋亡及自噬、蛋白质合成、免疫、细胞运动及代谢等大量的生命过程。核糖体S6 蛋白激酶 (P70 ribosomal protein S6 kinase,P70S6K)是mTOR 下游重要的效应器。有报道乙醇可抑制许多组织和/或细胞中P70S6K 的活性[1]等。ERK 信号通路不仅调节细胞生长、增殖、移行、分化、凋亡和自噬,还介导炎性反应[2]。然而,乙醇对肝细胞中ERK1/2的影响报道很少[3],对肝细胞中P70S6K的影响及P70S6K 与ERK1/2的相互关系尚未见报道。因此,本研究拟对此进行探讨。
1 材料和方法
1.1 主要试剂和仪器
P70S6K 磷酸化(p-P70S6K)抗体、ERK1/2磷酸化(p-ERK1/2)抗体和β-actin 抗体(Cell signaling公司);PPARγ 抗体(Santa Cruz 公司);辣根过氧化物酶标记驴抗兔IgG 和ECL plus Western blot 检测系统(GE Healthcare Biosciences 公司);蛋白质测定试剂盒(Bio-Rad Laboratories 公司);蛋白分析仪(Bio-Rad 公司);细胞核/细胞浆抽提试剂盒(Nuclear/Cytosol Fractionation Kit)(BioVision 公司);T4 多聚核苷酸激酶试剂盒(Promega 公司);[γ-32P]ATP(Amersham 公司);筛网(EC588-100)、雷帕霉素(rapamycin)和U0126(Sigma 公司)。
1.2 方法
1.2.1 大鼠原代肝细胞的分离和培养:给成年雄性SD 大鼠腹腔注射含20 mg/kg 甲苯噻嗪和61.5 mg/kg氯胺酮的混合麻醉剂麻醉,以Chee 氏液(pH 7.2)(含10 mmol/L HEPES、2.0 U/mL肝素和0.5 mmol/L EGTA)灌流肝脏至流出液中不含有血液,再改用含500 mg/L胶原酶的Chee 氏液进行第2次灌流。灌流完成后将肝脏切碎并小心搅拌以游离肝细胞,以100 μm的筛网过滤,细胞悬浮液50 ×g离心2 min,所得细胞沉淀用含100 μmol/L地塞米松、100 U/mL青霉素和100 mg/L链霉素的Chee 氏液洗涤2 次。然后接种于用鼠尾胶原预先包被(25 μg/孔)的6 孔板,1.0 ×106个/孔,置37 ℃,5%CO2培养箱中培养4 h至细胞贴壁,然后换不含地塞米松的Chee 氏培养液培养20 h。
1.2.2 乙醇对肝细胞中P70S6K 活性等的影响:在剂量-效应关系实验中,在上述原代肝细胞的培养孔中分别加入0、50、100 和200 mmol/L的乙醇,4 h后收集细胞检测P70S6K 的表达;在时间-效应关系实验中,细胞培养孔均加入200 mmol/L乙醇,分别培养0、1、2 和4 h后收集细胞,检测P70S6K 的表达。重复样本量为3。
另取细胞,在其中加入100 nmol/L雷帕霉素或10 μmol/L U0126,培养24 h后收集细胞,进行Western blot 分析和凝胶电泳迁移率实验(Electrophoretic Mobility Shift Assay,EMSA)。
1.2.3 Western blot:用含蛋白酶抑制剂的RIPA 裂解液裂解细胞,测定蛋白质浓度,然后进行SDS-聚丙烯酰胺胶电泳。电泳完成后将蛋白质转移至Hybond膜,进而用含5% 脱脂奶粉,0.1% 吐温20的Tris 缓冲液室温封闭膜1 h,分别加p-P70S6K、p-ERK1/2、PPARγ 和β-actin 抗体,4 ℃孵育过夜。第2 天用含0.1%吐温-20 的Tris 缓冲液洗去游离的抗体后,加辣根过氧化物酶标记的驴抗兔IgG 室温孵育1 h,用ECL plus Western blot 检测系统进行检测。重复样本量为3。
1.2.4 EMSA:用细胞核/细胞质抽提试剂盒提取细胞核蛋白并测定蛋白浓度,按照使用说明书进行。双链过氧化物酶体增殖反应元件(PPRE)寡核苷酸探针序列为:5'-CAAAACTAGGTCAAAGGTCA-3',用T4 多聚核苷酸激酶试剂盒以[γ-32P]ATP 标记探针末端。取10 μg核蛋白、2 μL[γ-32P]标记的探针、20 μL 结合缓冲液(内含15 mmol/L HEPES、60 mmol/L KCl、0.5 mmol/L EDTA、1 mmol/L DTT、75 mg/L poly (dI-dC)、100 mg/L 乙酰化BSA 和0.05% NP-40),混合后室温孵育20 min进行结合反应。冷竞争反应时,以200 倍未标记的探针加入结合反应混合物中;超级迁移分析时,PPARγ 抗体在DNA-蛋白质结合反应之后加入。上5% 聚丙烯酰胺凝胶电泳,电泳结束后取下凝胶并干燥,以X 线片显影,用Optimas 6.1 软件分析图像。重复样本量为3。
1.3 统计学分析
数据用SPSS13.0 处理,计量资料进行t 检验或F 检验。
2 结果
2.1 乙醇对P70S6K 活性的影响
0、50 、100 和200 mmol/L 的乙醇处理后p-P70S6K的相对表达量逐渐降低(P<0.01 或P<0.05);在细胞中加入200 μmol/L乙醇,乙醇处理后0、1、2 和4 h 时p-P70S6K 的相对表达量逐渐降低(P<0.01 或P<0.05)(图1)。
2.2 P70S6K 与ERK1/2的关系
乙醇处理后,p-P70S6K 和p-ERK1/2的相对表达量减少(P<0.01)(图2A)。另外,U0126 使p-ERK1/2和p-P70S6K 的表达均下降,雷帕霉素使p-P70S6K 表达下降而p-ERK1/2表达增加(P<0.01或P<0.05)(图2B)。
2.3 乙醇对PPARγ 的影响
对照组和乙醇处理组PPARγ 相对表达量分别无显著差异,EMSA 也未见乙醇使迁移距离发生改变(图3)。
3 讨论
长期大剂量饮酒可致肝脂肪变性、炎性反应和坏死,而mTOR 信号通路和细胞的增殖、凋亡有关,在调节免疫反应方面也起重要的作用[4]。P70S6K是mTOR 信号通路的主要效应器之一,常被用作mTOR 信号通路是否激活的指标[5]。本研究发现,乙醇对P70S6K 的活性有明显的抑制作用,且存在量效关系和时效关系,提示乙醇的摄入可抑制mTOR 信号通路进而可能引起肝脂肪变性、炎性反应和坏死等。
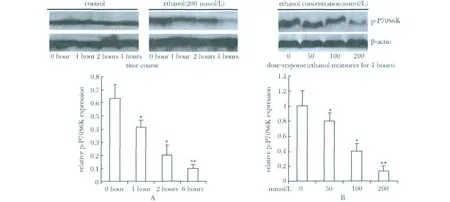
图1 乙醇对原代培养大鼠肝细胞中磷酸化P70S6K 的抑制有时间-效应和浓度-效应关系Fig 1 Ethanol inhibited the activity of p-P70S6K in rat primary hepatocytes in a time-and concentrationdependent manner
有研究表明,ERK1/2可以抑制mTOR 信号通路[6-7];也有报道认为ERK1/2 和肝脂肪变性有关[8]。本研究结果显示,乙醇也抑制ERK1/2 的活性,用ERK1/2信号通路特异抑制剂U0126 处理细胞,ERK1/2活性被抑制的同时P70S6K的活性也被抑制,表明在肝细胞中ERK1/2抑制mTOR 信号通路。而有意思的是,用mTOR 特异抑制剂雷帕霉素处理细胞,抑制P70S6K 的活性但增强ERK1/2 活性,提示mTOR 可以反向调节ERK1/2,这种现象值得进一步探讨,同时也提示mTOR 和ERK1/2的关系比想象的要复杂。
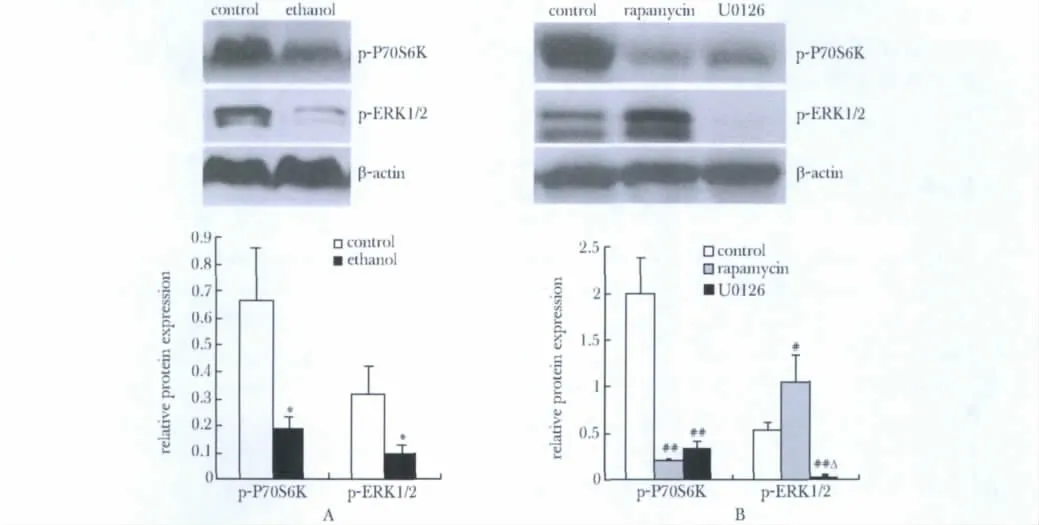
图2 原代培养肝细胞中ERK1/2 对P70S6K 的调节作用Fig 2 ERK1/2 regulated P70S6K in primary hepatocyte
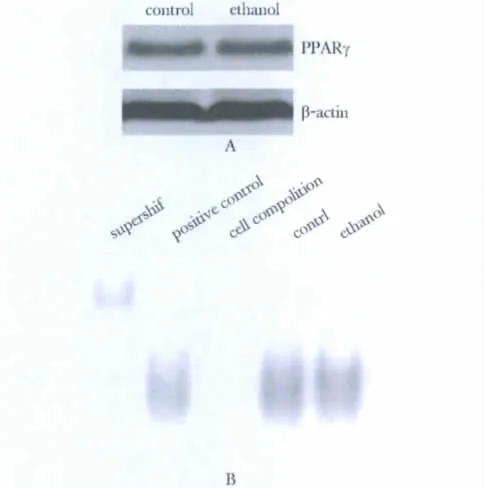
图3 乙醇对PPARγ 表达的影响Fig 3 Ethanol did not affect the expression and activity of PPARγ
过氧化物酶增殖物激活受体PPRAγ 是脂类激活性转录因子,参与脂类平衡的调节,可通过激发与脂肪增殖有关的基因的表达诱导脂肪细胞的分化[9]。有报道认为,mTOR 和ERK1/2信号通路可调节PPRAγ[10]。因为乙醇可以抑制mTOR 和ERK1/2信号通路,如果mTOR 和ERK1/2 信号通路调节PPRAγ,PPRAγ 的活性也应该因此变化。然而EMSA结果表明,乙醇处理并不影响PPRAγ 的活性,提示乙醇导致的肝脏脂肪变性可能不是通过增加PPRAγ 的活性。
总之,本研究在肝原代细胞中的实验表明,乙醇可抑制mTOR 和ERK1/2 的活性。由于mTOR 和ERK1/2信号通路在细胞生物学中的重要性,进一步研究乙醇对mTOR 和ERK1/2调节及对肝脂肪变性、炎性反应和坏死的影响,对了解乙醇引起肝损害的机理及预防损害将有重要的意义。本研究只探讨了乙醇短期内对大鼠原代肝细胞中P70S6K 和ERK1/2活性的影响,其在动物慢性乙醇摄入模型及在和乙醇摄入有关的人肝脏标本中的作用有待于进一步验证和研究。
[1]Li Q,Ren J.Chronic alcohol consumption alters mammalian target of rapamycin (mTOR),reduces ribosomal p70s6 kinase and p4E-BP1 levels in mouse cerebral cortex[J].Exp Neurol,2007,204:840-844.
[2]卢宏柱,樊启红,刘丹,等.乙型肝炎病毒X 蛋白通过激活ERKs 和NF-κB 上调大鼠系膜细胞表达TNF-α[J].基础医学与临床,2011,31:144-148.
[3]Cagnol S,Chambard JC.ERK and cell death:mechanisms of ERK-induced cell death--apoptosis,autophagy and senescence[J].FEBS J,2010,277:2-21.
[4]Aroor AR,James TT,Jackson DE,et al.Differential changes in MAP kinases,histone modifications,and liver injury in rats acutely treated with ethanol[J].Alcohol Clin Exp Res,2010,34:1543-1551.
[5]Delgoffe GM,Powell JD.mTOR:taking cues from the immune microenvironment[J].Immunology,2009,127:459-465.
[6]Lantier L,Mounier R,Leclerc J,et al.Coordinated maintenance of muscle cell size control by AMP-activated protein kinase[J].FASEB J,2010,24:3555-3561.
[7]Zoncu R,Efeyan A,Sabatini DM.mTOR:from growth signal integration to cancer,diabetes and ageing[J].Nat Rev Mol Cell Biol,2011,12:21-35.
[8]Smathers RL,Galligan JJ,Stewart BJ,et al.Overview of lipid peroxidation products and hepatic protein modification in alcoholic liver disease[J].Chem Biol Interact,2011,192:107-112.
[9]Whitehead JP.Diabetes:New conductors for the peroxisome proliferator-activated receptor γ (PPARγ)orchestra[J].Int J Biochem Cell Biol,2011,43:1071-1074.
[10]Kudo Y,Tanaka Y,Tateishi K,et al.Altered composition of fatty acids exacerbates hepatotumorigenesis during activation of the phosphatidylinositol 3-kinase pathway[J].J Hepatol,2011,55:1400-1408.

