CHD5基因慢病毒载体的构建及在结直肠癌细胞中的表达
赵 蕊,吕静野,严启滔,张 宝,郑文岭,马文丽*
(1.南方医科大学基因工程研究所,广东广州510515;2.华南基因组研究中心,广东广州510800)
细胞癌变为多种致癌因素共同作用、多种肿瘤相关基因参与的综合病变过程,本质上为细胞增殖与分化的失衡进而使细胞获得永生性及恶性表型。正是肿瘤这种特性,使得人们更积极的去认识肿瘤相关基因,进而将肿瘤治疗更加个体化。近年来研究表明[1]:CHD5 是抑癌调控系统的一个总开关,当其失去功能的时候,细胞内起抑癌作用的调控系统会被关掉。既往研究证实了这一点,在72 例卵巢癌患者中,有41%都出现了CHD5 的低表达,并且这些患者的生存和预后都较差[2],但是此基因在结直肠癌中却少有报道。本研究利用基因重组技术,将人全长CHD5 基因克隆至慢病毒质粒TREAutoR3上,构建TREAutoR3-CHD5 重组慢病毒表达载体,并制备高浓度的病毒颗粒,感染结直肠癌细胞系LOVO 并观察CHD5 基因表达情况。为研究CHD5基因在结直肠癌中的作用机制提供了依据。
1 材料与方法
1.1 材料
LOVO 细胞及包装质粒pCMV-VSV-G,pRSVRev,pMDLg-pRRE(南方医科大学基因工程研究所提供);慢病毒的四环素诱导表达载体TREAutoR3(Dr.Jurgen Seppen 惠赠)。T4 Ligase(Takara 公司);限制性内切酶Age Ⅰ、Nde Ⅰ和Phusion DNA polymerase(NEB 公司)。氯霉素、氨苄青霉素和强力霉素(Sigma 公司)。DNA 凝胶回收试剂盒、质粒小、中量抽提试剂盒和PCR 纯化试剂盒(QIAGEN公司),慢病毒滴度测定试剂盒(Lenti-XTMqRT-PCR Titration Kit,Clontech),细胞增殖检测试剂盒MTT(碧云天公司)。脂质体LipofecttamineTM2000 和大肠杆菌(Escherichia coli,E.coli)Stbl3(invitrogen 公司)。引物委托上海英骏生物公司合成。CHD5 cDNA clone(Open Biosystems)。
1.2 方法
1.2.1 CHD5 基因的提取:以pENTR-223.1-CHD5为模板,设计用于扩增全长CHD5 编码框的引物,并在上下游引物分别引入Age Ⅰ和Nde Ⅰ酶切位点。上游引物:5'-GGAATTAACCGGTCGCCACCATGCGG GGCCCAGTGG-3',下游引物:5'-GGAATTCCATATG TTAGATATCGGTCACATAGGGC-3'。PCR 反应体系:5 ×HF 缓冲液10 μL,dNTP(10 mmol/L)1 μL,前后引物各1 μL,模板pENTR-223.1-CHD5 3 μL,Phusion DNA 聚合酶0.5 μL,ddH2O 33.5 μL,总反应体积为50 μL。PCR 反应条件:98 ℃1 min,98 ℃5 s,60 ℃ 15 s,72 ℃ 2 min,30 个循环;72 ℃延伸10 min。PCR 产物用琼脂糖凝胶电泳检测。
1.2.2 慢病毒表达载体TREAutoR3-CHD5 重组质粒的构建与鉴定:将CHD5 的PCR 产物胶回收,CHD5 片段和TREAutoR3 载体分别进行双酶切(Age Ⅰ/Nde Ⅰ)并回收纯化酶切产物,然后利用T4 连接酶把酶切产物进行连接。将连接产物转化至Stbl3 感受态细胞中,挑取5 个单克隆进行酶切鉴定(Age Ⅰ/Nde Ⅰ)和测序分析。
1.2.3 慢病毒的包装与病毒滴度测定:将构建的穿梭质粒TREAutoR3-CHD5 与3 个包装质粒(pRsv-REV、pMDLg-pRRE 和PCMV-VSV-G)共转染293FT细胞,培养4 h后倒去培养基,加入不含抗生素的新鲜培养基(含10% FBS)培养48 h。4 000 ×g离心10 min去除细胞碎片,用0.45 μm滤膜过滤上清液,使用Plus-20 离心超滤装置对病毒液进行浓缩,操作按照MILLIPORE 的使用说明,浓缩后的病毒置于-80 ℃保存。利用慢病毒滴度测定试剂盒(Lenti-XTMqRT-PCR Titration Kit,Clontech)对TREAutoR3,TREAutoR3-CHD5 的病毒滴度进行测定。
1.2.4 重组慢病毒感染LOVO 细胞:在细胞培养瓶(75 cm2)中,接种1 ×106个LOVO 细胞,加入TREAutoR3 病毒上清稀释液(10 MOI)。混合均匀后放入CO2培养箱内感染24 h(37 ℃,5% CO2)。24 h后,移去TREAutoR3 病毒上清稀释液,加入第2种病毒(TREAutoR3,TREAutoR3-CHD5)上清稀释液,混合均匀后放入CO2培养箱内感染24 h(37 ℃,5% CO2)。24 h后,移去第2 种病毒上清稀释液,加入含强力霉素(1 mg/L)的l640 培养基(10%FBS,)诱导培养。其中TREAutoR3-CHD5 感染重复3 瓶。
1.2.5 实时荧光定量PCR 检测细胞中CHD5 基因在mRNA 水平的表达:按照Trizol 试剂说明书抽提细胞总RNA,按QuantiTect Rev.Transcription Kit 反转录试剂盒说明书进行反转录,进行实时荧光定量PCR 反应。QPCR 引物分别为:5'-TCCGCAAGCAGG TCAACTACA-3',5'-CTCATCCTCAGAGCCAATGGAA-3'。反应条件为:95 ℃预变性30 s,95 ℃5 s 60 ℃退火34 s,共40 个循环。
1.2.6 Western blot 检测细胞中CHD5 在蛋白质水平的表达:利用Western 及IP 细胞裂解液试剂盒(Beyotime)进行蛋白质样品制备,并参照BCA 蛋白浓度测定试剂盒说明书对蛋白质进行定量,每孔上样30 μg蛋白样品进行SDS-PAGE 电泳,电泳后利用电印记法将凝胶中的蛋白质转移到PVDF 膜上,封闭后分别加入一抗和HRP 标记的羊抗兔二抗,洗涤后,与ECL 试剂反应、处理、曝光,对蛋白质条带进行分析。
1.2.7 细胞增殖检测:选定与酶标仪匹配的96 孔培养板,每孔2 000 个LOVO 细胞,200 μL培养基。设置3 个复孔和无细胞培养基对照,加入病毒转染细胞,37 ℃培养细胞至合适的时间。每孔200 μL培养基加入20 μL MTT(5 g/L),37 ℃培养箱内继续孵育4 h 后,直接加入 Formazan 溶解液溶解formazan。在酶标仪上测定570 nm波长附近的吸光度值。
2 结果
2.1 TREAutoR3-CHD5 重组质粒的构建与鉴定
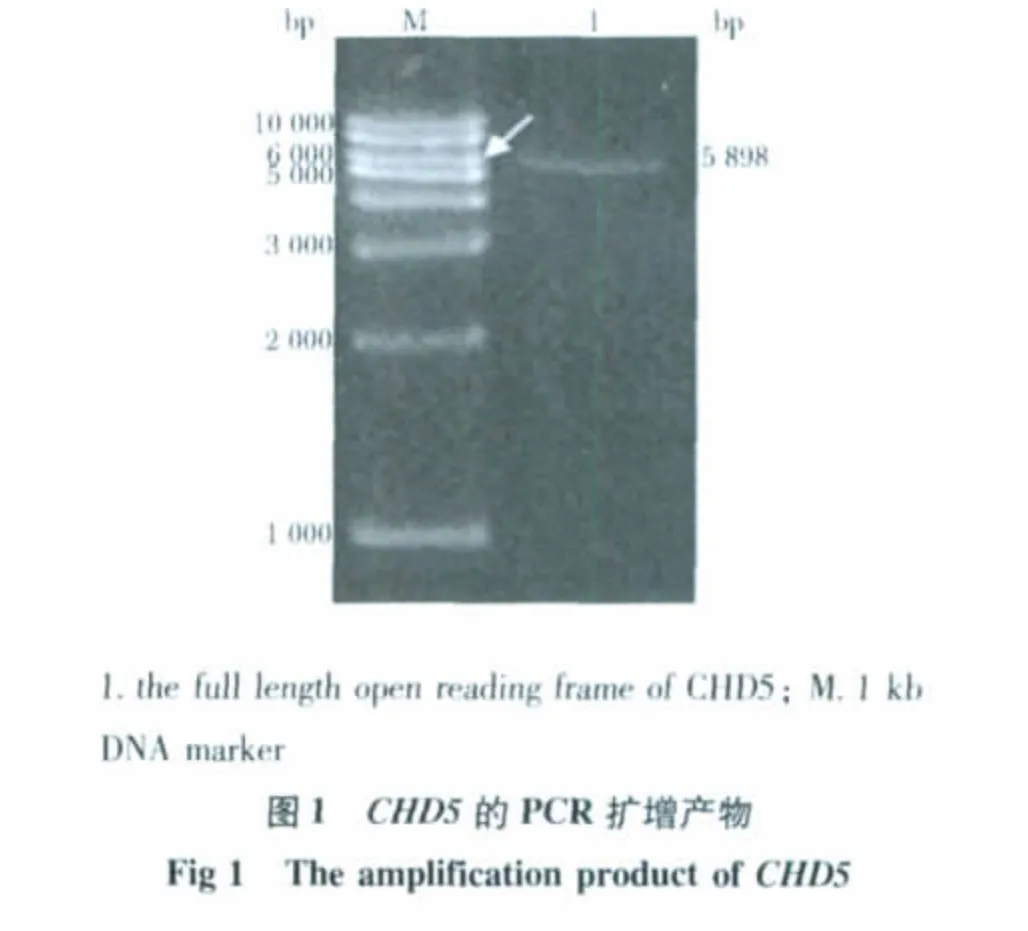
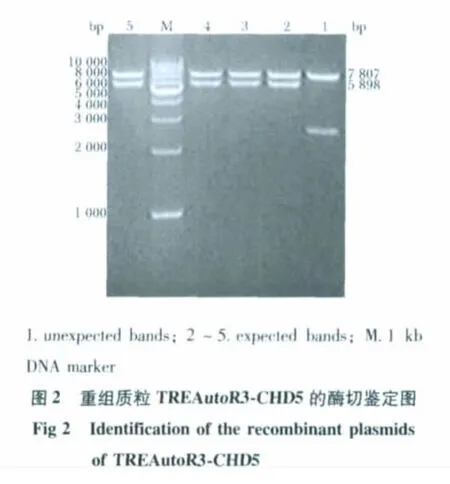
对PCR 产物进行琼脂糖凝胶电泳分析如图1,特异性扩增片段与预期的大小(5 898 bp)一致。对筛选出的TREAutoR3-CHD5 阳性克隆质粒,进行酶切鉴定(Age Ⅰ/Nde Ⅰ)和测序鉴定。结果如图2,其中2,3,4 和5 号克隆的酶切产物与预期大小一致,而1 号克隆考虑为非目标条带插入。测序鉴定结果表明,2 号克隆插入片段的序列与GenBank 人CHD5 cDNA (NM_015557)序列一致。
2.2 病毒滴度测定
LV-CHD5-1-clone,LV-CHD5-2-clone,LV-CHD5-3-clone 病毒滴度测试的结果分别为2.6 ×106,3 ×106和3.5 ×106,即每毫升病毒浓缩液中分别含有2.6 ×106,3 ×106和3.5 ×106个病毒颗粒。同法测得LV-NC 的滴度为1.2 ×107。
2.3 荧光定量PCR 检测结果
与阴性对照相比,共感染LV-CHD5 和LV-NC病毒的LOVO 细胞系中的CHD5 基因的mRNA 表达水平提高(图3)。
2.4 Western blot 检测结果
与阴性对照组相比,共感染LV-CHD5 和LV-NC病毒的LOVO 细胞系中的CHD5 基因的蛋白表达水平上升(图4)。
2.4 细胞增殖检测结果
与阴性对照相比,在强力霉素(DOX)诱导外源CHD5 基因表达96 h 后,共感染TREAutoR3 和TREAutoR3-CHD5 的LOVO 细胞的增殖降低(图5)。
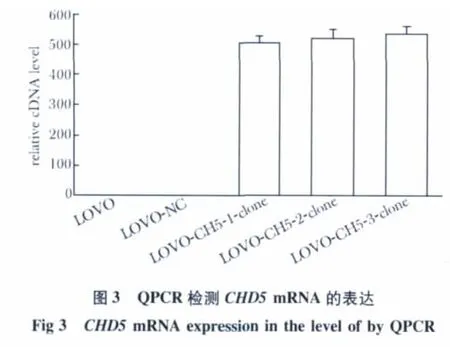
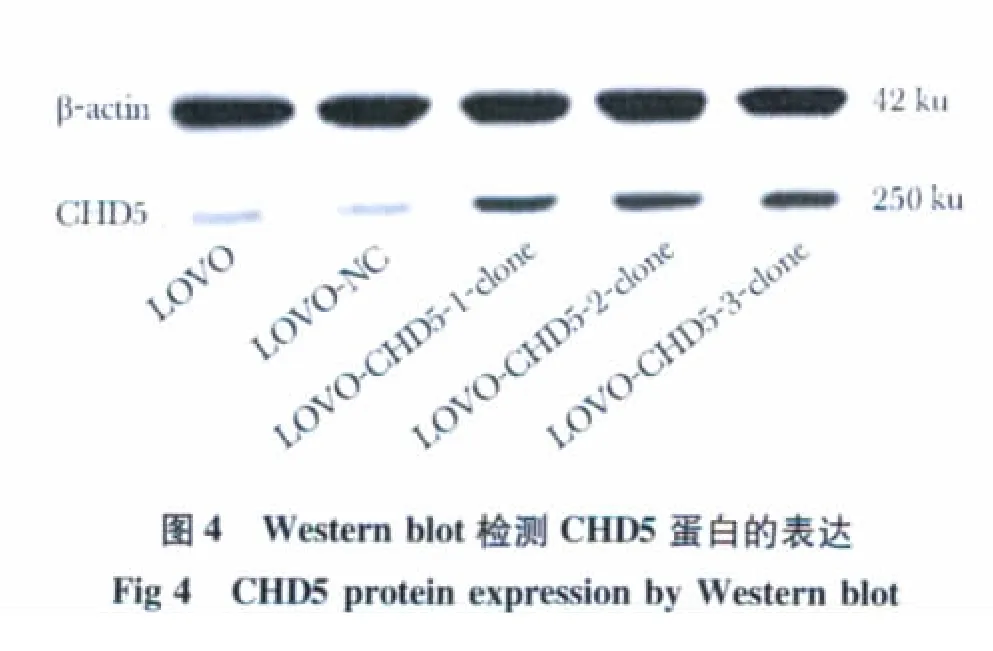
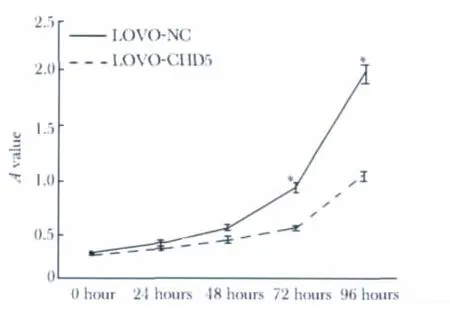
图5 CHD5 对LOVO 细胞增殖的影响Fig 5 The effect of CHD5 re-expression on proliferation
3 讨论
慢病毒载体是一种目前应用较多的目的基因转移工具,可容纳大片段的目的基因片段,具有体内表达稳定,安全性好等特点,可转染动物和人的原代细胞和细胞系[3]。本实验选用LOVO 细胞为研究对象,构建慢病毒载体质粒TREAutoR3-CHD5 与包装质粒一同转染293FT 细胞,获得的慢病毒颗粒成功转染LOVO 细胞,这为进一步了解CHD5 基因的功能及其在肿瘤中的作用提供了依据。同时,本研究证实与未转染CHD5 基因的阴性对照相比,CHD5的表达水平是明显上升的,并且感染后的LOVO细胞的增殖明显受到抑制。可见提高CHD5 表达水平能够对LOVO 细胞增殖产生明显的抑制作用。
既往研究中利用染色体工程技术构建了CHD5所在的基因组片段(1p36)缺失或获得的基因工程小鼠。敲除CHD5 基因的小鼠对致癌转化特别敏感,最终引发肿瘤[4]。这一研究阐述了CHD5 的肿瘤抑制机制——具有激活P19Arf/P53 信号传导通路的肿瘤抑制功能。最早报道的1p36(CHD5 所在的基因组片段)缺失是在神经母细胞瘤中,神经系统其他肿瘤也有陆续报道[5-7]。而在上皮系统肿瘤中(包括甲状腺肿瘤,子宫颈癌,及乳腺癌等[8-9])及造血系统肿瘤(如急性骨髓性白血病,慢性髓细胞性白血病和非Hodgkin 淋巴瘤[10-11])也偶有研究发现。
但是从这些研究中也有发人深省的问题,CHD5基因的抑癌作用是所有肿瘤特有还是在某种类型肿瘤中起主导作用呢?而提高它的表达是否能长期有效的抑癌或者很快被其他通路所取代?这将是我们下一步需要深入探索的问题。
[1]Bagchi A,Papazoglu C,Wu Y,et al.CHD5 is a tumor suppressor at human 1p36[J].Cell,2007,128,459-475.
[2]Wong RR,Chan LK,Tsang TP,et al.CHD5 downregulation associated with poor prognosis in epithelial ovarian cancer[J].Gynecol Obstet Invest,2011,72:203-207.
[3]Anthony RV,Cantlo n JD.RNA Interference:a new approach to the in vivo study o f gene function[J].J AnimSci,2007,85:118-119.
[4]Mills AA,Bradley A.From mouse to man:generating megabase chromosome rearrangements[J].Trends Genet,2001,17:331-339.
[5]Garcia I,Mayol G,Rodríguez E,et al.Expression of the neuron-specific protein CHD5 is an independent marker of outcome in neuroblastoma[J].Mol Cancer,2010,9:277-285.
[6]Potts RC,Zhang P,Wurster AL,et al.CHD5,a brainspecific paralog of Mi2 chromatin remodeling enzymes,regulates expression of neuronal genes[J].PLoS One,2011,6:2451-2455.
[7]Lang J,Tobias ES,Mackie R.Br J Preliminary evidence for involvement of the tumour suppressor gene CHD5 in a family with cutaneous melanoma[J].Dermatol,2011,164:1010-1016.
[8]Stein L,Rothschild J,Luce J,et al.Copy number and gene expression alterations in radiation-induced papillary thyroid carcinoma from chernobyl pediatric patients[J].Thyroid,2010,20:475-487.
[9]Muthuswamy SK.A New Tumor Suppressor That Regulates Tissue Architecture[J].PLoS Med,2009,6:173-177.
[10]Mori N,Morosetti R,Mizoguchi H,et al.Progression of myelodysplastic syndrome:allelic loss on chromosomal arm 1p[J].Br J Haematol,2003,122:226-230.
[11]Phan TX,Hoang AV,Huynh VM,et al.Unique secondary chromosomal abnormalities are frequently found in the chronic phase of chronic myeloid leukemia in southern Vietnam[J].Cancer Genet Cytogenet,2006,168:59-68.

