促红细胞生成素抑制大鼠体外循环术致急性肾损伤时NF-κB P65和ICAM-1表达
黄海嵘,王高明,刘小龙,申 翼 ,王常田,李德闽,景 华
(南京大学医学院临床学院南京军区南京总医院心胸外科,江苏南京210002)
急性肾损伤是体外循环引起的常见并发症之一,延缓患者术后恢复[1]。近年研究表明,体外循环后肾脏局部中性粒细胞聚集,继而大量细胞因子释放,引起肾功能损伤,因而中性粒细胞的逸出是体外循环后肾损伤的重要环节[2]。而血管内皮细胞表面的ICAM可与中性粒细胞表面的整合素结合,使其固着于局部血管内皮,发生铺展,进而分泌水解酶而穿出脉管壁。而ICAM的表达水平又受 NF-κB的调控[3-4]。因此,在体外循环后急性肾损伤的病理生理过程中,NF-κB和ICAM的表达水平决定了损伤的严重程度,而抑制其表达则将起到减轻损伤的作用。目前临床上主要用治疗肾性贫血以及其他原因造成贫血的促红细胞生成素(erythropoietin,EPO),还有抗氧化、抗凋亡、调节炎性反应等作用[5]。本实验建立大鼠CPB模型,观察EPO干预后大鼠肾功能及组织病理学改变,及肾组织中NF-κB P65、ICAM-1表达水平的变化及其可能机制。
1 材料与方法
1.1 实验动物及分组
清洁级雄性SD大鼠30只,体质量 (500±50)g,南京军区南京总医院比较医学科[许可证SYXK(军)2007-029]。大鼠随机分为3组(每组n=10):sham、CPB和EPO组。sham组常规行动静脉穿刺、面罩给氧,肝素化等CPB建模操作,不进行CPB,其余2组建立CPB,EPO组于转流前在预充液中加入3 000 U/kg的 EPO,流量逐步调至[≥100 mL/kg·min]维持1 h。
1.2 CPB模型制备
按照Dong等[6]的方法建立大鼠 CPB模型。术中密切监测动脉血压、心率、血氧及肛温等。
1.3 标本处理
分别于肝素化后转流前(T0)和转流结束后(T1)、0.5(T2)、1(T3)、2(T4)和24 h(T5)由右股动脉采血1 mL,离心后取血浆样本于-70℃下保存备检。术后24 h再次麻醉大鼠取双侧肾脏,0.9%氯化钠注射液冲洗干净后右侧肾脏立即-70℃下保存,左侧肾脏固定于10%中性甲醛溶液中保存。
1.3.1 肾脏组织HE染色光镜观察及测定血清肌酐水平:光镜下观察肾小球、肾小管-间质的病理变化及炎性细胞浸润等情况。使用全自动生化分析仪(Hitachi-917,Japan)检测血清肌酐水平。
1.3.2 免疫组化检测肾组织中NF-κB P65蛋白含量:采用免疫组化SP法,参照试剂盒说明书操作,以肾实质细胞内出现棕褐色颗粒为阳性表达。应用Image-Pro Plus 6.0专业图像分析系统软件,测定免疫组化反应阳性颗粒的平均吸光度A值,对NF-κB P65活化蛋白表达做半定量分析。
1.3.3 Western blot方法检测肾组织中ICAM-1蛋白含量:取0.1 g深低温保存肾组织,加入1 mL裂解缓冲液,离心提取总蛋白,进行蛋白定量。取50μg蛋白样品经SDS-聚丙烯酰胺凝胶电泳分离、转膜及封闭后,分别加入羊抗大鼠ICAM-1多克隆抗体、兔抗大鼠β-actin多克隆抗体,4℃孵育过夜,加入碱性磷酸酶标记的二抗,室温孵育2 h,酶法显色,扫描。采用Scion Image图象分析系统分析,以目的产物与β-actin吸光度值的比值(±s)反映ICAM-1蛋白表达水平。
1.4 统计学分析
使用SPSS13.0统计软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组均数比较用单因素方差分析,两两比较进行组间方差齐性检验。
2 结果
2.1 EPO对肾功能的影响
术后各时间点,CPB组血清肌酐水平明显高于sham组(P<0.05);EPO组较CPB组显著下降(P<0.05)(表1)。
2.2 肾脏组织病理学观察
CPB 组肾小管上皮及肾小球毛细血管内皮细胞明显肿胀,管腔变窄或闭合,有炎性细胞浸润,肾间质血管扩张充血,肾小球及球后毛细血管内存积有成堆的结构破坏的红细胞及血红蛋白,呈明显的组织损伤特征,EPO组较CPB组炎性细胞浸润及肾组织损伤程度明显减轻,而sham组肾小球及肾小管结构基本完整(图1)。
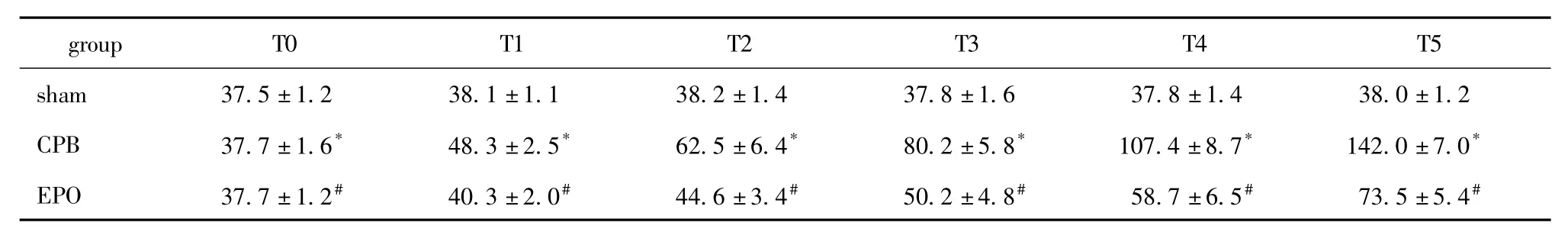
表1 3组不同时相Scr水平Table 1 Serum creatinine levels at different time in each group
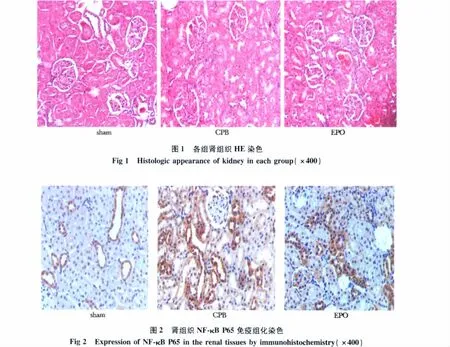
2.3 EPO对肾组织中NF-κB P65蛋白表达和分布的影响
在sham组见少量NF-κB P65阳性表达,但CPB组在肾小管上皮细胞高度表达,亦表达于血管内皮细胞,表现为胞核上不均匀的黄褐色颗粒状物,EPO干预后阳性细胞表达明显减少(图2);CPB组NF-κB P65吸光度值(A值)(0.189±0.009)明显高于sham组(0.140±0.013)(P<0.05),EPO组(0.152±0.004)较CPB组显著下降(P<0.05)。
2.4 EPO对肾脏组织ICAM-1蛋白表达的影响
CPB组ICAM-1表达为1.05±0.23明显高于sham组的0.15±0.03(P<0.05),EPO组干预后回降至0.56±0.13(P<0.05)(图3)。
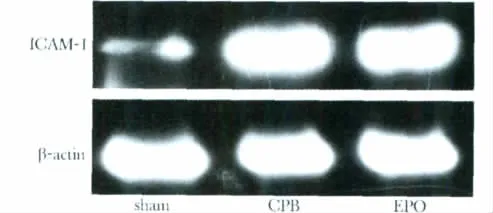
图3 各组肾组织ICAM-1蛋白表达Fig 3 W estern blot analyses of ICAM-1 proteins in the renal of rats.
3 讨论
文献 [1,7]报道,CPB术后肾功能不全的发生率在7%~40%之间,急性肾功能衰竭的发生率在1%~10%之间,一旦发生急性肾衰,患者术后死亡率明显升高,尤其是需要透析治疗的病例,死亡率高达40%~80%。研究表明,在体外循环过程中,血液成分与非生理界面接触、非生理搏动血流造成的脏器低灌注等,引起了炎性介质的释放,继而导致在脏器组织局部大量中性粒细胞聚集、激活,释放炎性因子、趋化因子及蛋白酶等物质,造成脏器损伤[8]。
ICAM-1,即CD54,属于免疫球蛋白超家族(Igsuperfamily,Ig-SF),其配体为中性粒细胞表面的整合素。在中性粒细胞进入组织基质的过程中,血管内皮细胞表面的P选择素与E选择素与中性粒细胞表面的L选择素识别,使其运动速度减慢而形成滚动状态,血管内皮细胞表面的I-CAM-1再与中性粒细胞表面的整合素结合,使中性粒细胞固着于局部的血管内皮,并发生铺展,进而分泌水解酶而穿出脉管壁,进入基质,造成损伤[9]。而 NF-κB 则是ICAM-1表达的上游调控因子[10]。
以往对体外循环后脏器损伤研究的重点是如何减轻炎性因子及活性氧自由基等中性粒细胞产物对组织的损伤[11],本实验选择了重组人促红细胞生成素 (rHuEPo)作为干预药物,着眼于在体外循环的早期即抑制中性粒细胞逸出。实验发现,体外循环术后大鼠血清肌酐水平明显上升,肾组织形态学改变,中性粒细胞在肾组织间质中的聚集更提示其与体外循环后相关损伤的关系,而在EPO处理组,血清肌酐水平及肾脏组织形态学表现均提示组织损伤减轻,尤其是组织中炎性细胞减少。说明EPO确能有效减轻CPB造成的肾脏损伤,检测NF-κB P65蛋白表达,提示 CPB组大鼠肾组织NF-κB P65蛋白表达活性明显增高,而使用EPO,NF-κB P65表达水平被抑制,同样,ICAM-1蛋白表达,也呈现出CPB组相应升高,而EPO组则显著下降。从而证实,EPO能同时抑制大鼠肾组织中NF-κB的活性,减少ICAM-1的表达,进而减少中性粒细胞逸出及其造成的损伤,最终达到保护肾脏的作用。
综上所述,EPO可减轻体外循环术后大鼠肾脏损伤,其机制与其抑制 NF-κB P65激活,减少ICAM-1表达有关。
[1] Provenchere S,Plantefeve G,Hufnagel G,et al.Renal dysfunction after cardiac surgery with normothermic cardiopulmonary bypass:incidence,risk factors,and effecton clinical outcome[J].Anesth Analg,2003,96:1258 -1264.
[2]Singbartl K,Ley K.Leukocyte recruitment and acute renal failure[J].JMol Med(Berl),2004,82:91 -101.
[3]张红,李学忠,白龙梅,等.脂多糖通过NF-κB途径调节大鼠星形胶质细胞Toll样受体表达[J].基础医学与临床,2010,30:1206-1209.
[4]王燕飞,唐朝枢,杜军保.硫化氢抑制apoE基因敲除小鼠动脉粥样硬化中ICAM-1的表达[J].基础医学与临床,2009,29:19-23.
[5]Patel NS,Sharples EJ,Cuzzocrea S,et al.Pretreatment with EPO reduces the injury and dysfunction caused by ischemia/reperfusion in the mouse kidney in vivo[J].Kidney Int,2004,66:983 -989.
[6]Dong GH,Wang CT,Li Y,et al.Cardiopulmonary bypass induced microcirculatory injury of the small bowel in rats[J].World JGastroenterol,2009,15:3166 -3172.
[7]Thakar CV,Arrigain S,Worley S,etal.A clinical score to predict acute renal failure after cardiac surgery[J].JAm Soc Nephrol,2005,16:162 -168.
[8]de Mendonca-Filho HT,Gomes RV,de Almeida Campos LA,et al.Circulating levels of macrophage migration inhibitory factor are associated with mild pulmonary dysfunction after cardiopulmonary bypass[J].Shock,2004,22:533-537.
[9]Singbartl K,Ley K.Leukocyte recruitment and acute renal failure[J].JMol Med(Berl),2004,82:91 -101.
[10]Fotis L,Agrogiannis G,Vlachos Is,et al.Intercellular Adhesion Molecule(ICAM)-1 and Vascular Cell Adhesion Molecule(VCAM)-1 at the Early Stages of Atherosclerosis in a Rat Model[J].In Vivo,2012,26:243 -250.
[11]王常田,申翼,钱雅君,等.心肺转流对大鼠血浆和肺内基质金属蛋白酶-9的影响[J].医学研究生学报,2011,24:242-245.

