HCV核心蛋白抑制SFRP1基因启动子活性
权会琴,聂 丹,周 帆,陈林林,陈庆美,单晓亮,谢 青,唐 霓
(重庆医科大学感染性疾病分子生物学教育部重点实验室重庆,400016)
核心蛋白是丙型肝炎病毒(hepatitis C virus,HCV)编码的一种多功能蛋白,通过激活多种信号通路,与原癌基因直接作用或者干扰机体免疫防御功能,参与HCV 相关肝病,如肝癌的发生[1-2]。然而,丙型肝炎病毒核心蛋白(hepatitis C virus core protein,HCV Core)是如何诱导肝细胞肝癌(Hepatocellular Carcinoma,HCC)的发生至今未完全阐明。
研究表明,50% 以上HCC 的发生与Wnt/β-catenin信号通路的异常活化有关,其中Wnt 拮抗分子分泌卷曲相关蛋白家族(SFRPs)的表达失活与肿瘤的发生密切相关。分泌型卷曲相关蛋白1(SFRP1)是SFRP 家族(SFRP1,2,3,4,5)成员之一,含有N 端半胱氨酸富集结构域(CRD),该结构域与Wnt 受体Fzd 具有高度同源性,SFRP1 通过此结构域竞争性地与Fzd 受体结合Wnt 蛋白,抑制Wnt 信号通路的活化[3]。本研究旨在探讨HCV Core 能否通过抑制SFRP1 启动子活性引起SFRP1 表达的下降。
1 材料与方法
1.1 主要材料
人胚肾细胞HEK293 和人肝癌细胞系SK-Hep1(均本实验室保存)培养于含10%胎牛血清(Gibco公司)、1 ×105U/L 青霉素及100 mg/L 链霉素的DMEM 培养基(Hyclone 公司)中,37 ℃、5% CO2条件下常规培养。GFP 对照腺病毒(AdGFP)及HCV核心蛋白的腺病毒(AdCore)为本实验室保存。荧光素酶报告载体pGL3-Basic 质粒以及内参质粒pRL-TK 为本实验室保存。DH5α 菌种为本实验室保存。
1.2 主要试剂
限制性内切酶(Kpn Ⅰ和Hind Ⅲ)、T4 DNA 连接酶和双荧光素酶检测试剂盒(Promega 公司),脂质体2000(Invitrogen 公司)。
1.3 重组质粒的构建
提取Huh7 细胞基因组,分别用PCR 扩增SFRP1 启动子序列(-407 ~-27 bp,-837 ~-27 bp,-1 202 ~-27 bp,-1 619 ~-27 bp,-2 029 ~-27 bp),PCR 反应条件为:95 ℃4 min,98 ℃20 s,最适退火温度(表1),72 ℃15 s,30 个循环,72 ℃5 min 将不同片段PCR 产物及pGL3-Basic 载体采用Kpn Ⅰ和Hind Ⅲ双酶切,T4 DNA 连接酶连接,连接产物转入DH5α,提取质粒经双酶切初步鉴定后送去测序确证。引物序列及退火温度见表1。

表1 SFRP1 启动子序列扩增引物及退火温度Table 1 Primers and annealing temperature of SFRP1 promoter
1.4 重组质粒的转染
细胞以1.5 ×104细胞数铺于60 mm培养皿,待细胞贴壁后进行转染。实验共分为6 组,命名为:1)pGL3-Basic;2)pGL3-S1(-407 ~-27 bp);3)pGL3-S2(-837 ~-27 bp);4)pGL3-S3(-1 202 ~-27 bp);5)pGL3-S4(-1 619 ~-27 bp);6)pGL3-S5(-2 029~-27 bp)。各组均以pRL-TK 质粒作为内参对照,脂质体2000 和质粒之间的比例为15 μL∶3 μg,待测质粒和内参质粒之间的比例为4∶1,质粒转染48 h后裂解细胞测启动子活性,每次实验各组均设3 个复孔,实验重复3 次。
1.5 病毒感染滴度的确定
AdCore 与AdGFP 均含有GFP 报告基因[1],通过荧光显微镜观察绿色荧光表达,可观察腺病毒的感染效率。将SK-Hep1 细胞以40%的密度接种于24 孔板,病毒感染后24 h观察荧光以确定AdGFP、AdCore病毒用量。
1.6 荧光素酶活性检测
分别将上述5 个截短报告质粒与pRL-TK 共转染HEK293 细胞,同时设置pGL3-Basic 为阴性对照组,测定报告质粒活性。按照Promega 公司双荧光素酶检测试剂盒说明书进行,1 ×PBS 洗细胞2 次,加入100 μL 1 ×细胞裂解液裂解细胞,裂解产物转入1.5 mL离心管中,14 000 r/min离心1 min,收集上清,进行荧光素酶活性检测,实验结果以虫荧光素酶活性与海肾荧光素酶活性之比表示荧光素酶活性,此值与pGL3-Basic 组之比表示相对荧光强度。
1.7 抑制作用的检测
将上述5 个截短报告质粒与阴性对照分别转染SK-Hep1 细胞,同时共转染pRL-TK 质粒,细胞转染后24 h将细胞重铺于24 孔板,用腺病毒AdGFP、Ad-Core 有效感染上述细胞,24 h后进行荧光素酶活性检测。
1.8 统计学分析

图1 重组质粒pGL-S1 ~S5 双酶切鉴定结果Fig 1 Identification of recombinant plasmids,pGL3-S1 ~S5,with Kpn Ⅰ& Hind Ⅲdigestion
2 结果
2.1 重组质粒的鉴定
提取肝癌细胞系Huh7 细胞基因组,PCR 扩增SFRP1 启动子区不同截短突变,分别命名为:pGL3-S1
2.2 不同长度SFRP1 启动子区活性的比较
结果显示(图2):在-407 ~-27 bp片段启动子活性最高。与pGL3-Basic 对照组相比较,相对荧光素酶活性增加了37.31 ± 4.45 倍(P<0.01),pGL3-S2 ~S5 的活性分别增加了28.74 ± 2.47、13.56 ±2.52、12.97 ±0.87 和8.29 ±0.09 倍(P<0.01)。
2.3 AdGFP 及AdCore 对SK-Hep1 细胞的感染效率的鉴定
腺病毒GFP、Core 能够有效感染SK-Hep1 细胞(图3)。
2.4 AdCore 对SFRP1 启动子区活性的抑制作用
抑制作用结果如下(图4):SFRP1 启动子区域-407 ~-27 bp片段启动子活性最高,腺病毒Ad-Core 感染后,与对照组相比,该启动子片段活性明显下降,下降了63.8% ±1.0% (P<0.01)。Ad-Core 抑制pGL3-S2 启动子活性下降了45.7% ±1.5% (P<0.01)。
3 讨论
HCV感染是我国慢性病毒性肝炎的主要病因之一,可导致肝硬化及肝癌等严重后果,其中,核心蛋白的生物学功能最为广泛和重要。近年来大量研究表明,HCV Core 除了包装病毒正链RNA 外,还能与细胞内多种信号系统的蛋白作用,如激活NFκB 通路,增强TNF-α 转录活性,活化MAPK/ERK 通路刺激细胞增殖[4];此外,通过激活细胞内重要信号通路Wnt/β-catenin,参与细胞异常增殖和分化。

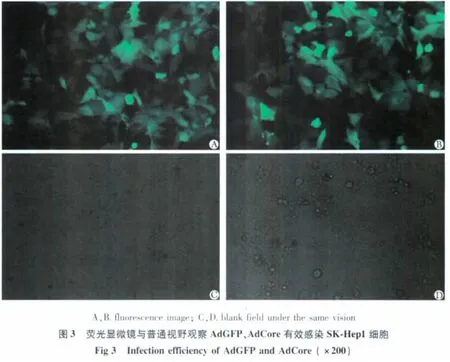
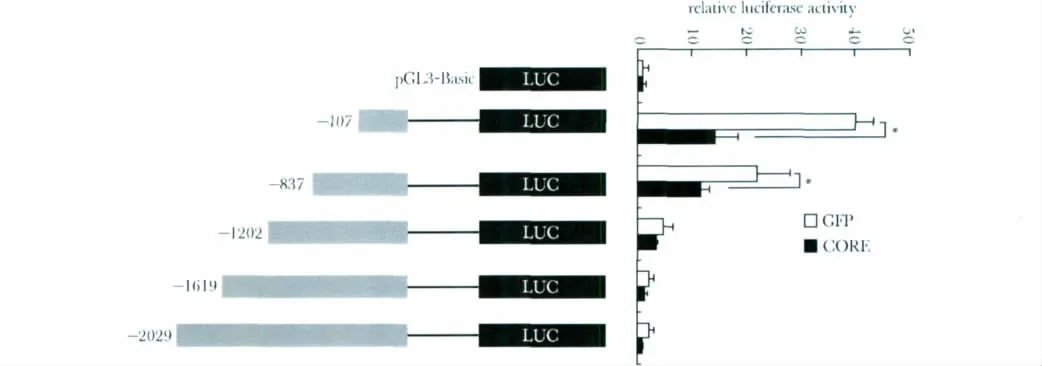
图4 HCV 核心蛋白对SFRP1 启动子区活性的抑制作用Fig 4 Inhibitory effects of HCV Core protein on SFRP1 promtor activity
Wnt/β-catenin 信号通路的异常活化在肿瘤的发生发展中起重要的作用,SFRP1 作为此信号通路的抑制分子,其抑癌基因功能已经得到证实。本研究旨在探讨HCV 核心蛋白对Wnt 信号通路抑制分子SFRP1 启动子活性的影响,将SFRP1 启动子5'侧翼5 个不同片段构建重组质粒,转入HEK293 细胞和SK-Hep1 细胞,测定启动子活性。结果表明,-407 ~-27 bp活性在这两种细胞均最强,说明在此区域可能存在重要的顺式作用元件,使得启动子的活性明显高于其他区域。AdCore 腺病毒感染SK-Hep1细胞,-407 ~-27 bp启动子活性明显下降,表明HCV Core 能够抑制SFRP1 启动子活性。
研究发现,Wnt 信号通路抑制分子启动子区的高度甲基化引起的基因沉默与许多恶性肿瘤的发病机制和进展有着密切的关系[5-7],如肺癌、胃癌等。在结直肠癌和腺瘤中,SFRP1 基因呈高甲基化状态,在3 个结直肠癌细胞系中均存在基因的失活,有效去除基因甲基化后能恢复该基因的转录[8]。当SFRP1 基因启动子区CpG 岛出现高甲基化,不能顺利启动基因转录,SFRP1 合成受阻,无法阻抑Wnt蛋白与Fzd 受体结合,使Wnt 信号传导激活下游靶基因如癌基因c-Myc 和cylinD1 等[9-10],导致细胞增生凋亡失调。HCV Core 是否能够引起SFRP1 启动子区高度甲基化进而抑制启动子区活性,引起SFRP1 表达的下调,导致HCC 的发生,有待进一步验证。
[1]Liu J,Ding X,Tang J,et al.Enhancement of canonical Wnt/β-Catenin signaling activity by HCV core protein promotes cell growth of hepatocellular carcinoma cells[J].PloS One,2011,6:e27496.
[2]Jahan S,Ashfaq UA,Khaliq S,et al.Dual behavior of HCV Core gene in regulation of apoptosis is important in progression of HCC[J].Infect Genet Evol,2012,12:236-239.
[3]Bovolenta P,Esteve P,Ruiz JM,et al.Beyond Wnt inhibition:new functions of secreted Frizzled-related proteins in development and disease[J].J Cell Sci,2008,121:737-746.
[4]Aravalli RN,Steer CJ,Cressman EN.Molecular mechanisms of hepatocellular carcinoma[J].Hepatology,2008,48:2047-2063.
[5]Yu J,Tao Q,Cheng YY,et al.Promoter methylation of the Wnt/beta-catenin signaling antagonist Dkk-3 is associated with poor survival in gastric cancer[J].Cancer,2009,115:49-60.
[6]Uhm KO,Lee ES,Lee YM,et al.Differential methylation pattern of ID4,SFRP1,and SHP1 between acute myeloid leukemia and chronic myeloid leukemia[J].J Korean Med Sci,2009,24:493-497.
[7]Moskalev EA,Luckert K,Vorobjev IA,et al.Concurrent epigenetic silencing of Wnt/beta-catenin pathway inhibitor genes in B cell chronic lymphocytic leukaemia[J].BMC Cancer,2012,12:213.
[8]Shen JZ,Xu CB,Fu HY,et al.Methylation of secreted frizzled related protein gene in acute leukemia patients in China[J].Asian Pacific J Cancer Prev,2011,12:2617-2621.
[9]Feng Q,Stern JE,Hawes SE,et al.DNA methylation changes in normal liver tissues and hepatocellular carcinoma with different viral infection[J].Exp Mol Pathol,2010,88:287-292.
[10]Foltz G,Yoon JG,Lee H,et al.Epigenetic regulation of wnt pathway antagonists in human glioblastoma multiforme[J].Genes & Cancer,2010,1:81-90.

