中链脂肪酸对高脂肪饲料诱导的肥胖C57BL/6J小鼠脂肪组织中转录因子的影响
刘英华,张 永,徐 庆,于晓明,张新胜,王 觐,杨雪艳,薛长勇
解放军总医院 营养科,北京 100853
肥胖是全世界面临的公共健康问题,也是我国面临的一个严重的公共健康问题[1]。通过减轻体重改善机体脂代谢,进而预防一系列并发症尤其是心血管并发症发生,将对提高人们生活质量,促进人类健康具有重大意义。我们的前期研究结果表明适量食用中链脂肪酸油脂(medium-chain triglyceride,MCT)可降低高甘油三酯血症人群体重,减少体脂肪量,改善其血脂和脂蛋白水平[2-3],同时发现中链脂肪酸可能通过增强脂肪组织甘油三酯酯酶(adipose triglyceride lipase,ATGL)和激素敏感酯酶(hormone-sensitive lipase,HSL)的表达活性和水平,加速体内脂肪动员,进而促进脂肪组织分解,降低肥胖者体重[4-5]。为进一步探讨中链脂肪酸降低体重的机制,本研究进行了脂肪细胞分化过程中相关转录因子的测定。
材料和方法
1 实验动物及肥胖模型的建立 SPF级健康雄性4~5周龄C57BL/6J小鼠100只,由中国医学科学院实验动物研究所提供,许可证号SCXK京2009-0007。由普通饲料适应喂养1周后,随机选取15只继续喂养普通饲料,余85只给予高脂饲料喂养。4周后,按空腹体质量,从高脂饲料组选取体质量高于普通饲料喂养组小鼠体质量10%的个体,组成肥胖模型。
2 饲料配方及动物分组 基础饲料参照AIN-96G配制,高脂饲料在基础饲料基础上添加10%猪油、10%蛋黄粉,均由中国医学科学院实验动物研究所提供,许可证号SCXK京2009-0008,并经60Co辐照灭菌,-20 ℃保存。30只C57BL/6J肥胖小鼠按空腹体质量随机分为两组,每组15只,分别给予含有2%中链脂肪酸(medium-chain fatty acid,MCFA)和2%长链脂肪酸(long-chain fatty acid,LCFA)的高脂饲料喂养,共12周。研究用脂肪酸组成、干预饲料配方及营养素组成参见作者博士毕业论文[6](营养素组成为北京营养源研究所检测提供的结果)。
3 实验主要仪器及试剂 万分之一电子天平(FA-N型):中国民桥公司;酶标仪(航新ZS-2SWK),DY89-1型电动玻璃匀浆器(新芝公司),台式高速冷冻离心机(TGL-16):中国湘仪(湖南湘潭)集团;荧光定量PCR检测系统(Line-gene):中国博日(江苏杭州)科技有限公司;紫外分光光度计(UV-2000):中国尤尼柯(上海)仪器有限公司;小牛血清白蛋白购自华美生物工程公司,BCA蛋白浓度检测试剂盒购自美国Pierce公司,Cat.No.23225;ELISA检测试剂盒均购自中国上海BlueGene公司,Cat No.分别为:过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ,PPAR-γ):E01P0045,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α):E03T0008。核糖核酸(RNA)提取试剂盒,逆转录-PCR(RT-PCR)试剂盒购自美国Promega公司;Trizol、M-MLV逆转录酶购自美国Invitrogen公司;Taq DNA聚合酶、三磷酸脱氧核苷酸(dNTP)以及核糖核酸酶抑制剂购自宝生物工程(大连)有限公司(Takara);反转录第一条互补脱氧核糖核酸(cDNA)链合成试剂盒由尚柏生物医学技术(北京)有限公司提供。其他试剂为进口分析纯试剂。
4 小鼠体质量、肝脏质量及体脂肪质量测定 实验小鼠于研究结束前一夜禁食不禁水,第2天清晨进行小鼠空腹体质量称量并记录。同时进行体长测量,并计算Lee's指数,体质量指数(body mass index,BMI),体重增长值。计算公式为: Lee's指数=体长(cm);BMI(kg/m2)=体重(kg)/[体长(m)]2;体重增长值(g)=12周时小鼠体质量-12周前小鼠体质量。小鼠处死,立即分离肝脏,肠系膜周围脂肪组织、左右双侧附睾周围脂肪组织及左右双侧肾周脂肪组织,用滤纸吸干组织液后,用万分之一电子天平分别称质量,并计算脂体比,即脂肪系数。脂体比(%,脂肪系数)=(肠系膜+双侧附睾+双侧肾周围脂肪垫总质量/小鼠体质量)×100%。
5 小鼠脂肪组织中TNF-α及PPAR-γ测定取小鼠附睾周围脂肪组织,一部分立即放于液氮中备检mRNA,另一部分用0.9%氯化钠注射液按10%浓度制作匀浆,700 g/min离心15 min,去除沉淀,取上清液,BCA法测定蛋白质浓度,采用ELISA方法,按照TNF-α和PPAR-γ测定试剂盒操作说明书进行检测。
6 小鼠脂肪组织中PPAR-γ、甾醇调控元件结合蛋白-1(sterol regulatory element-binding protein-1,SREBP-1)和CCAAT/增强子结合蛋白(CCAAT enhancer binding protein-α,C/EBP-α)的mRNA表达测定 每组随机选取6个样本进行测定。首先按Trizol试剂的使用操作步骤,从约100 mg脂肪组织中提取总RNA。以总RNA 3 μg为逆转录反应模板,采用随机引物,按照反转录试剂盒的操作说明在普通PCR仪上进行逆转录,合成第一条cDNA链,总的反应体积是25 μl。再以2 μl逆转录反应产物为模板,按照荧光实时定量PCR试剂盒的说明,冰上配置50 μl的PCR反应体系。引物序列见表1。实时定量PCR扩增条件:95 ℃预变性120 s后,进行95 ℃变性20 s,59 ℃退火25 s,72 ℃延伸30 s(此阶段采集荧光信号),45个循环。目的基因表达采用Ct值法,即根据各样品基因扩增过程中荧光信号强度达到临界阈值所需要的循环数(threshold cycle,Ct)来比较各样品目的基因mRNA表达的丰度。表示方法为2-△△Ct,即为2△Ct(actin)-△Ct(target gene)。

表1 引物序列Tab. 1 Sequences of primers for RT-PCR
7 数据处理及分析 所有数据均采用-x±s表示。采用SPSS17.0统计软件包进行数据处理,两组之间比较采用成组设计的t检验,P<0.05为差异有统计学意义。
结 果
1 小鼠肥胖模型的建立及体质量、体脂肪质量的变化 实验开始时小鼠体质量平均为(15.97±0.45) g,4周后,普通饲料组小鼠体质量为(21.28±0.96) g,高脂饲料组有48只小鼠体质量高于普通饲料组10%以上,平均为(24.40±0.47) g,肥胖率56.47%。随机选取30只,分为2组,喂饲干预饲料12周后,MCFA组小鼠体质量、体长、Lee's指数、BMI、体重增长值、肝脏质量、肾周脂肪质量、附睾周脂肪质量和体脂比均显著低于LCFA组(P<0.05),仅肠系膜周围脂肪质量两组之间比较,差异无统计学意义(P>0.05)。见表2[6]。
2 脂肪组织中TNF-α、PPAR-γ水平及PPAR-γ、SREBP-1和C/EBP-α的mRNA表达变化 MCFA组C57BL/6J小鼠脂肪组织TNF-α水平、SREBP-1和C/EBP-α的mRNA表达量均显著低于LCFA组(P<0.05),PPAR-γ水平及mRNA表达量两组之间比较无统计学差异(P>0.05)。见表3和图1。
讨 论
本课题组前期进行的关于MCFA的临床研究选择的受试对象是高甘油三酯血症人群,由于动物的单纯高甘油三酯血症模型针对性较强,主要用于药物研发和代谢的实验研究,且单纯的高甘油三酯血症动物的体重和体脂肪不一定增多,而我们的临床研究结果显示,MCFA对超重人群调节脂代谢的作用效果更显著,为此我们建立肥胖的C57BL/6J小鼠动物模型,观察长期喂饲含有MCFA的饲料后的体重等变化。结果显示,喂饲MCFA组的小鼠在12周后,体质量、体长、Lee's指数、BMI、肝脏质量、各部分体脂肪质量等均显著低于LCFA喂养组(P<0.05),与前期进行的临床和基础研究结果一致[2-3,7-8]。这为进一步的机制研究奠定了基础。
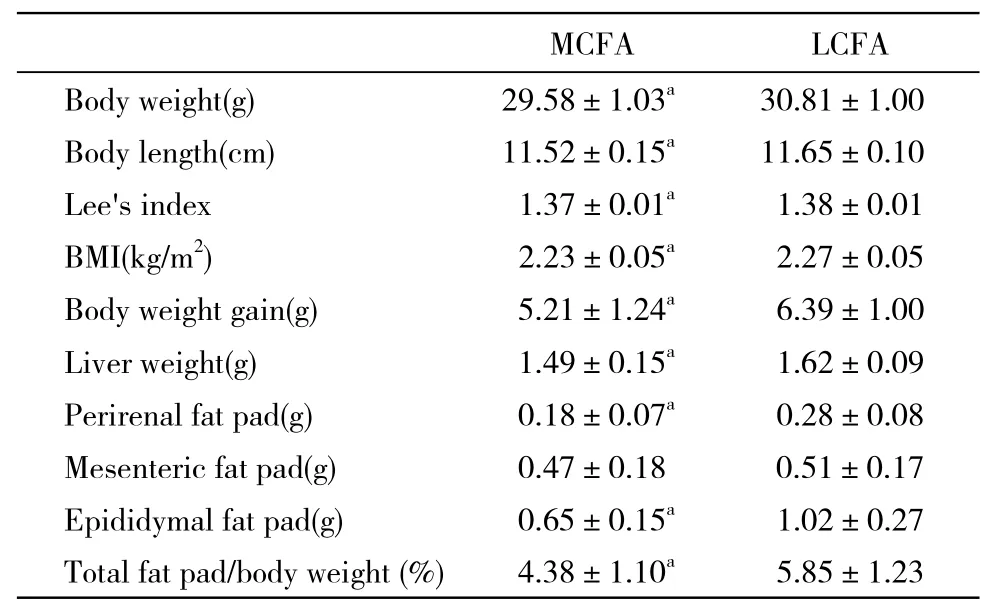
表2 小鼠体质量和体脂肪质量变化Tab. 2 BMI and BFI of C57BL/6J mice(-x±s, n=15)
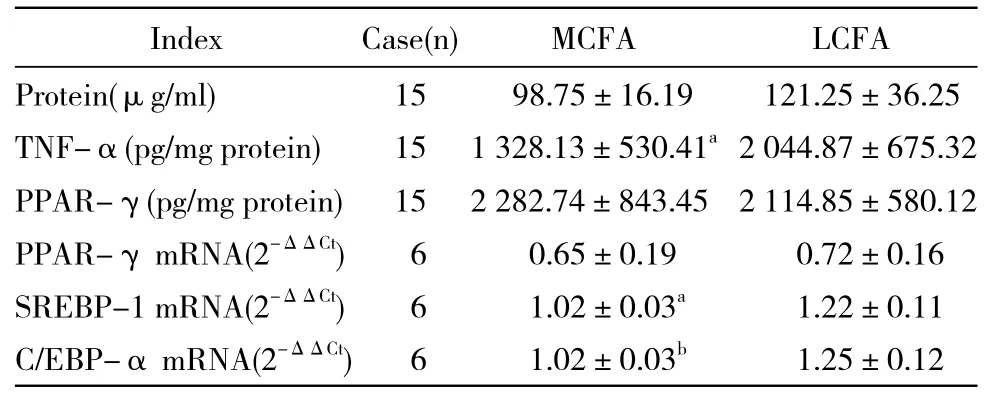
表3 小鼠脂肪组织中PPAR-γ, TNF-α水平及PPAR-γ,SREBP-1和C/EBP-α mRNA表达情况Tab. 3 Expression levels of PPAR-γ, TNF-α and PPAR-γ,SREBP-1and C/EBP-α mRNA in WAT of C57BL/6J mice(-x±s)
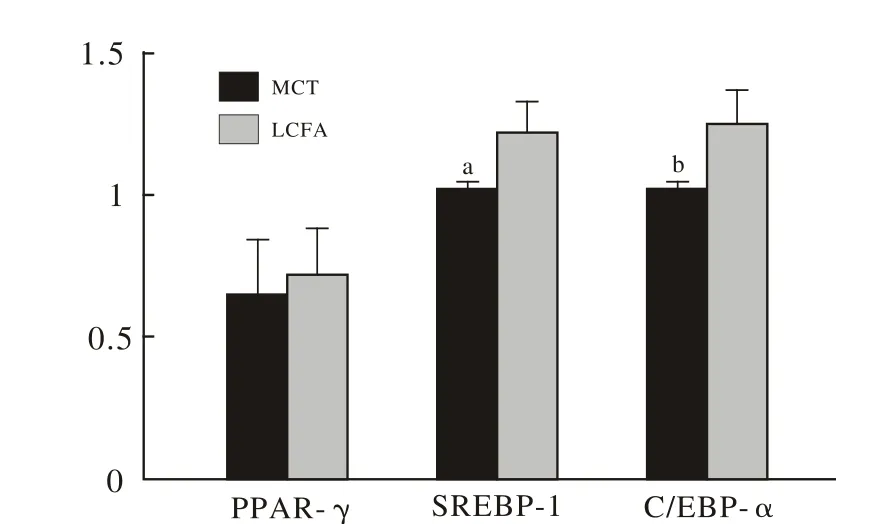
图 1 小鼠脂肪组织PPAR-γ,SREBP-1 and C/EBP-α mRNA表达情况Fig. 1 Expression of PPAR-γ,SREBP-1 and C/EBP-α mRNA in WATaP<0.05, vs LCFA group; bP<0.01, vs LCFA group
在肥胖发生机制的研究中,有报道认为脂肪细胞的过度增殖和分化是主要的机制之一[9]。对脂肪细胞分化或生脂因子的抑制作用,将减少体内脂肪聚集。目前,脂肪细胞分化过程的转录因子主要包括: PPARs家族、 SREBPs家族和 C/EBPs家族[10]。近年来研究表明,脂肪细胞分化是通过下列的脂肪细胞形成过程中的级联反应模式完成的[11]:以激素的刺激开始,激活C/EBP-α和PPAR-γ的表达,C/EBP-α和PPAR-γ的激活反过来再激活更多基因,这种相互作用最终都直接或间接的汇聚到C/EBP-α和PPAR-γ上,最终通过调节C/EBP-α和PPAR-γ的表达来影响脂肪细胞的分化。另一方面,SREBP-1的表达增强也可上调PPAR-γ的功能,促进脂肪细胞的分化、增殖和成熟[12-14]。这些过程主要在白色脂肪组织中完成。在本研究结果中,MCFA组肥胖小鼠WAT中SREBP-1和C/EBP-α的mRNA表达显著低于LCFA组,说明MCFA组小鼠脂肪合成显著降低,MCFA对SREBP-1和C/EBP-α这两个转录因子起到了一定的抑制作用。但MCFA组肥胖小鼠WAT中PPAR-γ的量及mRNA表达与LCFA组比较,均无统计学差异(P>0.05),仅存在数值上的下降趋势,为此,MCFA是否通过调节PPAR-γ的途径调节机体脂肪蓄积还有待进一步的探讨。
另外,TNF-α曾被认为是一种引起肿瘤坏死的内毒素诱导的血清因子,现在研究又证实TNF-α作为一种多功能的细胞因子,调节和参与机体炎症反应、细胞凋亡与存活以及参与其他细胞因子的产生等过程[15]。有报道认为,TNF-α可能作为C/EBP-α转录因子的靶基因,C/EBP-α表达的下降将抑制TNF-α的表达水平,进而减少脂肪合成[16-18]。本研究结果表明,MCFA组TNF-α水平降低,结合上述结果,分析MCFA通过调节SREBP-1和C/EBP-α转录因子的水平,进而改变脂肪细胞内TNF-α功能,抑制脂肪的合成,可能是MCFA降低肥胖小鼠体重,改善其脂代谢水平的机制之一。
1 陈春明,赵文华,杨正雄,等.中国慢性病控制中膳食关键因素的研究[J].中华流行病学杂志,2006,27(9):739-743.
2 Liu Y, Wang J, Zhang R, et al. A good response to oil with mediumand long-chain fatty acids in body fat and blood lipid profiles of male hypertriglyceridemic subjects[J]. Asia Pac J Clin Nutr, 2009, 18(3): 351-358.
3 Xue C, Liu Y, Wang J, et al. Consumption of medium- and longchain triacylglycerols decreases body fat and blood triglyceride in Chinese hypertriglyceridemic subjects[J]. Eur J Clin Nutr, 2009,63(7): 879-886.
4 Liu YH, Zhang Y, Xu Q, et al. Increased norepinephrine by medium-chain triglyceride attributable to lipolysis in white and brown adipose tissue of C57BL/6J mice[J]. Biosci Biotechnol Biochem,2012, 76(6): 1213-1218.
5 Liu Y, Xue C, Zhang Y, et al. Triglyceride with medium-chain fatty acids increases the activity and expression of hormone-sensitive lipase in white adipose tissue of C57BL/6J mice[J]. Biosci Biotechnol Biochem, 2011, 75(10): 1939-1944.
6 刘英华. 中链脂肪酸对肥胖小鼠脂代谢的调节作用及机制研究[D]. 军事医学科学院,2012.
7 刘英华,张永,张新胜,等.中链脂肪酸对高脂饲料诱导的C_(57)BL/6J肥胖小鼠体脂肪的影响[J].军医进修学院学报,2011,32(7):760-763.
8 张新胜,刘英华,徐庆,等. 中链脂肪酸对高甘油三酯血症合并不同水平HDL-C患者体重和体脂的影响[J]. 军医进修学院学报,2012,33(2):120-123.
9 Zhao S, Chu Y, Zhang C, et al. Diet-induced central obesity and insulin resistance in rabbits[J]. J Anim Physiol Anim Nutr (Berl),2008, 92(1): 105-111.
10 赵改霞. 固醇调节元件结合蛋白(SREBPs)的研究进展[D].山东大学,2005.
11 Espenshade PJ, Cheng D, Goldstein JL, et al. Autocatalytic processing of site-1 protease removes propeptide and permits cleavage of sterol regulatory element-binding proteins[J]. J Biol Chem,1999, 274(32): 22795-22804.
12 Sakai J, Nohturfft A, Cheng D, et al. Identification of complexes between the COOH-terminal domains of sterol regulatory elementbinding proteins (SREBPs) and SREBP cleavage-activating protein[J]. J Biol Chem, 1997, 272(32): 20213-20221.
13 Neer EJ, Schmidt CJ, Nambudripad R, et al. The ancient regulatoryprotein family of WD-repeat proteins[J]. Nature, 1994, 371(6495):297-300.
14 Grobe JL, Venegas-Pont M, Sigmund CD, et al. PPARgamma differentially regulates energy substrate handling in brown vs. white adipose: focus on “The PPARgamma agonist rosiglitazone enhances rat brown adipose tissue lipogenesis from glucose without altering glucose uptake”[J]. Am J Physiol Regul Integr Comp Physiol,2009, 296(5):R1325-R1326.
15 Liang H, Yin B, Zhang H, et al. Blockade of tumor necrosis factor(TNF) receptor type 1-mediated TNF-alpha signaling protected Wistar rats from diet-induced obesity and insulin resistance[J].Endocrinology, 2008, 149(6): 2943-2951.
16 Kim JB, Sarraf P, Wright M, et al. Nutritional and insulin regulation of fatty acid synthetase and leptin gene expression through ADD1/SREBP1[J]. J Clin Invest, 1998, 101(1): 1-9.
17 Foretz M, Guichard C, Ferré P, et al. Sterol regulatory element binding protein-1c is a major mediator of insulin action on the hepatic expression of glucokinase and lipogenesis-related genes[J]. Proc Natl Acad Sci U S A, 1999, 96(22): 12737-12742.
18 Yang JY, Della-Fera MA, Rayalam S, et al. Regulation of adipogenesis by medium-chain fatty acids in the absence of hormonal cocktail[J]. J Nutr Biochem, 2009, 20(7): 537-543.

