Excel软件应用于化学反应速率与活化能的测定
舒 婷
(湖北科技学院 药学院,湖北 咸宁 437100)
化学反应速率属于化学动力学范畴,在化工、医药、生命科学、环境工程等多种学科都有重要应用。在大学实验教学中,化学反应速率与活化能的测定是化学专业、药学专业和医学专业学生都要求掌握的实验内容,该实验结果涉及到大量的数据,图形和计算处理。Excel软件是最为常用的数据处理软件,在各种领域都有其应用的报道[1-6]。本文用Excel软件处理(NH4)2S2O8氧化KI反应的反应速率与活化能测定的实验数据,不仅使数据处理更加快速和准确,更重要的是引导学生入门,掌握计算机处理数据的方法。
1 考察浓度对化学反应速率的影响,求出反应的速率方程
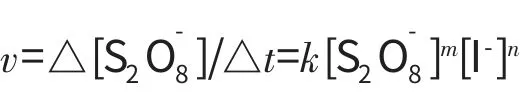
1.1 键入数据
打开Excel软件进入数据工作表状态,A列表示反应时间(s),在A1键入△t,B列表示(NH4)2S2O8的初始浓度(mol·L-1),在B1键入(NH4)2S2O8,C列表示KI的初始浓度(mol·L-1),在C1键入KI,D列表示Na2S2O3的初始浓度(mol·L-1),在D1键入Na2S2O3。
(1)在A2-A6键入243.3,124.8,60.2,122.5,240.7。
(2)在B2-B6键入0.02,0.04,0.08,0.08,0.08。
(3)在C2-C6键入0.08,0.08,0.08,0.04,0.02。
(4)在D2键入0.0016,按住右下角的十字架拖动到D6,则D2到D6均显示0.0016。
1.2 处理数据,绘制曲线,求出反应级数m,n 和反应速率常数k
(1)在E1键入v,在E2键入“=D:D/A:A”,则E列表示反应速率,按住右下角的十字架拖动到E6,自动算出各反应速率。
(3)在G1键入lg[I-],按照上述方法在G2插入“LOG10”函数,在“number”中输入“C:C”,按Enter键,则G列表示碘化钾浓度的对数,按住右下角的十字架拖动到G6,自动算出各碘化钾浓度的对数。
(4)在H1键入lgv,按照上述方法在H2插入“LOG10”函数,在number中输入“E:E”,按Enter键,则H列表示反应速率的对数。按住右下角的十字架拖动到H6,自动算出各反应速率的对数。
(5)选择F2-F4,按住Ctrl键,选择H2-H4,点击“插入”,“图表”,选择“散点图”,选择“平滑线散点图”,在图中的直线上点击右键,选择“添加趋势线”,选择“直线”,选择“公式”和“显示R的平方”,得到图1。图1显示直线方程y=1.0083x-3.4734,R=0.9996,该直线的斜率是1.0083,可求出m ≈1,与文献结果一致。
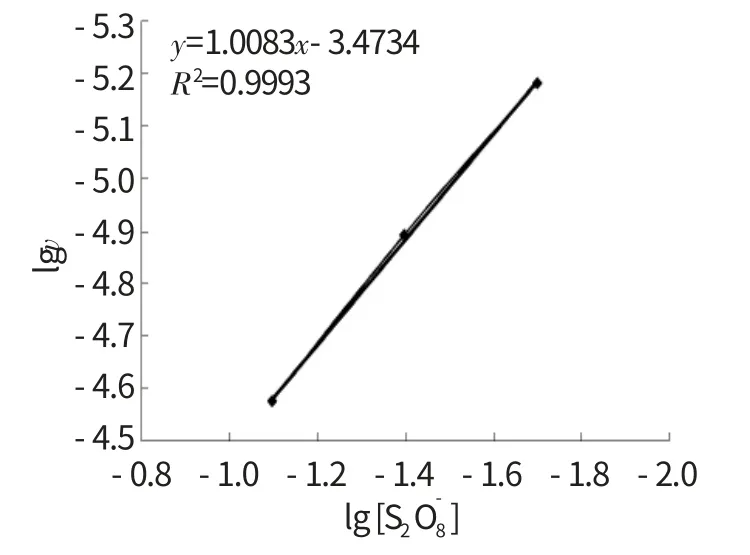
图1 反应级数m 的测定结果Fig.1 The measure result of reaction order m
(6)选择G4-G6,按住Ctrl键,选择H4-H6,点击“插入”,“图表”,选择“散点图”,选择“平滑线散点图”,在图中的直线上点击右键,选择“添加趋势线”,选择“直线”,选择“公式”和“显示R 的平方”,得到图2。图2显示直线方程y=0.9999x-3.4807,R=0.9999,该直线的斜率是0.9999,可求出n ≈1,与文献结果一致。
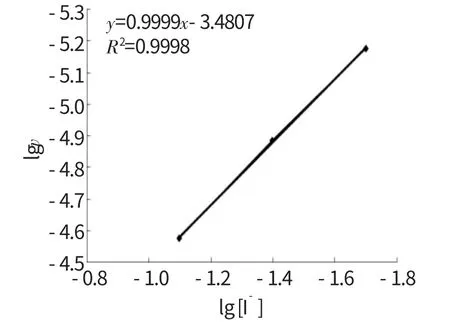
图2 反应级数n 的测定结果Fig.2 The measure result of reaction order n
(7)在I1键入k,在I2键入“=E:E/(B:B*C:C)”,按住右下角的十字架拖动到I6,自动算出反应的速率常数。
2 考察温度对化学反应速率的影响,求出反应的活化能
固定反应物的浓度和组成,通过在室温(285K),室温+10℃(295K),室温+20℃(300K)3个不同温度下测出反应时间,求出不同温度下反应的速率常数k,根据Arrhenius公式,反应速率常数k与反应温度T 的关系为lg k=A-Ea/2.303RT,以lg k~1/T 作图,即可求出反应的活化能。利用Excel软件可以快速准确地求出活化能。具体操作:
2.1 键入数据
(1)在J1键入T,在J7-J9键入285,295,305,J列表示反应温度(K),
(2)在A7-A9键入124.8,63.4,30.6,表示反应时间。
(3)在B7-B9键入0.04,表示过硫酸铵的初始浓度。
(4)在C7-C9键入0.08,表示碘化钾的初始浓度。
2.2 处理数据,求出反应的活化能
(1)将E列的右下角的十字架按住,拖出E7-E9,自动算出反应速率。
(2)将I列的右下角的十字架按住,拖出I7-I9,自动算出反应速率常数。
(3)在K1键入1/T,在K7键入“=1/J:J”,则K列表示反应温度的倒数,按住右下角的十字架,拖出K7-K9,自动算出反应温度的倒数。
(4)在L1键入lg k,在L6键入“=LOG10(I:I)”,M列表示反应速率常数的对数,按住右下角的十字架,拖出L7-L9,自动算出反应速率常数的对数。
(5)选择K7-K9以及L7-L9,点击“插入”,“图表”,选择“散点图”,选择“平滑线散点图”,在图中的直线上点击右键,选择“添加趋势线”,选择“直线”,选择“公式”和“显示显示R的平方”,得到图3。图3显示直线方程为y=-2679.1x+6.9977,R=0.9986,直线的斜率为-E a/2.303R,R 为气体常数8.314 J·(K·mol)-1,由此求出反应的活化能为51.3kJ·mol-1,活化能的文献值为51.9kJ·mol-1,实验误差为(文献值-实验值)/实验值×100%=1.2%,不超过±5%,符合实验要求。
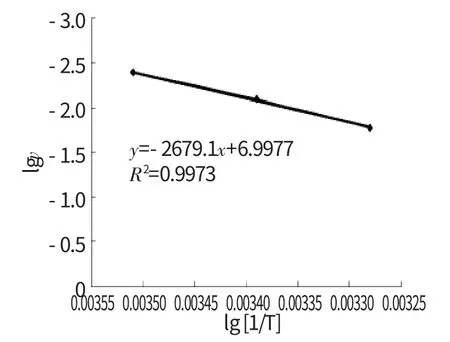
图3 活化能的测定结果Fig.3 The measure result of activation energy
操作完毕后,Excel表格显示为表1。

表1 实验的原始数据及计算数据表Tab.1 The original experimental data and calculated data table
从表1看出,当KI浓度不变时,(NH4)2S2O8的浓度增加一倍或二倍,反应速率相应增加约1倍或2倍,即反应速率与反应物(NH4)2S2O8的浓度成正比,因此m=l;当(NH4)2S2O8的浓度不变,KI浓度的增加一倍或二倍,反应速率相应增加约一倍或二倍,,即反应速率与反应物KI的浓度成正比,因此,n=1;与作图得到的结果一致。还可看出,温度每升高10K,反应速率常数增加约两倍,符合范特霍夫经验规律。
3 结论
化学反应速率与活化能的实验数据处理非常麻烦,涉及大量计算和多个图形,利用Excel软件的函数和自动计算功能可以大大缩短计算时间,而利用其作图和曲线拟合功能可以提高计算的速度和准确性。将Excel软件应用于大学实验教学对提高学生的数据处理能力有着重要意义。
[1]于广华,王宁.Microsoft Excel药学计算可视化的应用[J].计算机与应用化学,2006,23(9):839-841.
[2]马凤云,曹玲,黄雪莉.用Excel对精馏塔灵敏板位置确定的数值分析[J].计算机与应用化学,2006,23(3):275-278.
[3]孔凡洲,于仁成,徐子钧,等.应用Excel软件计算生物多样性指数[J].海洋科学,2012,(4):57-62.
[4]方欢,曾宏辉,储德节.处方评价工作中Excel软件抽样方法探讨[J].中国药房,2012,5:466-468.
[5]舒婷,张建军,杨左海,等.Excel软件应用于测定配合物组成和稳定常数[J].计算机与应用化学,2008,25(8):1031-1034.
[6]郑立辉,范国枝,韦一良,等.用Excel求解迭代问题[J].计算机与应用化学,2008,25(11):1429-1431.
[7]魏祖期.基础化学实验[M].北京:人民卫生出版社,2011.104.

