一株鸭坦布苏病毒的分离鉴定及全基因组序列分析
刘胜旺,张 玥,刘晓丽,李云霞,韩宗玺,邵昱昊,孔宪刚
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所禽病研究室,哈尔滨 150001)
2010年初,在我国南方集中养鸭地区出现一种引起蛋鸭产蛋量下降的疾病。该病迅速传播,在国内其他养鸭地区鸭场相继出现,涉及福建、浙江、广西、广东、江苏、江西、安徽、河南、河北、北京、山东等地。该病导致鸭、蛋鸭产蛋量大幅度下降,肉鸭、育成鸭发生神经症状,给我国养鸭业造成巨大经济损失。经研究确定该病是由一种新的黄病毒感染引起。这种新的黄病毒隶属于黄病毒科、黄病毒属、蚊媒病毒的恩塔亚病毒群,和坦布苏病毒亲缘关系最近,确定为一种新型鸭黄病毒-鸭坦布苏病毒(Duck Tembusu virus,DTMUV)[1-8]。2011年中国畜牧兽医学会第一届水禽疫病防控研讨会将该病名称统一为“鸭坦布苏病毒病”。
鸭坦布苏病毒(DTMUV)的病毒粒子呈球形,45~50 nm之间,有囊膜,表面有纤突[3,5,7]。基因组为单股正链RNA,含有一个开放阅读框,编码顺序为5'UTR-C-PrM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5-UTR3'。其中有3种结构蛋白C、PrM、E和7种非结构蛋白NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5。
本研究对病料进行病毒分离,全基因测序。国际上通常以黄病毒NS5基因3'端长约1 kb的区域同源性作为黄病毒属病毒分类依据。通过对实验室分离株Du/CH/LSD/110128株全基因和NS5基因对比分析,确定该株病毒属于新型鸭坦布苏病毒(DTMUV)。
1 材料与方法
1.1 病料来源主要材料
病料来自山东某发病鸭场;RNAiso Plus、One Step RT-PCR Kit Ver.2、pMD18-T载体、250 bp DNA Ladder Marker以及3'RACE快速扩增试剂盒等(购自宝生物工程(大连)有限公司);DNA回收试剂盒(购自OMEGA公司);0.22 μmol·L-1一次性滤器(购自Millipore公司);其他化学试剂均为国产分析纯;大肠埃希氏工程菌JM109由本实验室保存。
1.2 动物
SPF鸭胚购自中国农业科学院哈尔滨兽医研究所实验动物中心。
1.3 病毒分离
对来自山东某发病鸭场病料进行研磨,加入PBS匀浆,-70℃反复冻融3次,8 000 r·min-1离心5 min,吸取上清液,用 0.22 μmol·L-1一次性滤器过滤除菌后将滤液装于冻存管中备用。将滤液以0.1 mL·胚-1,接种于9~11日龄SPF鸭胚,37℃孵育,弃掉24 h以内死亡胚,72 h后将接种鸭胚放入4℃,1 h后无菌收取尿囊液。
1.4 全基因序列测定分析
1.4.1 引物的设计合成
根据GenBank中登录的鸭黄病毒BYD-1株(登录号:JF312912)的序列[2,7],及参考文献[15]设计10对包含10条互相重叠片段的引物(见表1),由北京六合华大基因科技股份有限公司构建。

表1 扩增引物Table 1 Primers for PCR in amplification
1.4.2 病毒RNA的提取
对收取的尿囊液进行病毒RNA提取,取200 μL鸭胚尿囊液,按RNAiso说明书提取RNA,最后用30 μL DEPC水溶解沉淀。通过RT-PCR方法判定病毒分离是否成功。引物使用鸭黄病毒(Flavivirus)的特异性引物,DFLA-F:AGACTGCTG GTGCAATGAGAC和DFLA-R:CGTCGTTCCCAGAT TCCA[1]。预期扩增片段长度250 bp,RT-PCR产物经0.8%琼脂糖凝胶电泳检测。
1.4.3 病毒全基因组克隆
将经琼脂糖凝胶电泳检测阳性病毒RNA使用已设计的10对引物进行RT-PCR,产物根据OMEGA公司胶回收试剂盒说明书回收目的片段。使用常规方法重组质粒,筛选出阳性质粒送北京六合华大基因科技股份有限公司进行序列测定。
1.4.4 基因组序列分析
将测得序列通过DNASTAR、BioEdit等软件进行拼接分析,所得序列在GenBank中进行BLAST同源序列比对,用MEGA5软件采用邻近法分别对Du/CH/LSD/110128株与其他黄病毒科病毒进行全基因发育进化树和NS5基因发育进化树构建。并用MegAlign对全基因组和NS5基因进行同源性比对。从GenBank下载参考序列的毒株(见表2),从GenBank下载NS5基因参考序列的毒株(见表3)。

表2 从GenBank下载参考序列的毒株及其缩写Table 2 Reference viruses in GenBank and their abbreviation
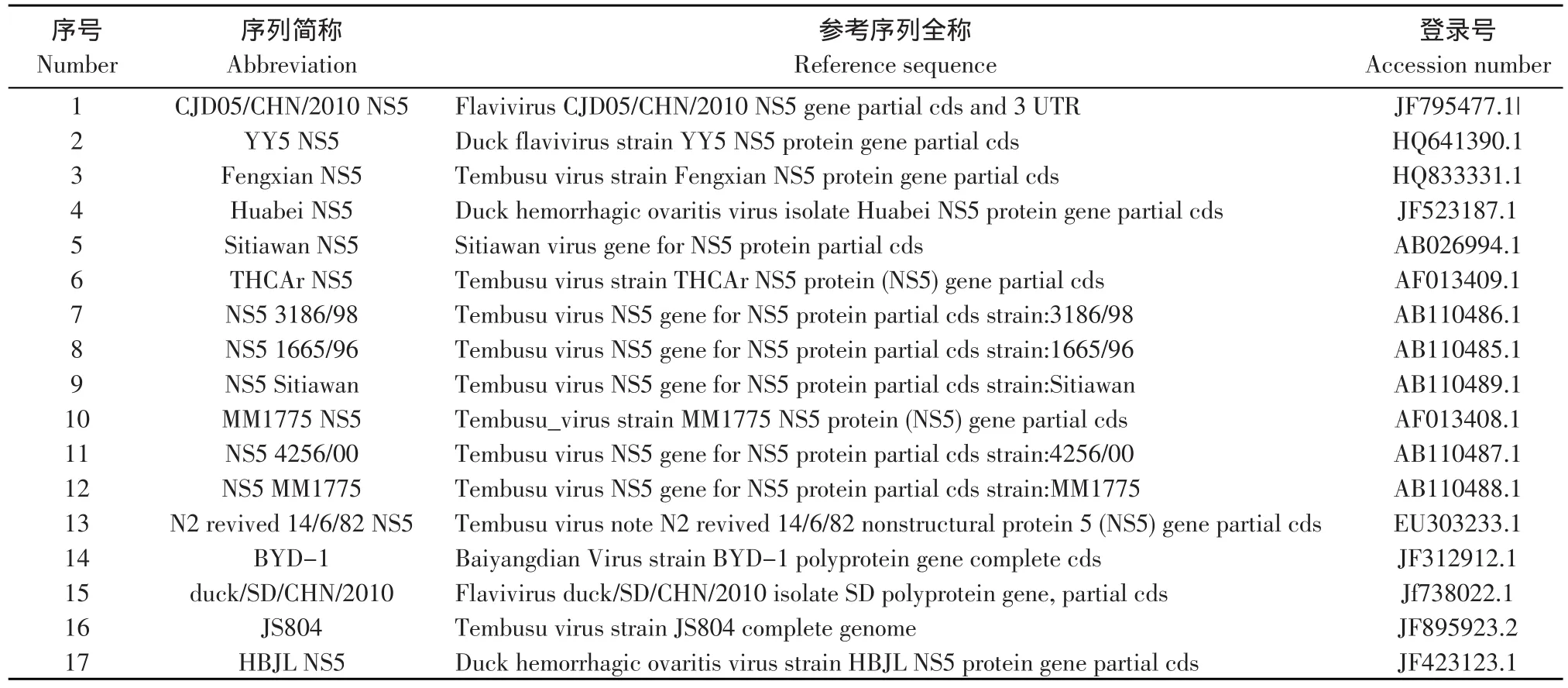
表3 从GenBank下载参考序列的毒株及其缩写(NS5)Table 3 Reference viruses in GenBank and their abbreviation(NS5)
2 结果与分析
2.1 病毒分离
尿囊腔接种后72 h的胚体有明显出血点,颈背部出血点明显(见图1),对收获的鸭胚尿囊液提取RNA经RT-PCR扩增后,通过琼脂糖凝胶电泳检测在250 bp处有明显条带。
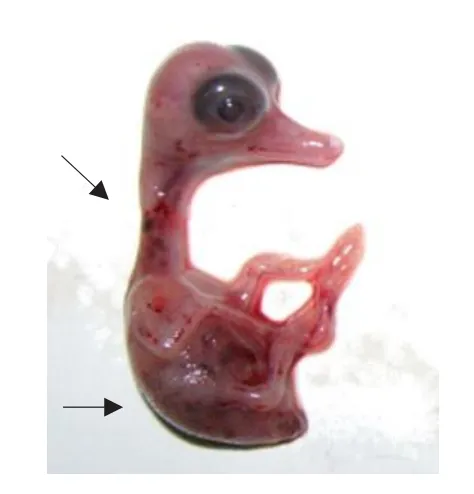
图1 鸭胚出血(颈背部出血点)Fig.1 Duck embryo bleeding(neck and back with petechia)
2.2 全基因组扩增结果
将分离到的病毒使用上述10对引物通过RT-PCR扩增得到10条相互重叠的片段,琼脂糖凝胶电泳检测,片段大小与预测基本相符(见图2)。
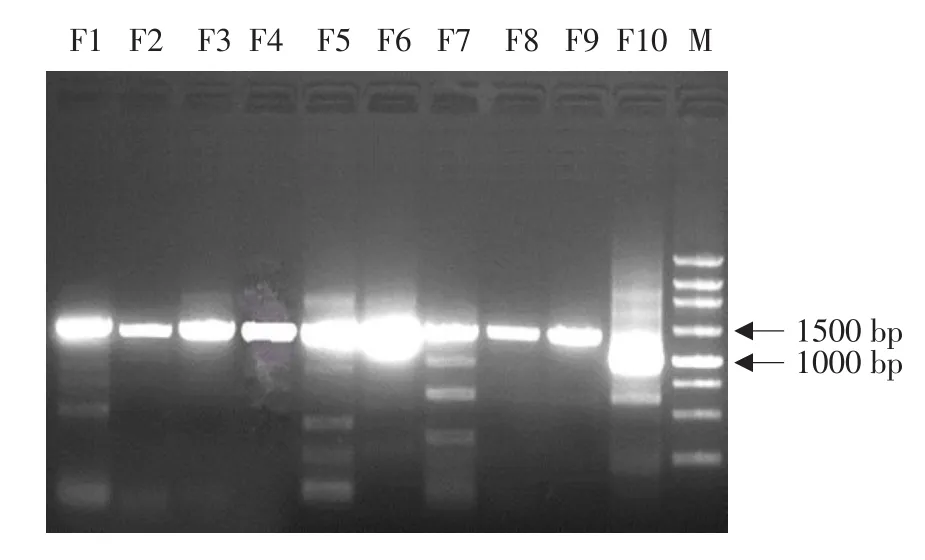
图2 全基因组扩增Fig.2 Whole genome amplification
2.3 全基因片段分析
本试验测得的Du/CH/LSD/110128株基因含有一个开放阅读框,编码3 426个氨基酸组成的多聚蛋白,其中3种结构蛋白(C、PrM、E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5),与已知的坦布苏病毒属病毒基因相似。各个蛋白在基因中的位置组成(见表4),参照已发表文献中已知序列多聚蛋白的切割方法[9-11],经比较可得出各个蛋白的切割位点基本保守。
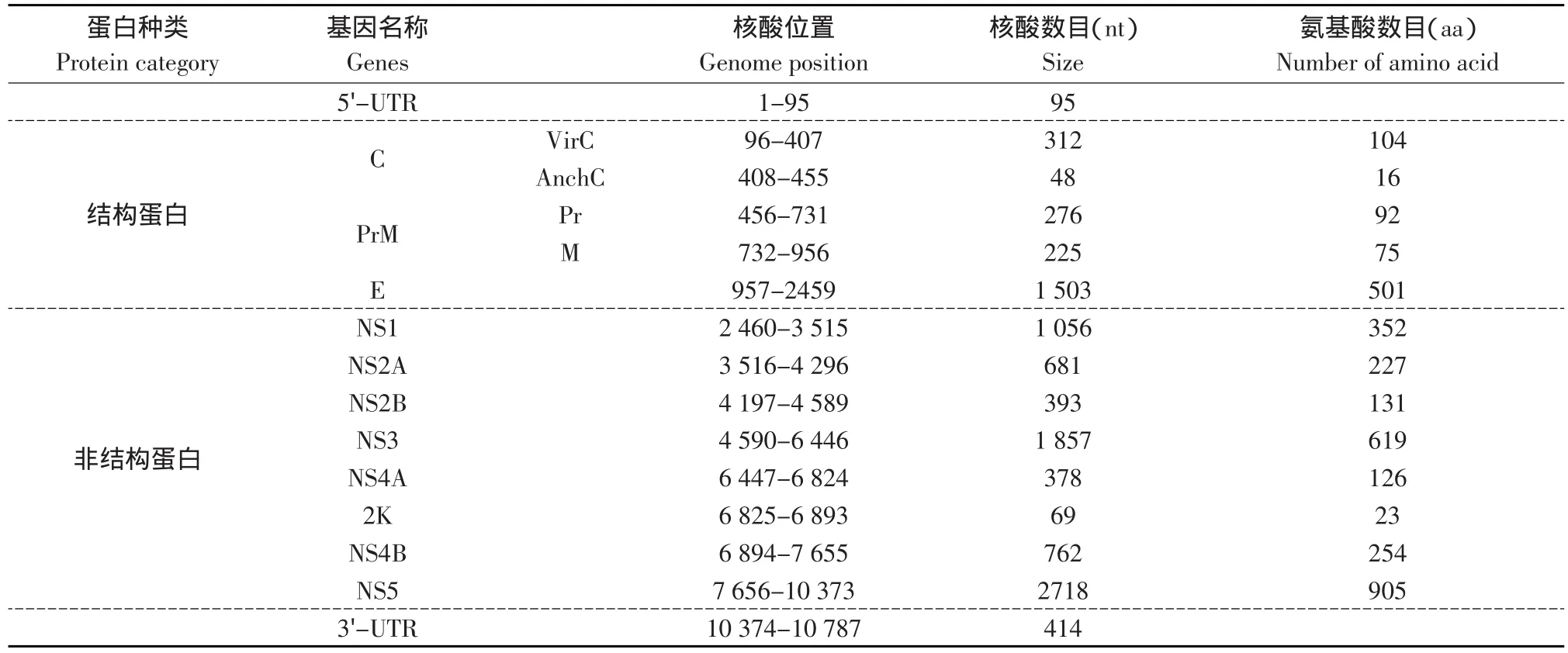
表4 Du/CH/LSD/110128全基因组结构Table 4 Full-length genome organization of Du/CH/LSD/110128
2.3 全基因系统进化分析结果
将本试验分离到的Du/CH/LSD/110128株全基因序列与其他23株黄病毒科病毒进行基因核苷酸同源性比对,比对结果(见表5),并采用邻近法对它们进行遗传进化树的构建(见图3)。
2.4 NS5基因分析
对试验分离株Du/CH/LSD/110128与GenBank上已公布的其他32株病毒的NS5基因进行核苷酸序列同源性比对。
结果见表6和图4。
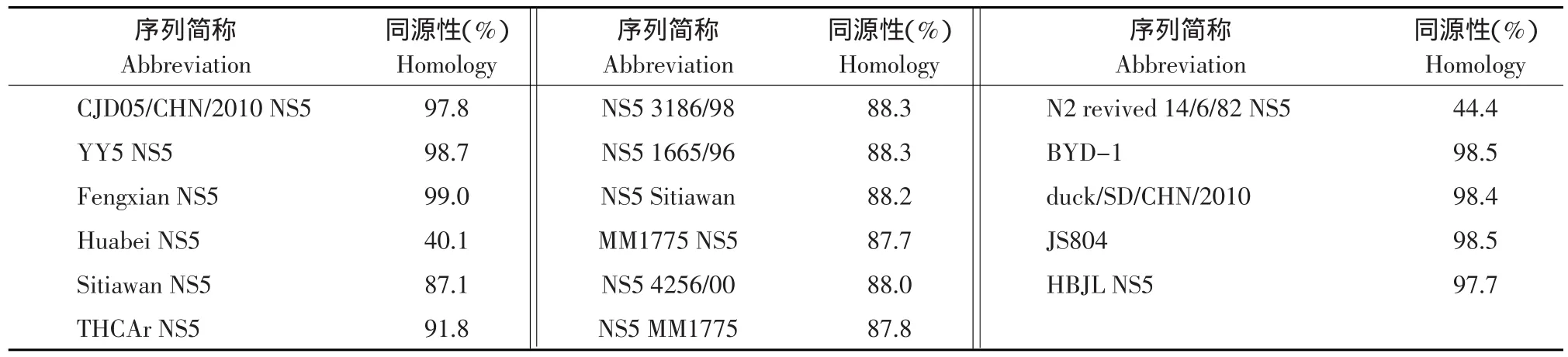
表5 Du/CH/LSD/110128(NS5)与其他GenBank已公布序列核苷酸同源性比较Table 5 Comparison of Du/CH/LSD/110128(NS5)with reference viruses in GenBank for nucleotide
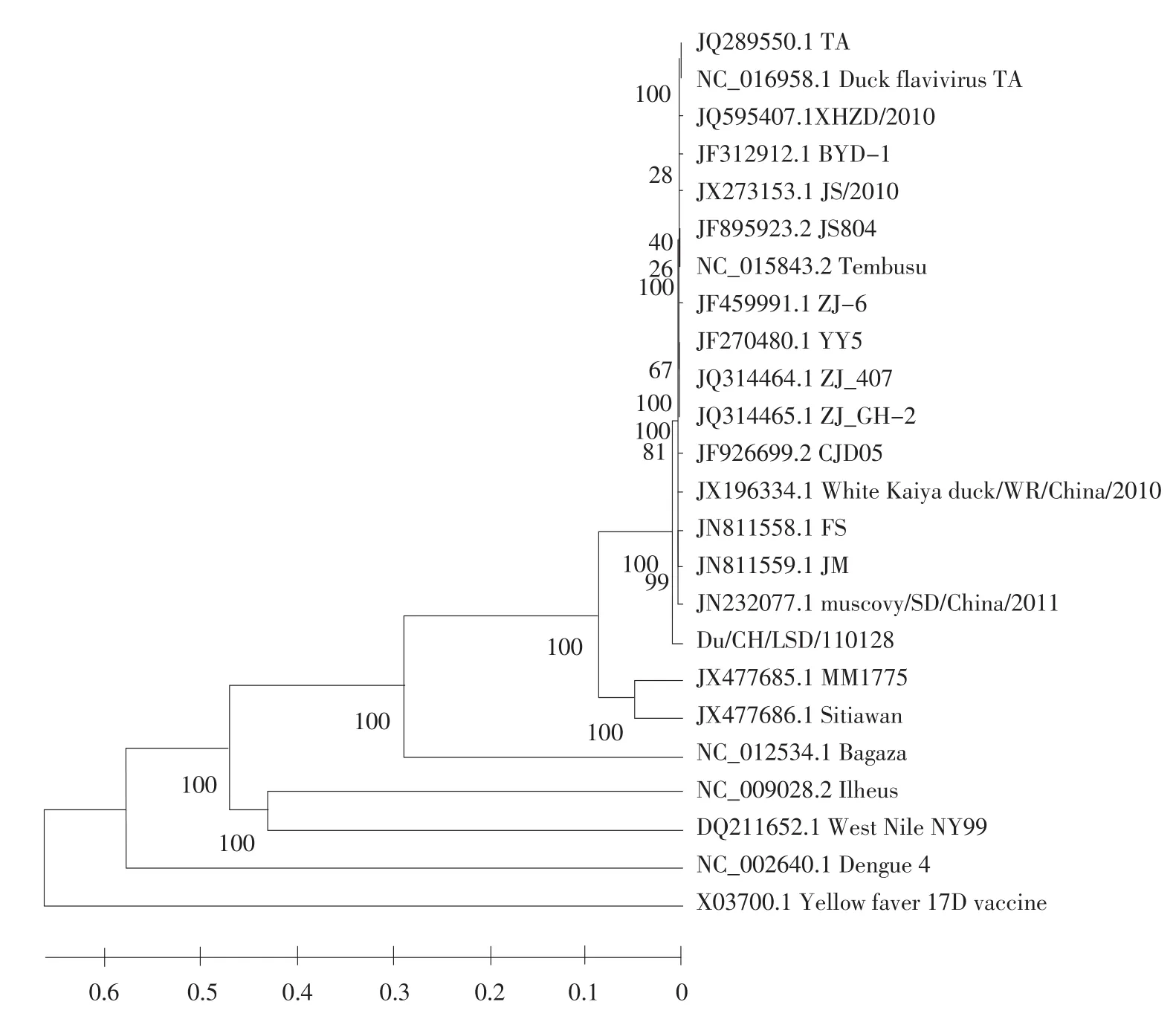
图3 鸭坦布苏病毒DU/CH/LSD/110128株系统进化分析Fig.3 Phylogenetic analysis of DTMUV DU/CH/LSD/110128 strain
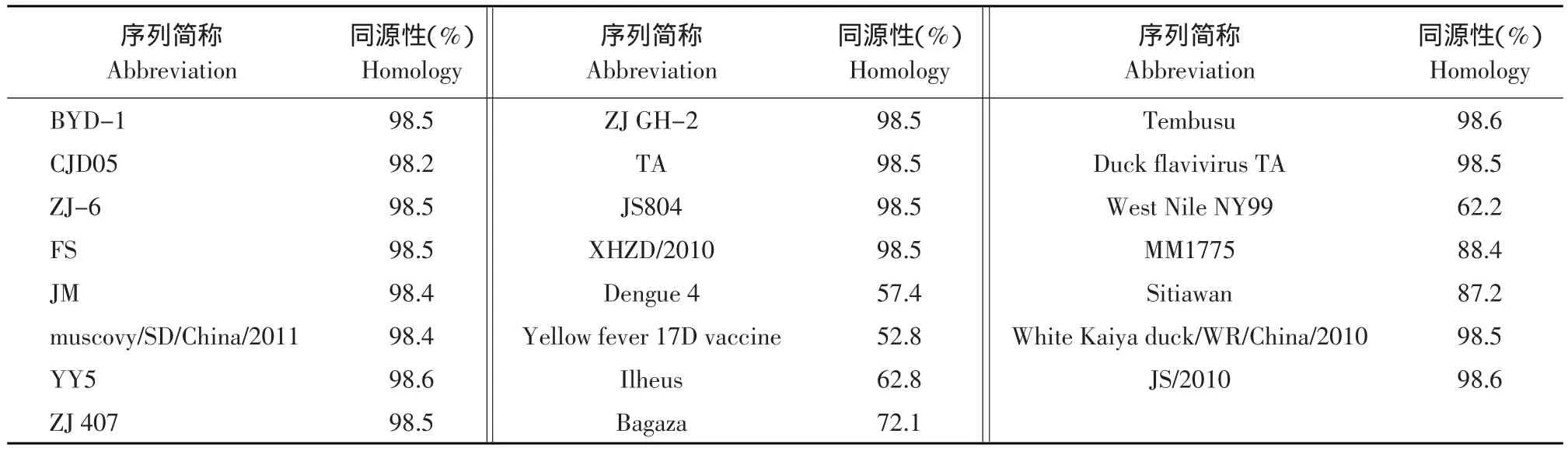
表6 Du/CH/LSD/110128株与其他GenBank已公布序列核苷酸同源性比较Table 6 Comparison of Du/CH/LSD/110128 with reference viruses in GenBank for nucleotide
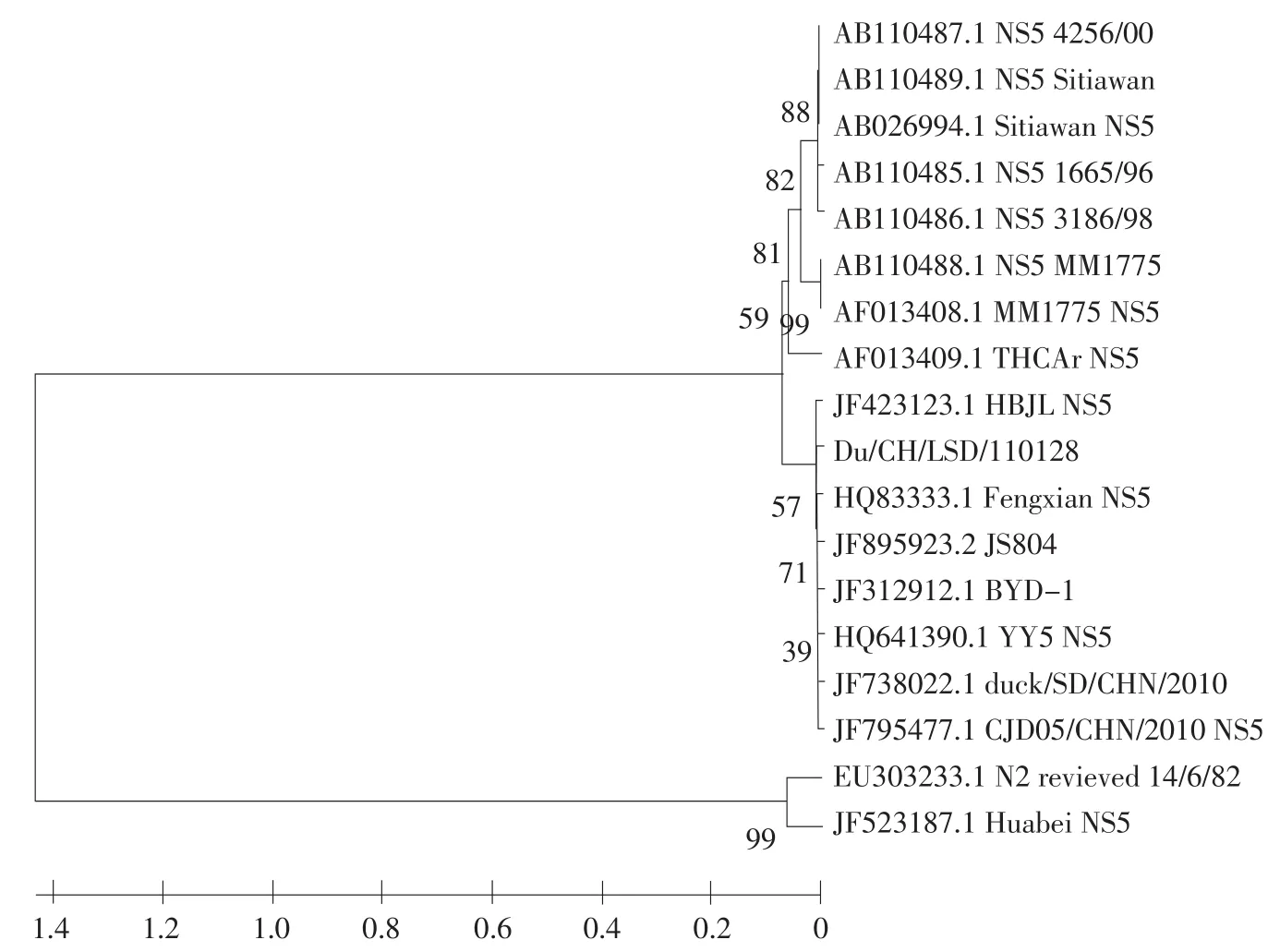
图4 鸭坦布苏病毒Du/CH/LSD/110128株NS5基因系统进化分析Fig.4 Phylogenetic analysis of DTMUV Du/CH/LSD/110128 strain NS5 gene
3 讨论与结论
鸭黄病毒病最早于1995年出现在河北省石家庄、邯郸等地,首次鉴定该病的病原为黄病毒科的鸭病毒性脑炎病毒,国外未见报道[11]。2010年初开始,在我国大部分集中养鸭地区爆发。该病迅速传播,患病鸭多出现脚麻痹、头颈歪斜等运动机能失调等神经症状,产蛋量急剧下降,表现为出血性卵巢炎症状[1-8],临床易与禽流感新城疫混淆,建立灵敏准确的实验室诊断该病的方法非常重要,颜丕熙等建立的套式RT-PCR方法,灵敏度比常规PCR高10倍,临床样品阳性检出率高于病毒分离率[14]。Yan等建立了TaqMan探针荧光定量PCR方法,灵敏度是常规PCR的100倍[16]。截至目前尚没有可有效防治DTMUV的商品化疫苗研制成功,感染DTMUV后病鸭产生的抗体效价较低[3,7-8],鸡亦可对DTMUV产生特异性免疫应答反应[12]。筛选出抗原性良好的天然疫苗株对进一步研究开发效果确实的灭活苗和弱毒苗有至关重要作用。
对黄病毒的分类,国际上公认分类方法是病毒NS5基因核苷酸同源性在84%以上的分离株为同一个种病毒[13]。本试验对病料进行病毒分离检测和全基因组序列测定分析,确定Du/CH/LSD/110128株病毒含有一个开放阅读框,编码一个由3 426个氨基酸组成的多聚蛋白,主要包含3个结构蛋白和7个非结构蛋白,其中有一个囊膜蛋白E和一个与RNA相连的核心蛋白C,以及一个较大的前体蛋白PrM。紧接着是非结构蛋白NS1,为一种糖蛋白,以及NS2A、NS2B、NS3、NS4A、NS4B 和 NS5[17]。通过对试验分离株Du/CH/LSD/110128与GenBank已公布的一些黄病毒科病毒的基因序列进行核苷酸同源性比较和系统进化树分析,发现试验分离株Du/CH/LSD/110128与黄热病毒(Yellow fever virus)、登革热病毒(Dengue virus)、伊利乌斯脑炎病毒(Ilheus virus)、西尼罗病毒(West Nile virus)、巴格扎病毒(Bagaza virus)和坦布苏病毒(Tembusu virus)具有遗传进化关系。其中与黄热病毒(Yellow fever virus)亲缘关系最远,与巴格扎病毒(Bagaza virus)亲缘关系较近但遗传距离介于病毒种的水平上。与其他株坦布苏病毒亲缘关系最近,全基因组核苷酸同源性和NS5基因核苷酸同源性均在87%以上,可以确定试验分离株Du/CH/LSD/110128属于黄病毒科、黄病毒属、蚊媒病毒恩塔亚病毒群的坦布苏病毒。
黄病毒可引起人类和动物严重疾病,禽源司提阿万病毒(Sitiawan virus)只对家禽致病不变。传统坦布苏病毒被库蚊这种传播途径所隔离,但新型的鸭坦布苏病毒可对各种鸭致病,其中包括北京鸭、樱桃谷鸭、绍兴鸭[10]。李泽君研究表明该病可以通过直接接触传播和空气传播[13],这与其他坦布苏病毒存在区别。鸭坦布苏病毒对鸟类和人类的致病性尚不清楚,其生理和生态动力学包括病毒周期也不甚了解。还需要更深入研究以揭示鸭坦布苏病毒本质、生理生态学及致病性等。
[1] Yan P,Zhao Y,Zhang X,et al.An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J].Virology,2011,417(1):1-8.
[2] 滕巧泱,颜丕熙,张旭,等.一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报,2010,18(6):1-4.
[3] Su J L,Li S,Hu X D,et al.Duck egg-drop syndrome caused by BYD virus,a new tembusu-related flavivirus[J].PLoS ONE,2011,6(3):e18106.
[4] 朱丽萍,颜世敢.鸭坦布苏病毒研究进展[J].中国预防兽医学报,2012,34(1):79-82.
[5] 曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[6] 李玉峰,马秀丽,于可响,等.一种从鸭新分离的黄病毒研究初报[J].畜牧兽医学报,2011,6:885-891.
[7] 廖敏,牟小东,耿阳,等.鸭传染性产蛋减少症(暂定名)的病原分离初报[J].中国动物传染病学报,2011,19(1):22-26.
[8] 胡旭东,路浩,刘培培,等.我国发现的一种引起鸭产蛋下降综合征的新型黄病毒[J].中国兽医杂志,2011,7:43-47.
[9] Thomas J,Chambers,Chang S,et al.Flavivirus Genome Organization,Expression,and Replication[J].Annual Review of Microbiology,1990,44:649-688.
[10] Yun T,Ye W C,Ni Z,et al.Identification and molecular characterization of a novel flavivirus isolated from Pekin duckings in China[J].Veterinary Microbiology,2012,157:311-319.
[11] 温立斌,张福军,王玉然,等.鸭病毒性脑炎(暂定)病原分离与鉴定的初步研究[J].中国兽医杂志,2001,37(2):3-4.
[12] 傅光华,黄瑜,施少华,等.鸡黄病毒的分离与初步鉴定[J].福建畜牧兽医,2011,3:1-2.
[13] 李泽君.鸭坦布苏病毒病病原的分离鉴定及生物学特性研究[J].中国家禽,2011,33(17):34-35.
[14] 颜丕熙,李国新,吴晓刚,等.应用套式RT-PCR快速检测鸭坦布苏病毒[J].中国动物传染病学报,2011,19(3):34-37.
[15] Maher-Sturgess Sheryl L,Forrester Naomi L,Wayper P J,et al.Universal primers that amplify RNA from all three flavivirus subgroups[J].Virol J,2008(5):16-25.
[16] Yan L P,Yan P X,Zhou J W,et al.Establishing a Taq-Manbased real-time PCR assay forthe rapid detection and quantification of the newly emerged duck Tembusu virus[J].Virol J,2011,8(1):464.
[17] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.

