捻转血矛线虫HLJ株H11基因克隆及部分胞外域表达
路义鑫,林 宇,2,李镝锐,汪 明
(1.东北农业大学动物医学院,哈尔滨 150030;2.北京出入境检验检疫局,北京 100026;3.中国农业大学动物医学院,北京 100091)
捻转血矛线虫是存在于牛羊等反刍动物体内的一种重要消化道寄生虫,呈世界性分布,国内各省均有报道。黑龙江省是畜牧大省,每年因消化道线虫造成的损失巨大。1979~1985年黑龙江省畜禽寄生虫区系调查协作组调查发现捻转血矛线虫寄生率和感染强度都很高,为黑龙江省优势种,并在全省分布[1]。1997年全国栋等调查黑龙江齐嫩地区牛感染率为96.2%;羊为85%[2]。2003年3月~2004年12月,王春仁等在黑龙江省西部地区进行调查发现捻转血矛线虫感染率为37.1%[3]。目前,该病主要采用化学药物治疗,但由于药物残留、环境污染、抗药性虫株出现和蔓延,使得传统化学治疗受到严重挑战,迫切需要一种有效防治方法控制其感染和流行。H11是一种隐蔽抗原,具有氨基肽酶活性,是目前世界上公认最好的捻转血矛线虫疫苗候选抗原。国外学者Smith等对H11进行克隆和表达[4];国内杜爱芳、严若峰等也对浙江、新疆虫株进行相关研究[5-6]。本研究将对黑龙江(HLJ)株进行克隆和表达,为捻转血矛线虫疫苗研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 虫种
捻转血矛线虫HLJ株成虫,采自黑龙江省绵羊体内。
1.1.2 菌种与质粒
大肠杆菌感受态细胞DH5α(购自北京全式金生物工程有限公司);pMD18-T载体(购自宝生物工程(大连)有限公司);表达载体pGEX-6P/1由中国农业大学寄生虫教研组保存。
1.1.3 工具酶与试剂
RNA提取纯化试剂盒(购自Promega公司);Trizol(购自Invitrogen公司);胶回收试剂盒(购自Omega公司);质粒小量提取试剂盒(购自博大泰克公司);RNasin(RNA酶抑制剂)、M-MLV Reverse Transcriptase(M-MLV反转录酶)、TaqDNA聚合酶、dNTP、T4DNA连接酶及限制性内切酶EcoR I、HandⅢ(等均购自宝生物工程(大连)有限公司)。
1.2 方法
1.2.1 引物设计与合成
根据GenBank中已发表序列(登录号∶X94187)为参考,设计一对引物P1和P2,扩增H11基因开放阅读框;在对H11基因序列分析基础上,设计一对表达引物P3和P4,扩增H11基因胞外域。引物由北京奥科生物技术有限公司合成。

1.2.2 捻转血矛线虫总RNA提取和目基因扩增
按照Promega公司试剂盒说明书提取捻转血矛线虫总RNA。逆转录方法获得cDNA。取逆转录产物(cDNA)利用25 μL体系进行PCR扩增获得H11基因。纯化后连接pMD18-T载体,构建重组质粒pMD18-T-H11,送北京奥科生物有限公司进行测序。应用软件进行序列分析和比较。
1.2.3 原核表达载体构建
以P3、P4为引物,pMD18-T-H11为模板扩增,PCR扩增获得目的片段。将纯化PCR产物和pGEX-6P-1载体进行BamHⅠ和SalⅠ双酶切,产物用Omega胶回收试剂盒纯化。连接转化后,将初选质粒进行单、双酶切和PCR鉴定。阳性质粒送生物公司测序。重组原核表达载体命名为pGEX-6P-1-H11。
1.2.4 目的基因诱导表达
将测序鉴定正确pGEX-6P-1-H11重组质粒转化大肠杆菌表达菌Rosetta(DE3),37℃培养过夜,挑取单菌落,接种于含AmpLB培养基中,37℃活化过夜后,1∶100稀释到LB培养基中,37℃、250 r·min-1振摇培养至对数期(OD600=0.6),加入终浓度为 1 mmol·L-1IPTG,于 37℃、250 r·min-1诱导6 h。于诱导前和诱导后3、4.5、6 h分别取出1 mL菌液,以5 000 r·min-1离心收集菌体,弃上清,进行SDS-PAGE分析。
处理样品经SDS-PAGE电泳后,将凝胶上蛋白转印至硝酸纤维素膜(NC膜)上,以感染捻转血矛线虫阳性血清作为一抗,辣根过氧化物酶标记兔抗羊IgG作为二抗进行Western-blot分析,参见文献[7]步骤进行操作。
2 结果与分析
2.1 H11基因RT-PCR扩增
图1为以P1和P为引物PCR扩增捻转血矛线虫H11基因电泳图。电泳结果显示,所取样品PCR产物在凝胶中跑出目的条带,与DNA Marker比较可知H11大小为3 000 bp,这与预期扩增片段大小相吻合。初步确定扩增出片段为目的基因。

图1 H11基因RT-PCR产物电泳结果Fig.1 RT-PCR amplification result of H11 gene
2.2 H11基因克隆和鉴定
提取重组质粒pMD18-T-H11 DNA样品进行PCR、单、双酶切鉴定。经BamHⅠ单酶切得到长约5 700 bp一条带,BamHⅠ、HandⅢ双酶切得到长约3 000和2 700 bp两条带,质粒PCR长约3 000 bp(见图2)。证明为阳性重组质粒。
2.3 H11抗原基因序列分析
本试验测得捻转血矛线虫H11基因。测序结果表明PCR扩增捻转血矛线虫H11基因由起始密码子到终止密码子核苷酸长为2 919 bp,编码972个氨基酸残基。经软件分析,捻转血矛线虫HLJ株H11与已知序列(X94187,Smith)同源性为99.14%,有25个碱基发生突变,在550、1 230、1 461、1 530、1 590位有碱基T→C突变,在1 272、1 587、1 681、1 832位有碱基G→A突变,在1 554、1 577、1 584、1 902、2 543位有碱基A→G突变,在1 694、1 722、1 777、1 860、2 217、2 444位有碱基C→T突变,在2 770位有碱基G→T突变,其余4个是同义突变;与已知序列(AY247714,严若峰)同源性为98.49%,有44个碱基发生突变,在292、1 270位有碱基C→A突变,在712、951、1 000、1 272、1 329、1 832、1 889、2 149、2 151、2 184位有碱基G→A突变,在928、1 026、2 199位有碱基A→C突变,在933、936、980、1 005、1 041、1 188、1 191、1 212、1 770、1 860、1 946、2 217位有碱基C→T突变,在942、977、1 062、1 901、2 543位有碱基A→G突变,在1 158、1 353、1 570、2 150、2 707位有碱基T→C突变,在2 770位有碱基G→T突变,其余6个是同义突变;与已知序列(AY819650,杜爱芳)同源性为99.59%,有12个碱基发生突变,在1 272、1 832位有碱基G→A突变,在1 770、1 860、2 217位有碱基C→T突变,在1 901、2 543、2 642位有碱基A→G突变,在2 770位有碱基G→T突变,其余3个是同义突变。
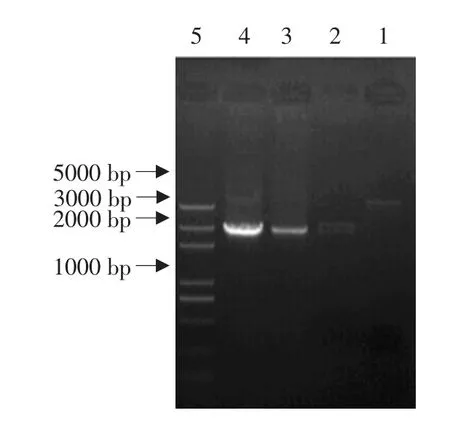
图2 捻转血矛线虫重组质粒pMD18-T-H11PCR、酶切鉴定Fig.2 Identification of Haemonchus contortus recombinant plasmid pMD18-T-H11
经生物信息学软件分析(NetNGlyc 1.0 Server),H11基因含有4个糖基化位点和1个Zn结合功能域。4个糖基化位点分别位于99~102aa、227~230aa、549~552aa、858~861 aa处;Zn结合功能域位于376~385 aa处(见图3)。
2.4 H11部分胞外域扩增
在对H11基因序列分析基础上,选取包含3个糖基化位点和1个Zn结合功能域,从451至2 919 bp一段序列设计一对引物P3、P4,以pMD18-T-H11为模板,经PCR扩增,获得一条约2 500 bp目的条带(见图4)。

图3 捻转血矛线虫H11基因生物信息分析结果Fig.3 Analyzed H11 gene of Haemonchus contortus by bioinformatics

图4 H11部分胞外域PCR扩增结果Fig.4 PCR amplification result of H11 ECD gene
2.5 原核表达载体鉴定
提取重组质粒pGEX-6P-1-H11样品进行PCR、单、双酶切鉴定。经BamHⅠ单酶切得到长约7 500 bp一条带,BamHⅠ和SalⅠ双酶切得到长约5 000和2 500 bp两条带,质粒PCR长约2 500 bp(见图5)。证明为阳性重组质粒。
2.6 H11部分胞外域原核表达
SDS-PAGE结果(见图6)表明,采用1 mmol·L-1IPTG 37℃培养,pGEX-6P-1-H11可以诱导表达,在118 ku处出现特异性融合蛋白条带。H11(415~2 919 bp)蛋白分子质量约为92 ku,表达蛋白为带有GST标签融合蛋白,GST分子质量为26 ku,故推测融合蛋白分子质量约为118 ku,与推测分子质量大小相符。表达产物经超声波裂解后,融合蛋白主要存在于离心沉淀中,提示融合蛋白表达后以包涵体形式存在于菌体中。免疫印迹实验未发现目的条带。

图5 捻转血矛线虫重组质粒pGEX-6P-1-H11PCR、酶切鉴定Fig.5 Identification of Haemonchus contortus recombinant plasmid pGEX-6P-1-H11

图6 捻转血矛线虫H11部分胞外域基因重组蛋白SDS-PAGE分析Fig.6 SDS-PAGE analysis of H11 ECD gene recombinant protein
3 讨论与结论
H11是寄生阶段捻转血矛线虫小肠微绒毛上皮细胞中一种跨膜糖蛋白,分子质量为110 ku。Smith首先克隆H11基因,并进行序列分析[5]。本试验根据GenBank上发表H.contortus(X94187)序列为设计引物,采用RT-PCR方法从捻转血矛线虫总RNA中特异性地扩增出H11基因,测序结果表明,H11基因由起始密码子到终止密码子核苷酸长为2 919 bp,编码972个氨基酸残基。经软件分析,捻转血矛线虫HLJ株H11与已知序列(X94187,Smith)同源性为99.14%,有25个碱基发生突变,其中4个是同义突变;与已知序列(AY247714,严若峰)同源性为98.49%,有44个碱基发生突变,其中6个是同义突变;与已知序列(AY819650,杜爱芳)同源性为99.59%,有12个碱基发生突变,其中3个是同义突变。这些差异与地域差异有关。黑龙江省位于中国东北部,无霜冻期短,年均气温低,外界环境在绝大多数时间里很难满足虫体发育需求,虫体长期以受阻幼虫形式存在于宿主体内,为适应不利生存环境可引起一定程度改变。
糖基化位点氨基酸组成特征为N-{P}-[ST]-{P},锌结合功能域氨基酸组成特征为[GSTALIVN]-{PCHR}-{KND}-H-E-[LIVMFYW]-{DEHRKP}-H-{EKPC}-[LIVMFYWGSPQ]。经软件分析,H11基因含有4个糖基化位点和1个Zn结合功能域。4个糖基化位点分别位于 99~102aa、227~230aa、549~552aa、858~861 aa处;Zn结合功能域位于376~385 aa处。糖基化位点能够携带部分必需寄生虫特有保护性多肽,锌结合功能域氨基酸可发挥中性锌金属肽酶活性,结果与张红丽等[8]一致。
H11基因编码蛋白分子质量较大,体外表达较为困难。严若峰将H11基因分3段构建原核表达载体pET28/H11-1、pET28/H11-2、pET28/H11-3,并分别进行表达,结果H11-1和H11-2获得较高水平表达,而H11-3未见明显表达条带;严若峰还将3段H11基因在巴斯德毕赤酵母中进行表达,结果可通过RT-PCR、SDS-PAGE、和Western blot检测到目的基因表达,但培养上清中检测不到目的蛋白表达。张红丽等克隆捻转血矛线虫ZJ株H11抗原部分基因(包含2个糖基化位点和1个Zn结合功能域,从670到1 710 bp),构建pET28b-HPS原核表达载体,结果获得高效表达[8]。
本研究以pMD18-T-H11为模板成功克隆捻转血矛线虫HLJ株H11基因451到2 919 bp一段胞外域序列,包含3个糖基化位点和1个Zn结合功能域,并构建pGEX-6P-1-H11原核表达质粒,在大肠杆菌表达菌Rosetta(DE3)中成功表达,获得预期结果。
H11是迄今为止从捻转血矛线虫肠道中分离到最具保护性隐蔽抗原,正常情况下不被机体免疫系统所识别,机体不对其产生免疫反应,本研究以自然感染捻转血矛线虫绵羊阳性血清进行免疫印迹实验未出现目的条带,证实H11确是一种隐蔽抗原,与严若峰结果相一致[8]。如何才能发挥H11免疫原性,有待深入研究。
[1] 黑龙江省畜禽寄生虫区系调查协作组.黑龙江省畜禽寄生虫区系调查研究[J].黑龙江畜牧兽医,1986(合刊):2-6.
[2] 王春仁,马桂芬,赵金萍,等.黑龙江西部羊寄生虫调查及控制技术建立[J].黑龙江八一农垦大学学报,2005,17(4):53-57.
[3] 周庆民,仇建华,曲家华,等.齐齐哈尔市羊寄生虫感染情况调查[J].中国兽医寄生虫病,2006,11(4):23-26.
[4] Smith T S,Graham M,Munn E A,et al.Cloning and characterization of a microsomal aminopeptidase from the intestine of the nematodeHaemonchus contortus[J].Biochimica et Biophysica Acta,1997,1338:295-306.
[5] 杜爱芳,李孝军,侯玉慧,等.捻转血矛线虫H.contortus ZJ株H11蛋白基因克隆及序列分析[J].畜牧兽医学报,2005,36(4):87-390.
[6] 严若峰.捻转血予线虫H11抗原cDNA基因克隆、表达及山羊免疫保护性试验[D].南京:南京农业大学,2004.
[7] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[8] 张红丽,姜小磊,周前进,等.捻转血矛线虫H11部分功能域基因原核表达与分析[J].浙江大学学报:农业与生命科学版,2008,34(6):591-596.

