蛋氨酸脑啡肽对GM-CSF诱导的小鼠骨髓来源树突状细胞TLR-4和TNF-α表达影响
刘金玲,单风平
(1.沈阳农业大学畜牧兽医学院,沈阳 110866;2.中国医科大学免疫教研室,沈阳 110001)
树突状细胞(Dendritic cell,DC)是目前所知机体内功能最强大的抗原提呈细胞,参与机体多种自身免疫性疾病、免疫缺陷病、肿瘤及炎症反应病理过程,在机体抗感染免疫及肿瘤免疫应答过程中起着有重要作用[1]。Toll样受体(Toll like receptors,TLRs)是一种模式识别受体,在细胞活化信号转导中起重要作用,是联系天然免疫与获得性免疫桥梁。研究表明,TLR4(Tol-l like receptor 4)可直接或间接结合病原体,通过细胞吞噬和内化活动,将病原体及其产物清除,还可诱导防御素和NO表达,因此TLR4在天然免疫中起重要作用[2-4]。
肿 瘤坏死因子-a(Tumor Necrosis Factor-a,TNF-a)是一种主要由活化单核巨噬细胞和T淋巴细胞产生多效性细胞因子,主要作用于免疫细胞调节,可诱导细胞凋亡,炎症反应及抑制肿瘤和病毒复制,在疾病感染过程中有重要监测意义[5-6]。蛋氨酸脑啡肽(Methionine Enkephalin,MENK)联系神经、免疫两大系统,是重要细胞因子,具有独特生物学活性,机体免疫细胞表面广泛存在其受体[7-8],MENK通过与受体相互作用增强天然免疫系统细胞如自然杀伤细胞、单核细胞、巨噬细胞和获得性免疫系统细胞如T细胞活性,促进细胞因子释放等,从而起到免疫调节作用[9]。
关于MENK对树突状细胞功能研究,国内外鲜有报道,本试验通过体外诱导培养骨髓来源树突状细胞,观察蛋氨酸脑啡肽对GM-CSF诱导的骨髓来源树突细胞表达TLR-4和TNF-α影响,探明TLR4和促炎症因子TNF-α表达变化情况,从而探讨蛋氨酸脑啡肽对树突状细胞免疫功能作用调节机制,为临床研究提供试验基础。
1 材料与方法
1.1 材料
6~8周C57BL/6小鼠(购自上海实验动物研究所);RPMI-1640完全培养基(含L-谷氨酰胺)、胎牛血清(购自Hyclone公司);荧光素标记的小鼠单抗:CD11c-FITC(购自Biolegend公司);重组小鼠GM-CSF(rmGM-CSF),IL-4(购 自 Biolegend 公司);分装后于-20℃保存备用;蛋氨酸脑啡肽(MENK)由中国医科大学免疫学教研室提供;RT-PCR Kit、TRIzol、琼脂糖(购自TaKaRa公司);兔抗鼠TNF-α,兔抗鼠TLR-4多克隆抗体、SABC、DAB显色试剂盒(购自武汉博士德公司);二抗IgG-HRP(购自美国Santa Cruz公司)。
1.2 方法
1.2.1 细胞培养
将7~8周龄的正常C57BL/6鼠颈椎脱位处死,无菌条件下取完整股骨、胫骨,用RPMI-1640培养液将骨髓细胞冲出,收集骨髓细胞悬液经离心,红细胞裂解再次离心后将细胞用RPIM1640培养基悬浮,分装6孔培养板,每孔106个·mL-1。每孔中别加入不同诱导剂置于含5%CO2,饱和湿度,37℃培养箱中培养,隔天半量换液,并用倒置显微镜观察不同时间点树突状细胞形态变化。
1.2.2 试验分组
在培养的过程中,将细胞分为如下各组,施以不同的刺激条件。①RPMI-1640空白对照组;② GM-CSF(10 ng·mL-1)、 IL-4(5 ng·mL-1)和MENK (10~12 mol·L-1)共刺激组(MENK+G+I);③ GM-CSF(10 ng·mL-1)和 IL-4(5 ng·mL-1)组(G+I)。培养至第7天,用吸管轻轻吹打后收集所有悬浮细胞,经流式细胞仪鉴定BM-DCs的纯度。
1.2.3 RT-PCR法检测树突状细胞TLR-4和TNF-αmRNA的表达
利用Primer Premier 5.0软件设计PCR引物,引物均由TaKaRa公司合成,PCR引物见表1。
1.2.3.1 细胞总RNA的提取
各组细胞加入TRIzol裂解液,转移到1.5 mL离心管中,加入0.2 mL氯仿,离心,吸取上层水相,加等量的异丙醇沉淀RNA,离心,缓慢加人750 μL乙醇洗涤,离心,空气风干后加入DEPC水溶解。紫外分光光度计测定波长260及280 nm RNA A值,计算RNA的浓度和纯度,取0.5 μg RNA用于RT-PCR。
1.2.3.2 cDNA合成
20 μL 体系中含,10×RT Buffer 2 μL,MgCl2(25 mmol·L-1) 4 μL,RNase Inhibitor(40 U·μL-1)0.5 μL,dNTP Mixture(10 mmol·L-1)1 μL,Oligo(dT)-Adaptor Primer 1 μL(2.5 pmol·μL-1), RNase Free dH2O 6.5 μL,总RNA样本1 μL,AMV Reverse Transcriptase 1 μL(5 U·μL-1)。反应条件:30 ℃ 10 min,65℃ 50 min,95℃ 5 min,5℃ 5 min。
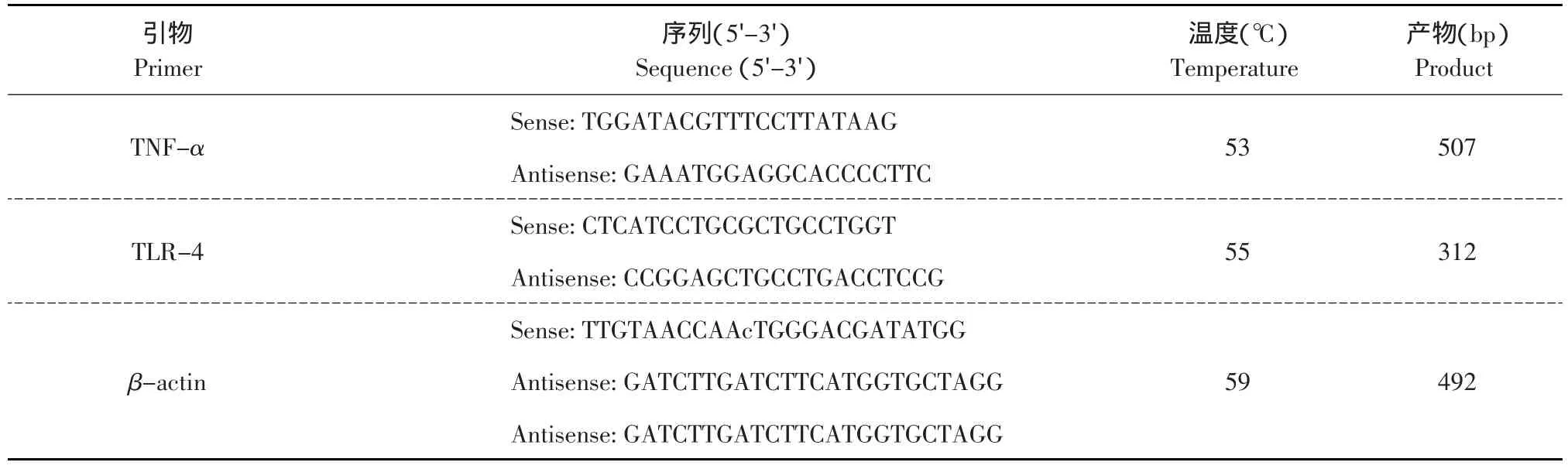
表1 PCR引物Table 1 PCR primer
1.2.3.3 半定量RT-PCR
在 25 μL 体系中含 RNase Free dH2O 12.5 μL,5×PCR Buffer 5 μL,TNF-α,TLR-4及β-actin的上下游引物各 0.5 μL,cDNA 5 μL,Taq酶 0.5 μL,dNTP Mixture(10 mmol·L-1)1 μL。循环参数为94 ℃预变性2 min,94℃变性30 s,退火温度30 s,72℃延伸30 s,30个循环,72℃延伸10 min 4℃保存。
各组取10 μL PCR扩增产物进行琼脂糖凝胶电泳,在Gelpro32凝胶成像系统上进行分析,以各组目的基因条带和相应β-actin条带光密度的比值作为相应基因mRNA的相对定量表达水平。
1.2.4 ELISA法检测树突状TNF-α蛋白的表达
每组做4个复孔。各组处理结束后收集培养液于酶标板,37℃孵育2 h,PBS清洗2次,加鼠源TNF-α抗体 100 μL·孔-1,37 ℃孵育 2 h,洗板 3次,加抗鼠HRP-IgG 100 μL·孔-1,37 ℃孵育1 h,洗板,分别加显色液A和B各50 μL·孔-1,37℃孵育 15 min,加终止液 100 μL·孔-1。酶标仪在450 nm波长处检测各孔吸光度。
1.2.5 Western-Blot检测TLR-4蛋白的表达
收集各组培养的成熟的BM-DC,加入2×SDS裂解后,取50 μg蛋白质样品加入到样品孔中进行SDS聚丙烯酸胺凝胶电泳,然后根据凝胶面积按300 mA接通电流进行转膜、封闭、兔抗鼠TLR-4一抗孵育过夜,兔抗鼠IgG-HRP抗体(1∶2 000稀释),孵育2 h,最后用DAB显色剂进行显色。
1.2.6 统计学处理
用SPSS(17.0)统计软件对数据进行处理,数据以平均值±标准差表示,组间比较采用单因素方差分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 BM-DCs纯度的流式细胞仪鉴定
取各诱导组细胞悬液0.1 mL至流式管中,加入荧光标记的CD11c-FITC,混匀,4℃避光染色,洗涤后上机检测,结果显示MENK+G+I组树突状细胞的纯度为95.09%,高于G+I组(90.89%),而1640对照组的纯度只有9.08%。表明MENK在体外能够增加骨髓来源树突状细胞的诱导纯度(见图1)。
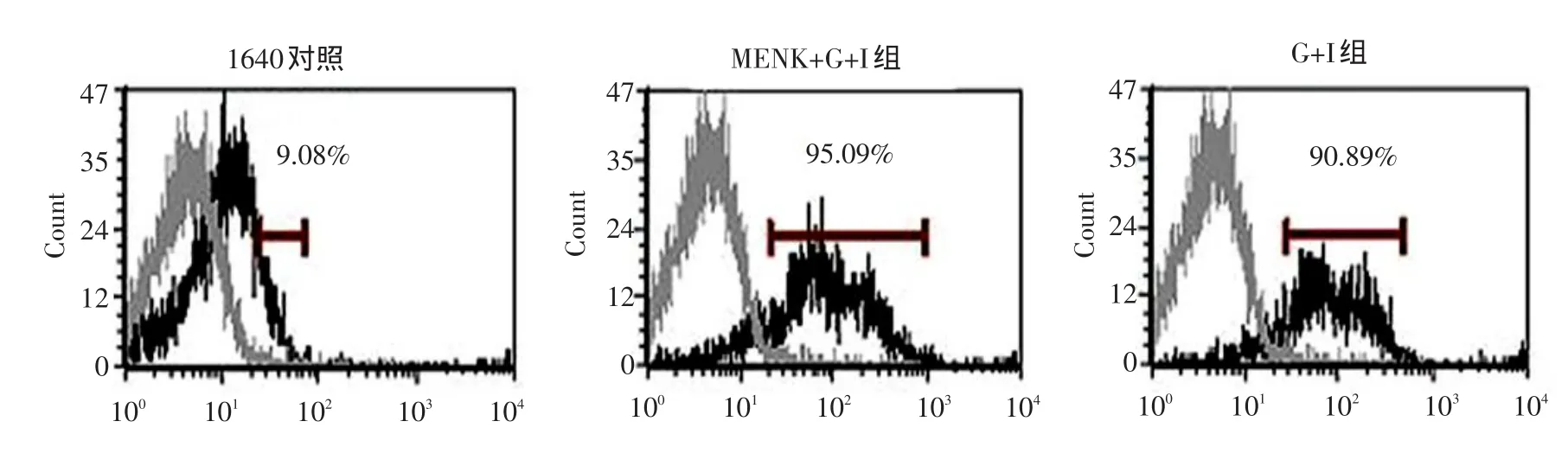
图1 各组树突状细胞纯度流式分析Fig.1 Purity analysis of DCs by FCM
2.2 MENK对GM-CSF和IL-4诱导的骨髓来源树突状细胞TNF-α和TLR-4mRNA的影响
RT-PCR结果表明经MENK与GM-CSF和IL-4(MENK+G+I)协同诱导骨髓来源树突状细胞TNF-α和TLR-4 mRNA的表达均增多,其中TLR-4 mRNA丰度值与1640对照组相比具有极显著性差异(P<0.01),与GM-SCF和IL-4(G+I)诱导组相比差异显著,具有统计学意义(P<0.05),而TNF-αmRNA丰度值(大于1640对照组,差异极显著(P<0.01),与G+I组相比差异显著(P<0.05)。上述数据表明MENK可以从基因水平上调树突状细胞TNF-α和TLR-4的表达(见图2、3)。
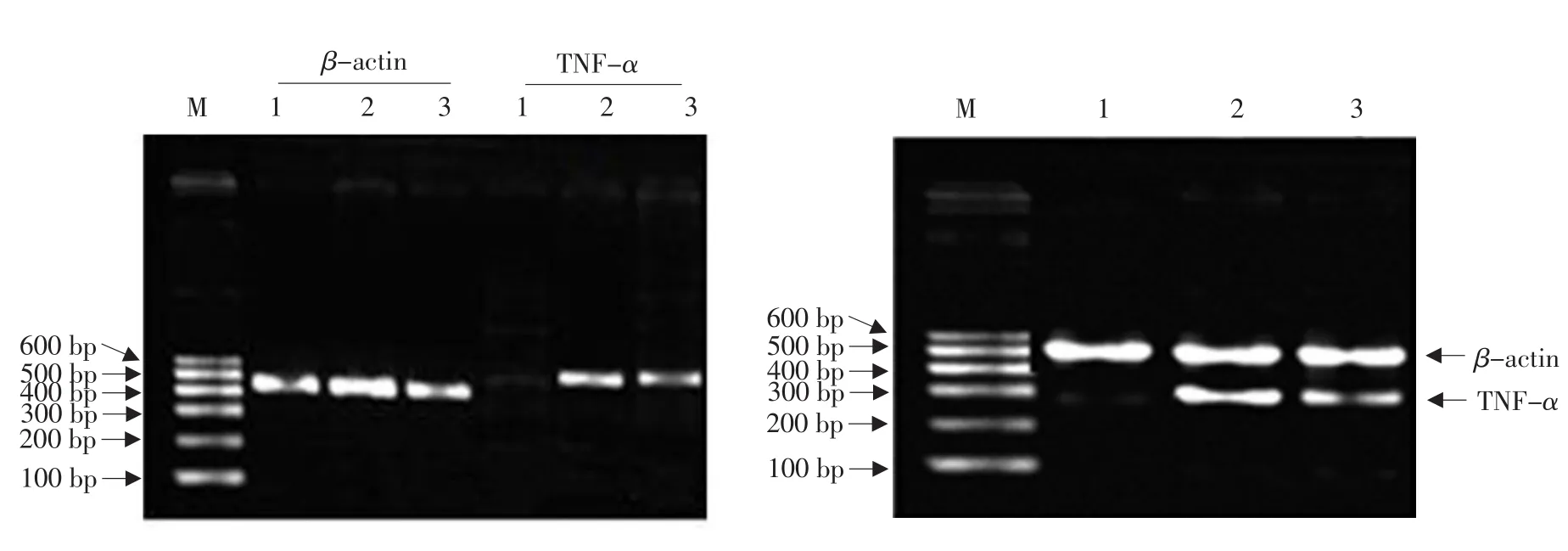
图2 各组骨髓来源树突状细胞TNF-α和TLR-4 mRNA表达的RT-PCR结果Fig.2 RT-PCR analysis at mRNA levels of of TNF-α and TLR-4 for BM-DCs
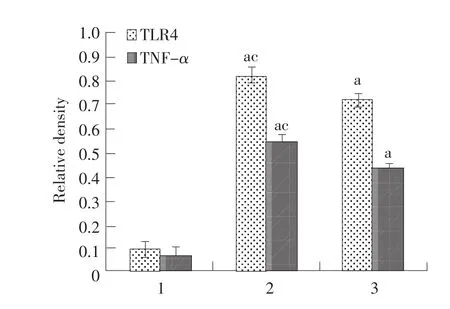
图3 各组骨髓来源树突状细胞TNF-α和TLR-4 mRNA表达的RT-PCR结果Fig.3 Analysis of histogram at abundance of TNF-α and TLR-4 for BM-DCs
2.3 MENK对GM-CSF和IL-4诱导的骨髓来源树突状细胞TNF-α蛋白表达的影响
结果表明,与RPMI1640对照组相比,MENK+G+I组中TNF-α水平有极显著提高(P<0.01);与G+I组相比差异显著(P<0.05),数据表明,MENK可上调的细胞因子TNF-α,MENK-12定向诱导Th1型细胞反应(见表2)。

表2 MENK对G+I诱导骨髓来源树突装细胞TNF-α表达的影响Table 2 Effect of MENK on TNF-α of BM-DCs induced by GM-CSF and IL-4
2.4 MENK对GM-CSF和IL-4诱导的骨髓来源树突状细胞TLR-4蛋白表达的影响
收集不同诱导条件下培养的成熟的BM-DCs,提取蛋白质后,采用Western-Blot方法从蛋白水平检测BM-DCs TLR-4的表达情况。结果表明,MENK+G+I组诱导培养的BM-DCs其TLR-4蛋白的表达丰度明显高于RPIM-1640对照组,差异极显著(P<0.01),高于G+I组,差异显著(P<0.05),提示MENK可上调BM-DCs TLR-4蛋白的表达(见图4)。
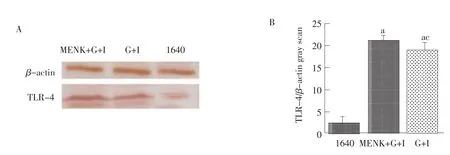
图4 体外诱导骨髓来源树突状细胞TLR-4的表达Fig.4 Expression of TLR-4 of BM-DCs in vitro
3 讨论与结论
DC是免疫应答启动因子和调节因子,是T、B细胞有效刺激因子。近年来,DC在机体免疫系统中重要作用显现,在移植排斥反应、肿瘤免疫治疗、感染性疾病和自身免疫性疾病等的诊治方面均有研究报道,同时对DC生物学特性、与某些疾病发生、预后等关系也有进一步深入研究[10-11]。成熟DC表达高水平的主要组织相容性复合体(MHC)分子,并能分泌白细胞介素-l(IL-1)、白细胞介素-6(IL-6)、干扰素-a(IFN-α)、肿瘤坏死因子a(TNF-a)等细胞因子[12],其中TNF-α是TNF家族重要成员之一,是具有广泛生物学活性的细胞因子,能诱导炎症因子产生导致细胞凋亡[13]。
Toll样受体是一种模式识别受体,广泛分布在免疫细胞表面,在细胞活化信号的转导中起重要作用,是联系天然免疫与获得性免疫的桥梁,能特异性地识别病原体相关分子模式,激发动物天然免疫和获得性免疫的早期免疫反应,这种特性使Toll样受体成为诱导有效免疫反应对抗病原或自身异常重要候选基因,而Toll样受体4(TLR-4)是机体对革兰氏阴性菌表达的脂多糖应答的主要受体,TLR-4活化后,激活NF-κB等转录因子,可引起TNF-α、NO等多种炎症介质和细胞因子的表达和释放[14],并激活获得性免疫,在炎症反应中发挥重要作用。
MENK是一类联系神经、免疫两大系统,通过作用到免疫细胞阿片受体上发挥生物学活性细胞因子。Burger等证实MENK具有增强NK细胞活性、刺激的T细胞增殖、显著增强CTL细胞活性[15]、刺激大鼠腹腔巨噬细胞H2O2和NO产生,协助巨噬细胞杀菌和抗肿瘤、调控IL-2、IL-1、IL-4和IFN-γ等细胞因子分泌及抑制细胞生长功能。MENK对免疫系统的调控功能已被大量体外、体内试验所证实[16]。
本试验发现经MENK刺激后,骨髓来源树突状细胞纯度为95.09%,高于1640对照组和G+I组,而且TLR-4和TNF-α表达在基因水平和蛋白水平均显著增加,与其他试验组相比差异显著,具有统计学意义。TNF-α处于炎症级反应中心环节,是TLR4/NF-κB信号通路中下游信号,TNF-α表达量多少是MENK发挥免疫调节作用进而干预肿瘤、病毒发生、发展的靶分子之一。
本试验结果提示,在MENK诱导作用下BM-DC增加阿片受体表达,从而上调TLR-4表达。这一现象与活化后DCs在亚群、表型和细胞因子分泌模式等方面差异性有关,但其确切机理尚待进一步阐明。综上,树突细胞表面的阿片受体是介导小鼠DCs活化的重要模式识别受体,间接通过上调TLR-4表达从而激活NF-κb信号通路,上调Th1型细胞因子TNF-α等表达,诱导Th1细胞反应,进一步深入探讨MENK对树突状细胞免疫功能调控影响,为揭示MENK抗疾病作用机制提供试验依据。
[1] Stephan B,Gordin Z,Stefanie K,et al.Epigenetic regulation of dendritic cell differentiation and function by oxidized phospholipids[J].Blood,2009,114:5481.
[2] Akira S,Takeda K,Kaisho T.Toll-like receptors:Critical proteins linking innate and acquired immunity[J].Nat Immunol,2001(8):675-680.
[3] 蒋宏伟,凌均,任邦鹏.炎症信号受体TLR4在大鼠正常牙髓和牙周组织中的分布及意义[J].临床口腔医学杂志,2006,22(6):87-90.
[4] Chow J C,Young D W,Golenbock D T,et al.Toll-like receptor-4 mediates lipopolysaccharide-induced signal transduction[J].J Biol Chem,1999,274(16):10689-92.
[5] 崔广智,金树梅,赵桂峰,等.丹参酮ⅡA对TNFα诱导的ECV304细胞NFκB、IκB-α表达及粘附分子ICAM1、VCAM1mRNA表达的影响[J].中国药理学通报,2007,23(12):1671-1675.
[6] 李小琼,金徽,陶凤,等.脂多糖诱导小鼠腹腔巨噬细胞TNF-αmRNA、iNOSmRNA的表达[J].遵义医学院学报,2009,32(5):445-447.
[7] 王宁,夏燕杰,单风平.蛋氨酸脑啡肽对树突状细胞表型及功能的影响[J].中国免疫学杂志,2010,26:814-818.
[8] Plotnikoff N P,Faith R E,Murgo A J,et al.Methionineenkephalin:A new cytokine-human studies[J].Clin Immunol Immunopathol,1997,82:93-101.
[9] Stanojevió S,Mitió K,Vujió V,et al.The influence of stress and methionine-enkephalin on macrophage functions in two inbred rat strains[J].Life Sci,2007,80:901-909.
[10] Tanzilya Khayrullina,Jui-Hung Yen,Huie Jing,et al.Adenosine receptors in regulation of dendritic cell differentiation and function[J].Blood,2008,112(5):1822-1831.
[11] Tracey A S,Enayat N,Beverly J R,et al.Dendritic cell differentiation induced by a self-peptide derived from apolipoprotein E1[J].J Immunol,2008,18110):6859-6871.
[12] Sallusto F,Lanzavecchia A Effect presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downergulated by tumor necrosis factor alpha[J].J Exp Med,1994,179:1109-1118.
[13] Fanger N A,Maliszewski C R,Schooley K,et al.Human dendritic cells mediate cellular apoptosis via tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)[J].J Exp Med,1999,190(8):1155-1164.
[14] Beutler B.Toll-like receptor:How they work and what they do[J].Current Opinion in Hematology,2002,9(1):2-10.
[15] Burger R A,Warren R P,Huffman J H,et al.Effect of methionine enkephalin on natural killer cell and cytotoxic T lymphocyte activity in mice infected with influenza A virus.[J]Immuno pharmacol Immunotoxicol,1995,17:323-34.
[16] Vujió V,Stanojevió S,Dimitrijevió M.Methionine-enkephalin sti-mulates hydrogen peroxide and nitric oxide production in rat peritoneal macrophages:interaction of mu,delta and kappa opioid receptors[J].Neuro immunomodulation,2004(11):392-403.

